2. 中国食品药品检定研究院实验动物资源研究所, 北京 100079;
3. 山东省食品药品检定研究院, 济南 250101
2. Institute for Laboratory Animal Resources, National Institutes for Food and Drug Control, Beijing 100079, China;
3. Shandong Institutes for Food and Drug Control, Jinan 250101, China
药物临床前安全性评价与公众的用药安全息息相关,药物潜在的致癌性评价是临床前药物安全性评价的重要组成部分,而动物模型则是评估药物致癌风险性不可或缺的重要手段。《经济合作与发展组织指导原则》(Organization for Economic Co-operation and Development,OECD TG 451)规定,药物的潜在致癌性体内评价方法是通过2年大鼠和小鼠长期实验来完成的[1]。我国国家食品药品监督管理总局药品审评中心于2009年也制定了《药物致癌实验必要性的技术指导原则》[2],用于指导我国使用啮齿类动物进行药物致癌性评价研究。
目前长期致癌实验存在以下不足:动物用量大、投入人力及资金成本高、耗时长,而且容易受到啮齿类自发肿瘤的干扰,结果准确性差。鉴于此,探索周期短、耗资少、准确可靠的致癌实验方法势在必行。转基因或基因敲除动物模型用于致癌性评价具有时间短、费用省、结果可靠、动物使用量少等特点。1998年,人用药品注册技术规定国际协调会议(International Conference on Harmonization of Requirements for Registration Pharmaceuticals for Human Use,ICH)ICH S1B指导原则要求药物致癌性评价除了在大鼠中进行2年的致癌性实验,还需要开展小鼠的长期致癌性实验,或以一个短期或中期的啮齿类动物体内实验来替代小鼠的长期致癌性实验,中短期致癌试验的试验期限一般为3~6个月,所使用的动物包括基因修饰小鼠模型,例如Tg.rasH2转基因模型、P53+/-基因敲除模型、Tg.AC转基因模型及XPA+/-基因敲除模型[3-5]。目前,P53+/-基因敲除模型已经得到ICH、FDA、欧洲专利药品委员会、日本厚生省认可,成为新药创制体系中重要一环。由于知识产权和昂贵的价格限制了我国使用P53+/-基因敲除模型用于我国临床前药物安全性评价和法定检验工作。基于以上原因,通过基因敲除的方法自主建立了P53+/-敲除小鼠模型并命名为B6-Trptm1/NIFDC,并采用阳性致癌物尿烷验证P53+/-敲除小鼠模型是否比野生型C57BL/6小鼠更敏感,以明确该模型能否作为临床前药物安全性评价致癌性实验短期体内实验的候选模型。
1 材料与方法 1.1 实验动物本研究所用杂合型P53+/-敲除小鼠为中国食品药品检定研究院实验动物资源研究所自主建立。建立方式为在C57BL/6来源的ES细胞中,通过打靶技术敲除p53基因第2~5外显子。获得的首建鼠经过PCR基因型鉴定、Southern杂交鉴定后与普通C57BL/6小鼠杂交,后代再通过PCR筛选获得基因敲除动物(命名为B6-Trptm1/NIFDC)[6]。繁育环境为SPF级,实验期饲养在清洁级环境中。所有实验在本单位实验动物伦理委员会指导下完成。
1.2 试剂P53+/-敲除小鼠建立及PCR筛选所用试剂均购自Invitrogen公司;组织固定及制片所需的乙醇、甲醛、二甲苯、石蜡均购自北京化学工业集团有限公司。
1.3 主要仪器智能化组织脱水机(莱卡ASP300)、自动包埋机(樱花TEC5EMJ-2)、滑动式切片机(樱花IVS-410)、自动染色机(樱花DRS-2000)等。
1.4 验证实验设计根据阳性致癌剂尿烷致癌性相关文献报道[7-8],P53+/-敲除小鼠尿烷验证实验设计分为3个组:阴性对照组(C57BL/6野生型小鼠,给予生理盐水)、尿烷组1(P53+/-敲除小鼠,给予1 000 mg·kg-1尿烷)和尿烷组2(C57/B6野生型小鼠,给予1 000 mg·kg-1尿烷),所有动物均为6周龄左右,每组动物数均为20只,雌雄各半。本实验共给药3次,即实验期第1天、第4天、第7天分别给药,给药方式为腹腔注射。试验期间观察动物的一般症状,给药后第8周开始每周一次肿瘤触诊观察肿瘤的发生和发展,如肿瘤出现的时间、部位、大小、质地和进展等情况。
1.5 大体及组织病理学检查给药后6个月后进行计划剖解,并对肿瘤组织和发现异常的组织器官用10%中性缓冲福尔马林溶液固定,固定后组织经修块取材,逐级酒精脱水,石蜡包埋,滑动切片机切片(厚约3 μm),经苏木精-伊红(HE)染色,光镜检查。
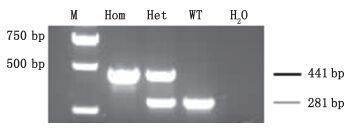
2 结果与分析 2.1 P53+/-敲除小鼠PCR鉴定结果在C57BL/6来源的ES细胞中,通过打靶技术敲除p53基因的第2-5外显子后对获得的p53基因敲除小鼠进行PCR基因型鉴定。在进行基因型鉴定时,根据打靶载体设计了两对区分纯合、杂合基因型的引物,即441 bp、281 bp条带为目的条带,如果扩增出441 bp、281 bp条带说明所构建的p53基因敲除小鼠是杂合型;只扩增出441 bp条带说明所构建的p53基因敲除小鼠是纯合型;只扩增出281 bp条带说明是野生型小鼠。从图 1的PCR结果可以看出,在441 bp、281 bp处扩增出了目的条带,说明成功构建了杂合型p53基因敲除小鼠,为后续尿烷验证实验的开展奠定了基础。
|
M. Marker Hom. p53纯合小鼠(p53 homozygous mice)Het. p53杂合小鼠(p53 heterozygous mice)WT.野生型小鼠(wild type mice) 图 1 p53基因敲除小鼠的PCR检测结果 Figure 1 PCR detection results of p53 gene knockout mice |
给药后第3周及第24周,尿烷组1有2只动物死亡,动物生存率为90%;尿烷组2有1只动物死亡,生存率均为95%;阴性对照组动物的生存率是100%。
2.3 临床症状观察结果在整个实验过程中,尿烷组1和尿烷组2的动物未见明显的临床异常症状。
2.4 大体剖检结果尿烷组1动物肝脏可见暗红色斑块及暗红色凹陷,病变发生频度分别为2/18和8/18;尿烷组1和尿烷组2动物肺脏出现小囊肿,病变发生频度分别为1/18和1/19;尿烷组1的动物还可见脾脏体积增大,颌下腺暗红色斑块,病变发生频度均为1/18;阴性对照组未见上述病变。大体剖检结果见表 1。
|
|
表 1 与给予尿烷相关的各组动物的大体病变 Table 1 Gross lesions of all animals associated with the administration of urethane |
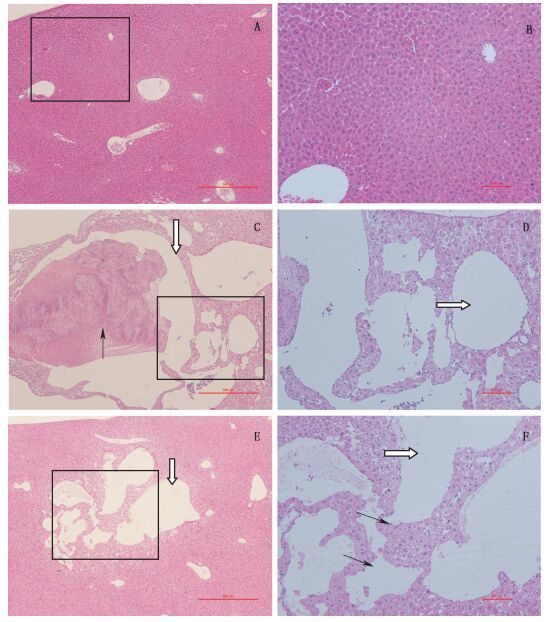
尿烷组1、尿烷组2动物肝脏的组织病理学变化为血管扩张,病变发生频度分别为17/18、7/19(见表 2),尿烷组1肝脏血管扩张发生频度及病变程度高于烷组2(见表 2、3);阴性对照组动物的肝脏未见上述病变。从图 1可以看出,病变部位的肝细胞轻度肿胀,肝窦结构混乱,肝窦内皮基底膜增厚,肝窦内壁的单层内皮细胞未见明显的异型性。尿烷组1的肝脏扩张的血管内还可见血栓形成(见表 3)。
|
|
表 2 P53+/-敲除小鼠和野生型小鼠腹腔注射尿烷后诱发的病变 Table 2 Lesions induced by intraperitoneal injection of urethane in P53+/-knockout mice and wild type mice |
|
|
表 3 P53+/-敲除小鼠和野生型小鼠肝脏病变程度的比较 Table 3 Comparison of lesion grade in liver between P53+/-knock out mice and wild type mice |
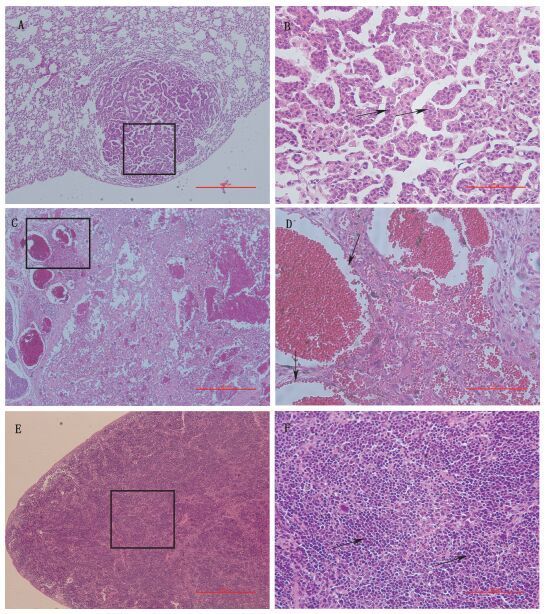
尿烷组1、尿烷组2动物的肺脏均有肺腺瘤发生,病变发生频度分别为6/18、2/19。病变部位可见单层立方或柱状上皮排列成乳头或腺样结构,上皮细胞形态较一致,少见多形性或异型性,与邻近组织界限清楚。尿烷组1的动物还出现肺脏腺瘤样增生,病变频度1/18,肺泡腔充满柱状支气管上皮细胞,胞浆嗜碱性增强,病变程度极轻度,呈腺瘤样增生。阴性对照组未见上述病变(见表 2和图 2)。
|
左侧图片为100倍镜下观察结果,右侧图片为左侧图片黑色方框区域200倍镜下观察结果(all the left panels are the examination results of 100 power view. All the right panels are the examination results of 200 power view of the areas of the black frames.) A、B.阴性对照组(negative control group)C、D.尿烷组1(黑色箭头所示为形成的血栓,白色箭头所示为扩张的血管)(urethane group 1)(black arrows indicate thrombus formation and white arrows indicate the angiectasis of liver)E、F.尿烷组2(白色箭头所示为扩张的血管,黑色箭头所示为扩张血管的内皮细胞)(urethane group 2)(white arrows indicate the angiectasis of liver and black arrows indicate the endothelial cells of distent blood vessels) 图 2 尿烷致各组实验动物肝脏血管扩张的组织病理学检查结果 Figure 2 Histopathological findings of liver angiectasis after administration of urethane in all groups |
尿烷组1动物颌下腺发生血管瘤,病变频度1/18,病变部位可见内皮细胞增生形成的血管内充满红细胞,血管内皮细胞分化良好,未见异型性(见表 2和图 2)。其余各组未见上述病变。
|
侧图片为100倍镜下观察结果,右侧图片为左侧图片黑色方框区域200倍镜下观察的结果(all the left panels are the examination results of 100 power view. All the right panels are the examination results of 200 power view of the areas of the black frames),A、B.肺腺瘤的HE切片显微照片(黑色箭头所示为增生的立方或柱状上皮排列成乳头状或腺样结构)(HE slide photomicrograph of lung adenoma)(black arrows indicate proliferation of cuboidal or columnar epithelial cells arranged in papillary or adenoid structure)C、D.颌下腺血管瘤的HE切片显微照片(黑色箭头所示为增生的血管内皮)(HE slide photomicrograph of submandibular gland hemangioma)(black arrows indicate proliferation of vascular endothelium)E、F.脾脏淋巴瘤的HE切片显微照片(黑色箭头所示为增生的淋巴母细胞)(HE slide photomicrograph of spleen lymphoma)(black arrows indicate neoplastic proliferation of lymphoblasts) 图 3 尿烷致P53+/-敲除小鼠组织病理学变化检查结果 Figure 3 Histopathological findings after administration of urethane in P53+/-knockout mice |
左尿烷组1动物脾脏发生恶性淋巴瘤,病变频度1/18,整个脾脏可见大小不等的处于不同分化状态的淋巴样细胞,可见核分裂相(见表 2和图 2)。其余各组未见上述病变。
3 讨论p53基因是一种肿瘤抑制基因(tumor suppressor gene),可促进细胞凋亡、维持基因组稳定及抑制肿瘤血管生成[9]。纯合的P53-/-敲除小鼠虽然可以正常发育长至成年,但一般在3-6月龄时因发生肿瘤而死亡[10]。p53基因是迄今发现的与人类肿瘤发生相关性最高的基因,在所有恶性肿瘤中,50%以上会出现该基因的突变,由此认为通过p53等位基因的敲除所构建的P53+/-敲除小鼠模型可以完全模拟致癌物致癌过程的发展及所产生肿瘤的特征性病变[11]。P53+/-敲除小鼠被看作是替代2年大鼠或小鼠长期致癌实验来评价化合物致癌性的短期模型,因P53+/-敲除小鼠对致癌物的敏感性比正常小鼠高,所以比传统小鼠致癌实验所使用的动物少,实验周期也短。而且,杂合的P53+/-敲除小鼠在9~12月龄前自发性肿瘤的发生率低,研究人员很容易确定与给予化合物相关的肿瘤性病变。12月龄后肿瘤发生率升高,到18月龄,大概50%的P53+/-敲除小鼠可发生肿瘤,主要是骨肉瘤、恶性淋巴瘤及血管肉瘤[11-12]。所以本研究采用6周龄左右的P53+/-敲除小鼠,在给予阳性致癌剂尿烷后6个月后进行动物各脏器的组织病理学检查。
P53+/-敲除小鼠模型在国际上已经用于致癌机制的基础研究,如p53基因在致癌机制中的作用以及利用该模型鉴定潜在的致癌物。20多年来,科研人员就尿烷的致癌性在啮齿类动物中积累了丰富的资料。有报道称尿烷可导致P53+/-敲除小鼠血管非增生性、增生性及肿瘤病变发生,以C57BL/6为背景的P53+/-敲除小鼠在给予尿烷后其肝脏可发生血管扩张、良性血管瘤及恶性血管肉瘤,尤以肝脏血管扩张的发生率较高,肺腺瘤、淋巴系统的恶性肿瘤发生率较低[12-15]。Carmichael等以P53+/-敲除小鼠为模型的尿烷对血管组织的致癌性研究表明,在每天分别给予10 mg·kg-1和100 mg·kg-1尿烷(每组20只动物),连续给药6个月后,P53+/-敲除小鼠中10 mg·kg-1组和100 mg·kg-1的小鼠肝脏血管扩张的发生率分别为40%和45%,表现为血管腔扩大,单层内皮细胞未见增生及异型性,腔内充有红细胞;100 mg·kg-1组中有10%动物的肝脏出现血管瘤样内皮细胞增生的病变;发生脉管系统肿瘤、良性血管瘤及恶性血管瘤的动物占90%,同时发生良性血管瘤和恶性血管瘤的动物占20%;100 mg·kg-1组肺腺瘤的发生率为25%,10 mg·kg-1和100 mg·kg-1组胸腺恶性淋巴瘤的发生率分别为5%和15%[16]。本研究中给予尿烷后P53+/-敲除小鼠和野生型C57BL/6小鼠肝脏的病理变化主要是血管扩张,尿烷组1的P53+/-敲除小鼠肝脏血管扩张病变发生率为94.4%,尿烷组2的野生型C57BL/6小鼠血管扩张病变发生率为36.8%,未见肝脏血管瘤和血管肉瘤的病变,可能的原因是本实验中尿烷剂量是1 000 mg·kg-1,一共给药3次,单次给药剂量虽大,但给药次数少,未能引起肝脏产生典型的血管瘤或血管肉瘤病变,但血管扩张较严重的部位也可见单层、均一突出且增生的血管内皮细胞,程度较血管瘤的内皮细胞病变轻,还可见血栓形成。尿烷组1肺腺瘤的发生率为33.3%,较Carmichael等报道的肺腺瘤发生率(25%)高,尿烷组2肺腺瘤的发生率为10.5%。脾脏恶性淋巴瘤和颌下腺血管瘤的发生率均为5.6%;目前未见尿烷致P53+/-敲除小鼠肿瘤研究中脾脏恶性淋巴瘤及颌下腺血管瘤的相关报道。
从本实验的大体病变观察结果和显微镜检查结果来看,尿烷可以导致尿烷组1和尿烷组2的动物肝脏血管发生扩张,而且尿烷组1上述病变的发生率远远高于尿烷组2,可见P53+/-敲除小鼠对尿烷的敏感性要大于其背景来源的野生型C57BL/6小鼠;我们还发现尿烷组1动物肝脏血管扩张的严重程度要高于尿烷组2,在肝脏扩张的血管局部较严重区域可见均一突出且增生的血管内皮细胞,并可见血栓形成(见图 2和表 3)。因为尿烷主要引起实验动物肝脏、肺脏等部位的肿瘤,很难在临床症状观察和临床触诊时发现有肿瘤形成,不容易判断实验动物发生肿瘤的时间,因而判断P53+/-敲除小鼠对尿烷的敏感性只能通过大体病变观察和显微镜检查结果来综合分析判断。从上述实验结果可以看出,本实验中所使用的自主建立的P53+/-敲除小鼠在给予尿烷后可引起肝脏血管扩张及肺腺瘤等病变,P53+/-敲除小鼠对尿烷的敏感性高于野生型C57BL/6小鼠,该模型可望将来作为临床前药物安全性评价致癌性短期体内实验候选模型之一,还需要采用更多的致癌物进行进一步的验证试验。
| [1] |
OECD Guidelines for the Testing of Chemicals, Section4: Health Effects, Test No. 451, Carcinogenicity Studies[EB/OL]. 1981[1981-5-12]. http://www.OECD.org.
|
| [2] |
国家食品药品监督管理局药品审评中心. 药物致癌实验必要性的技术指导原则[EB/OL]. 2009[2009-12-30]. http://www.cde.org.cn. Center for Drug Evaluation, State food and drug administration. The technical guideline for the necessity for the carcinogenicity study of drugs[EB/OL]. 2009[2009-12-30]. http://www.cde.org.cn. |
| [3] |
ICH harmonised tripartite guideline S1B: testing for carcinogenicity of pharmaceuticals[EB/OL]. 1997[1997-7-16]. http://www.ich.org.
|
| [4] |
Gulezian D, Jacobson-Kram D, Mccullough CB, et al. Use of transgenic animals for carcinogenicity testing: considerations and implications for risk assessment[J]. Toxicol Pathol, 2000, 28(3): 482. DOI:10.1177/019262330002800320 |
| [5] |
Shah SA, Paranjpe MG, Atkins PI, et al. Reduction in the number of animals and the evaluation period for the positive control group in Tg.rasH2 short-term carcinogenicity studies[J]. Int J Toxicol, 2012, 31(5): 423. DOI:10.1177/1091581812458957 |
| [6] |
DONEHOWER LA, HARVEY M, SLAGLE BL, et al. Mice deficient for p53 are developmentally normal but susceptible to spontaneous tumours[J]. Nature, 1992, 356(6366): 215. DOI:10.1038/356215a0 |
| [7] |
MASAKAZU O, KEISUKE O, TOMOYUKI W, et al. Susceptibilities of p53 knockout and rasH2 transgenic mice to urethane-induced lung carcinogenesis are inherited from their original strains[J]. Toxicol Pathol, 2005, 33(2): 267. DOI:10.1080/01926230590908231 |
| [8] |
KONSTANTINOS D, SOPHIA PK, CHRYSOUL AA. Allergic inflammation does not impact chemical-induced carcinogenesis in the lungs of mice[J]. Respir Res, 2010, 11: 118. DOI:10.1186/1465-9921-11-118 |
| [9] |
Prives C, Hall PA. The p53 pathway[J]. J Pathol, 1999, 187: 112. DOI:10.1002/(ISSN)1096-9896 |
| [10] |
Storer RD. Current status and use of short/medium term models for carcinogenicity testing of pharmaceuticals—scientific perspective[J]. Toxicol Lett, 2000, 112-113: 557. DOI:10.1016/S0378-4274(99)00227-1 |
| [11] |
Attardi LD, Jacks T. The role of p53 in tumor suppression: lessons from mouse models[J]. Cell Mol Life Sci, 1999, 55(1): 48. DOI:10.1007/s000180050269 |
| [12] |
Ashby J. Alternatives to the 2-species bioassay for the identification of potential human carcinogens[J]. Hum Exp Toxicol, 1996, 15(3): 183. DOI:10.1177/096032719601500301 |
| [13] |
Donehower LA. The p53-deficient mouse: a model for basic and applied cancer studies[J]. Semin Cancer Biol, 1996, 7(5): 269. DOI:10.1006/scbi.1996.0035 |
| [14] |
Harvey M, Mcarthur MJ, Montgomery CA, et al. Spontaneous and carcinogen-induced tumorigenesis in p53-deficient mice[J]. Nat Genet, 1993, 5(3): 225. DOI:10.1038/ng1193-225 |
| [15] |
Ozaki M, Ozaki K, Watanabe T, et al. Susceptibilities of p53 knockout and rasH2 transgenic mice to urethane-induced lung carcinogenesis are inherited from their original strains[J]. Toxicol Pathol, 2005, 33(2): 267. DOI:10.1080/01926230590908231 |
| [16] |
Carmichael NG, Debruyne EL, Bigot-Lasserre D. The p53 heterozygous knockout mouse as a model for chemical carcinogenesis in vascular tissue[J]. Environ Health Perspect, 2000, 108(1): 61. DOI:10.1289/ehp.0010861 |
 2017, Vol. 37
2017, Vol. 37 
