孕三烯酮[1](gestrinone)又称三烯高诺酮,是一种19-去甲基睾丸酮衍生物(结构式见图 1)。具有抗孕激素、抗雌激素及中度抗促性腺激素作用,同时还有弱的雌激素和雄激素作用,临床上主要用于治疗子宫内膜异位症[2]、子宫腺肌瘤[3]和紧急避孕[4]等方面。目前市面上销售的孕三烯酮剂型仅有胶囊剂(进口商品名内美通,国产商品名孕三烯酮胶囊,2.5 mg·粒-1,8粒·板-1×1板·盒-1,每周服用2次),但关于其药代动力学研究方面却未见文献报道。有关孕三烯酮生物基质中检测方法的文献资料也较少,主要有放射免疫法(RIA)[5-6]、GC-MS/MS法[7]、LC-MS/MS法[8]。RIA法因存在放射性污染且操作烦琐,GC-MS/MS法分析成本较高。2种方法均不宜推广使用,本文在参考文献[8]方法的基础上,进一步优化分析条件,大大提高方法的灵敏度和专属性,而且缩短了测定时间。并将该方法应用在巴马小型猪体内的药代动力学及缓释特性的研究,为该制剂的临床应用提供一定的实验数据及相关信息。
|
图 1 孕三烯酮(A)及孕二烯酮(B)的结构 Figure 1 Structures of Gestrinone(A)and Gestodene(B) |
孕三烯酮胶囊(北京紫竹药业有限公司,批号53110111 477,规格2.5 mg·粒-1);孕三烯酮对照品(100982-201101,中国食品药品检定研究院);孕二烯酮对照品(内标,Y0001112,中国食品药品检定研究院);乙腈(Merck,色谱纯),甲酸(Fisher,色谱纯);环己烷、碳酸钠(国药集团试剂有限公司,分析纯),水为自制高纯水。
1.2 实验动物巴马小型猪,雌性,8只,体重(34.5±2.8)kg,购自上海甲干生物科技有限公司,实验动物生产许可证号:SCXK(沪)2010-0028,饲养于第二军医大学动物实验中心,实验动物使用许可证:SYXK-(沪)-2007-0003。实验动物饲养于普通级动物房中,单只单笼,自由饮水、摄食。实验前动物适应性饲养两周。
1.3 实验仪器Agilent 1200高效液相色谱仪,Agilent G6410B型QQQ质谱仪,配有ESI源和Masshunter工作站;Millipore超纯水制备仪;涡旋混合器(其林贝尔仪器制造有限公司);台式低速离心机(Beckman公司);低温台式高速离心机(Thermo公司);氮吹仪(杭州奥盛仪器有限公司);BT125D电子天平(赛多利斯公司)等。色谱柱ZORBAX Extend-C18(2.1 mm×50 mm,5 μm,填料:十八烷基硅烷键合硅胶;Agilent仪器公司)。
2 方法 2.1 巴马小型猪给药和采血健康成年雌性巴马小型猪8只,采用常规口服给药的方法,用开口器打开小型猪嘴巴,卵圆钳夹持胶囊送至喉咙口,洗瓶灌注饮用水使其吞咽,再用开口器打开嘴巴确保药物已被吞服。给药前应禁食8 h,期间自由饮水。孕三烯酮胶囊[9]临床用量为每次1颗,1周2次,2.5 mg·颗-1,设计试验时也采用每次1颗,每周2次口服整颗给药,依据给药频次采集血样,进行分析。分别于给药前0 h,首次给予胶囊后0.5、1、1.5、2、3、4、6、24、48、72 h;第2、3、4、5、7、9、13、17、21次给药后2 h;第6、8、12、16、20、24次给药后96 h;第25次给药后0.5、1、1.5、2、3、4、6、24、48、72、96 h、1周前腔静脉采血,每次采血3 mL置肝素钠抗凝管中。3 500 r·min-1、4 ℃下离心10 min,取上层血浆置-70 ℃保存,待测。用Microsoft Excel进行数据整理,DAS3.0计算首末次给药的药代动力学参数。
2.2 孕三烯酮药代动力学测定 2.1.1 色谱条件色谱柱:Agilent ZORBAX Extend-C18(2.1 mm×50 mm,5 μm);流动相:A相:水(含0.1%甲酸)-B相:乙腈(含0.1%甲酸);梯度洗脱(0~1.2 min,30%→98%B相;1.2~3.0 min,98%B相;3.0~3.1 min,98%→30%B相;3.1~3.5 min,30%B相);流速0.40 mL·min-1;柱温:35 ℃;进样量:20 μL。
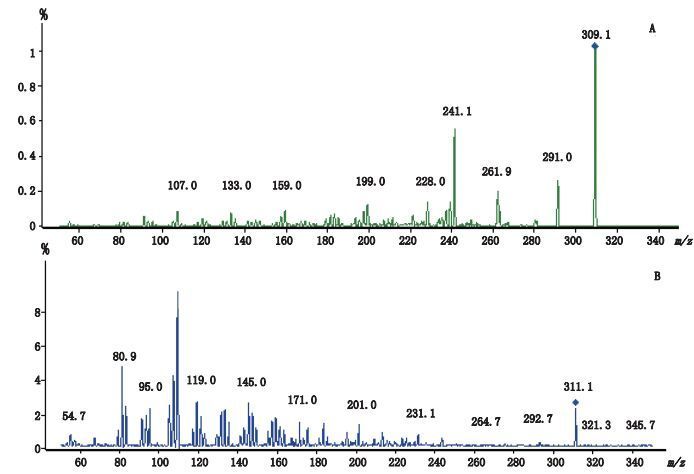
2.1.2 质谱条件采用多反应离子监测(MRM)扫描模式;ESI+源;用于定量分析的离子对为:孕三烯酮m/z 309.2→241.1,孕二烯酮m/z 311.2→109.1;干燥气温度:350 ℃;干燥气流速:12L·min-1;毛细管电压:4.0 kV;雾化器压力:2.4×105 Pa。待测化合物和内标的二级质谱子离子扫描图见图 2。
|
图 2 孕三烯酮(A)和孕二烯酮(B)二级质谱子离子扫描图 Figure 2 MS /MS spectra of Gestrinone(A)and Gestodene(B) |
对照品工作液:精密称取孕三烯酮适量,用乙腈配置成100 μg·mL-1的对照品储备液。取对照品储备液适量,以30%乙腈为溶剂逐步稀释,配制浓度分别为200、100、20、10、2、1、0.4和0.2 ng·mL-1的系列对照品溶液。质控工作液:精密称取孕三烯酮适量用乙腈配制成100 μg·mL-1的储备液。精密移取质控储备液适量,以30 %乙腈为溶剂逐步稀释,配制浓度分别为160、10、0.6 ng·mL-1的质控样品工作液。
内标工作液:精密称取孕二烯酮适量,用乙腈配置成100 μg·min-1的储备液。精密移取内标储备液0.1 mL,置100 mL量瓶中,以30%乙腈至定容刻度,配置浓度为100 ng·mL-1的内标工作液,摇匀,置于4 ℃的环境下保存。
2.4 血浆样品的处理精密吸取570 mL血浆置带塞离心管中,加入内标工作液30 mL,涡旋混合1 min,加入Na2CO3(1 mol·L-1)溶液30 mL涡旋1 min后用环己烷5 mL进行提取,涡旋混合2 min,4 ℃条件下4 500 r·min-1离心10 min,移取有机相4 mL置另一干净玻璃管中,45 ℃水浴中氮气吹干,残余物中加100 mL初始流动相30%乙腈(含0.1%甲酸)复溶,涡旋混合2 min,4 ℃条件下12 000 r·min-1高速离心10 min,取上清液20 mL进样分析。
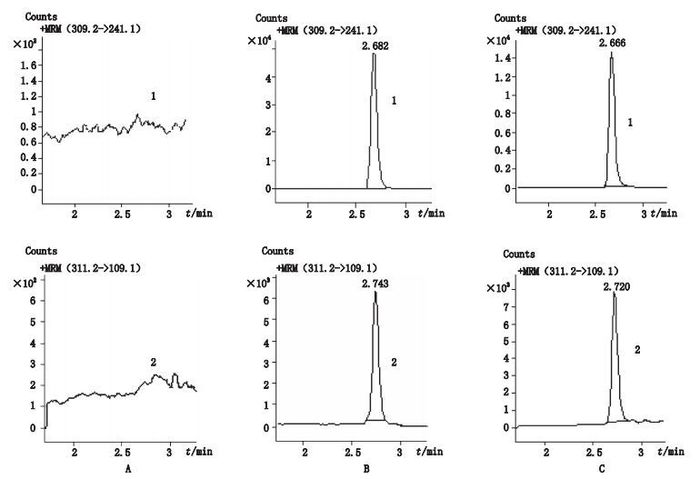
3 结果 3.1 专属性本实验所采用的色谱条件下,孕三烯酮和孕二烯酮的保留时间分别在2.6和2.7 min左右,无内源性物质干扰样品的测定,具有良好的专属性。空白血浆、空白血浆加孕三烯酮和内标、巴马小型猪首次给药后2 h血浆样品色谱图见图 3。
|
1.孕三烯酮(gestrinone,309.2→241.1)2.孕二烯酮(gestodene,311.2→109.1) A.空白血浆(blank plasma)B.空白血浆+孕三烯酮(200 ng·mL-1)+孕二烯酮(100 ng·mL-1)(blank plasma with gestrinone(200 ng·mL-1)and gestodene(100 ng·mL-1))C.巴马小型猪首次给药后2 h血浆样品(plasma from Bama miniature pig at 2 h after administration of 2.5 mg gestrinone capsules) 图 3 血浆样品色谱图 Figure 3 Chromatograms of plasma sample |
取空白血浆570 μL加入系列对照品溶液30 μL涡旋1 min,使标准血浆样品中孕三烯酮浓度分别为10、5、1、0.5、0.1、0.05、0.02、0.01 ng·mL-1,按“2.3”项下方法处理进样。以血浆中对照品质量浓度(X)对峰面积与内标峰面积之比(Y)进行加权最小二乘法计算标准曲线,权重1/X2。孕三烯酮线性方程:
Y=3.218X+0.001 9 r=0.998 9
结果显示孕三烯酮在0.1~10 ng·mL-1浓度范围内线性良好,定量下限为0.1 ng·mL-1。
3.3 精密度和准确度取空白血浆570 μL加入质控样品工作液溶液30 μL涡旋1 min,制备低、中、高3个浓度(0.03、0.5和8 ng·mL-1)的质控血浆样品,每个浓度5个样本,按“2.3”项下方法操作,随行标准曲线计算血药浓度;按以上方法制备3批标准血浆样品测定。根据测定值采用单因素方差分析计算精密度和准确度。具体结果见表 1。
|
|
表 1 巴马小型猪血浆中孕三烯酮精密度与准确度结果(n=5) Table 1 Results of precision and accuracy for the determination of gestrinone in Bama minipig plasma |
采用液液萃取后添加待测成分的方法[10]评价基质效应。精密移取0.6、10和160 ng·mL-1质控样品工作液及100 ng·mL-1的内标工作液各30 μL于玻璃管中,45 ℃水浴中氮气吹干,吹干物中加100 μL初始流动相复溶,4 ℃条件下12 000 r·min-1高速离心10 min,取上清液20 μL进样分析,分别记录孕三烯酮和孕二烯酮的峰面积SA。
取空白血浆570 μL,按“2.3”项下制备不含待测物和内标的样本,残渣中分别加入0.6、10和160 ng·mL-1质控样品工作液及100 ng·mL-1的内标工作液各30 μL,再于45 ℃水浴中氮气吹干,吹干物中加初始流动相100 μL复溶,4℃条件下12 000r·min-1高速离心10 min,取上清液20 μL进样分析,分别记录孕三烯酮和孕二烯酮的峰面积SB。
取570 μL空白血浆,分别精密加入0.6、10和160 ng·mL-1质控样品工作液及100 ng·mL-1的内标工作液各30 μL于玻璃管中,涡旋1 min,按“2.3”项下方法操作,分别记录孕三烯酮和孕二烯酮的峰面积SC。
基质效应=SB/SA×100%,提取回收率=SC/SA×100%,实验结果显示本法的基质效应影响较小,提取回收率>80%符合要求,具体结果见表 2。
|
|
表 2 孕三烯酮和孕二烯酮的基质效应及提取回收率结果(n=5) Table 2 Results of matrix and recovery effects of gestrinone and gestodene |
空白血浆570 μL,制备低、中、高3个浓度(0.03、0.5和8 ng·mL-1)的质控血浆样品,每个浓度5个样品,按“2.3”项下方法操作。分别考察于室温放置4 h、处理后4 ℃放置过夜、自动进样器上放置24 h、反复冻融3次的稳定性。结果表明血浆样品在上述条件下稳定性良好,具体结果见表 3。
|
|
表 3 各储存条件下孕三烯酮的稳定性(n=5) Table 3 Stability of gestrinone under various storage conditions |
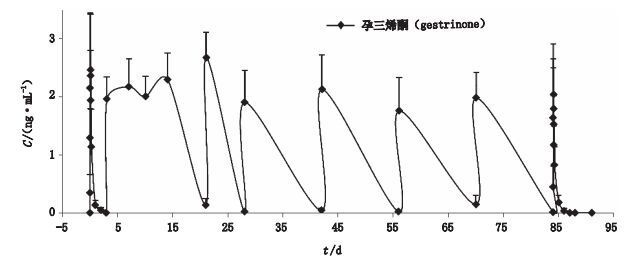
8只巴马小型猪日常饮食规律,实验过程中没有观察到不良反应,8只巴马小型猪口服孕三烯酮胶囊剂后的平均药物浓度与时间曲线见图 4,主要药代动力学参数见表 4。
|
图 4 巴马小型猪口服孕三烯酮胶囊后平均药物浓度与时间曲线(n=8,x±SD) Figure 4 Mean plasma concentration-time curves of gestrinone in Bama minipig after administration of gestrinone capsule |
|
|
表 4 巴马小型猪首次及末次口服2.5 mg孕三烯酮胶囊后药代动力学参数(n=8) Table 4 The pharmacokinetic parameters of the first and the last delivery of 2.5 mg capsule in Bama minipig |
小型猪[11-14]在食性、解剖结构、生理生化特点以及药物代谢特点方面与人类相似,已成为药物临床前评价非啮齿类动物的一个新的选择。国内小型猪资源丰富,指导原则中[15]也明确规定小型猪为临床前药代动力学研究的非啮齿类动物的适宜选择。本文首次成功地将巴马小型猪用于孕三烯酮胶囊药代动力学实验,在不麻醉的情况下进行给药和样品采集,探讨巴马小型猪多次给予孕三烯酮胶囊后的体内药动学特点。结果显示多次给予孕三烯酮胶囊期间巴马小型猪平均血药浓度峰浓度波动不大(1.90~2.68 ng·mL-1),首次和末次给药后的药动学参数无统计学差异,且多次给药(72 h/96 h)后体内浓度近乎达到实验方法检测限以下,证明孕三烯酮胶囊每周给药2次,体内不存在药物的蓄积性。孕三烯酮在小型猪体内具有快速吸收、快速分布、相对缓慢的消除的药动学特点。首末次Tmax与说明书中[9]报道的2.8~3.1 h差别不大,而t1/2的测定值与说明书中24 h,与存在差异,初步认为与小型猪自身代谢和人体代谢的差异性有关,后期会进行代谢差异性的相关研究。
在测定方法研究上,初期考察了乙腈、甲醇蛋白沉淀法和乙酸乙酯、乙醚、叔丁基甲醚、环己烷液液萃取等方法,结果表明用环己烷液液萃取法专属性强,且萃取过程中加入碳酸钠碱化血浆样品,提高了基质效应和回收率,能满足实验要求。分别考察了流动相中加入甲酸、甲酸铵对测定组分质谱响应信号的影响。结果表明流动相中加入甲酸或甲酸铵后孕三烯酮灵敏度提高,其中甲酸效果更明显,最终选择水(含0.1%甲酸)-乙腈(含0.1%甲酸)为流动相,在适当梯度洗脱的条件下能有效分离孕三烯酮,保留时间恰当,能满足测定的要求。本实验选择与孕三烯酮结构相似孕二烯酮为内标,在测定条件下两者的保留时间接近,且相互之间无干扰。
本文建立了灵敏度好、准确度高的孕三烯酮血浆浓度的测定方法,并对该方法进行了方法学确证,通过本实验建立的分析方法对孕三烯酮胶囊在巴马小型猪体内进行了药代动力学研究,并报道孕三烯酮在小型猪体内的药动学参数,为临床安全合理用药提供参考依据。
| [1] |
桂耀庭, 吴熙瑞. 三烯高诺酮的生殖生物学活性[J]. 同济医科大学学报, 1996, 25(2): 148. Gui YT, WU XR. Biological activities of gestrinone[J]. Acta Univ Med Tongji, 1996, 25(2): 148. |
| [2] |
王春凤. GnRHa和孕三烯酮对子宫内膜异位症异位及在位内膜细胞凋亡及MMP-3表达的影响[D]. 济南, 山东大学, 2009 WANG CF.The effects of GnRHa and Gestrinone on Apoptosis and Expression of MMP-3 in Human Ectopic and Eutopic Endometrial Stromal Cells in vitro[D]. Jinan: Shandong University, 2009 http://cdmd.cnki.com.cn/Article/CDMD-10422-2009248687.htm |
| [3] |
朱云晓, 柯佩琪, 沈宏伟, 等. 三烯高诺酮治疗子宫肌瘤31例[J]. 中国新药杂志, 2003, 12(8): 649. ZHU YX, KE PQ, SHEN HW, et al. Gestrinone in treatment of 31 cases of uterus myoma[J]. Chin J New Drugs, 2003, 12(8): 649. |
| [4] |
高雪, 吴尔若, 陈贵安. 孕三烯酮紧急避孕机理的初步探讨[J]. 中国优生与遗传杂志, 2007, 15(11): 95. GAO X, WU ER, CHEN GA. Mechanism of emergency contraception with gestrinone: a preliminary investigation[J]. Chin J Birth Health Hered, 2007, 15(11): 95. DOI:10.3969/j.issn.1006-9534.2007.11.051 |
| [5] |
KUMAR TCA, DAVID GFX, SANKARANRAYANAN A, et al. Pharmacokinetics of progesterone after its administration to ovariectomized rhesus monkeys by injection, infusion, or nasal spraying[J]. Proc Nal Acad Sci USA, 1982, 79(13): 4185. DOI:10.1073/pnas.79.13.4185 |
| [6] |
AKINLA O, LAHTEENMAKI P, JACKANICZ TM. Intravaginal contraception with the synthetic progestin, R2323[J]. Contraception, 1976, 14(6): 671. DOI:10.1016/0010-7824(76)90110-4 |
| [7] |
KIM Y, LEE YK, KIM M, et al. Determination and excretion study of gestrinone in human urine by high performance liquid chromatography and gas chromatography/mass spectrometry[J]. Rapid Commun Mass Spectrom, 2000, 14(14): 1293. DOI:10.1002/(ISSN)1097-0231 |
| [8] |
WANG Q, WU ZP, WANG YM, et al. Determination of gestrinone in human serum by liquid chromatography—electrospray tandem mass spectrometry[J]. J Chromatogr B Biomed Sci Appl, 2000, 746(2): 151. DOI:10.1016/S0378-4347(00)00302-9 |
| [9] |
Instruction for Gestrinone capsule. Chinese Obstetrics and Gynecology Network[DB/OL].(2011-4-25)[2016-5-10]. http://www.obgy.cn/jihuashengyu/5808b014cb4904f040e56260
|
| [10] |
向平, 沈敏, 卓先义. 液相色谱-质谱分析中的基质效应[J]. 分析测试学报, 2009, 28(6): 753. XIANG P, SHEN M, ZHUO XY. Matrix effects in liquid chromatographic-mass spectrometric analysis[J]. J Instrum Anal, 2009, 28(6): 753. |
| [11] |
MAHL JA, VOGEL BE, COURT ML, et al. The minipig in dermatotoxicology: Methods and challenges[J]. Exper Toxicol Pathol, 2006, 57(5): 341. |
| [12] |
刘宇. 以洛伐他汀为典型药物研究巴马香猪和人代谢的异同[D]. 重庆: 第三军医大学, 2008 LIU YU. A Comparative Study on the Differences and Similarities of Lovastatin Metabolism Between the Bama Miniature Pigs and Human[D]. Chongqing: Third Military Medical University, 2008 http://cdmd.cnki.com.cn/Article/CDMD-90025-2009253795.htm |
| [13] |
童颖, 潘虹, 孙成龙, 等. 小型猪血浆中二丙酸倍他米松及其代谢物倍他米松的LC-MS/MS同时测定方法的建立及在药动学研究中的应用[J]. 药学进展, 2014, 38(4): 290. TONG Y, PAN H, SUN CL, et al. Simultaneous determination of betamethasone dipropionate and its active metabolite betamethasone in miniature pig plasma by LC-MS/MS and its application in pharmacokinetic study[J]. Progr Pharm Sci, 2014, 38(4): 290. |
| [14] |
张浩, 夏艳萍, 陈克研, 等. 异丙酚在容量控制性失血性休克猪体内的药动学研究[J]. 中国现代应用药学, 2016, 33(6): 771. ZHANG H, XIA YP, CHEN KY, et al. Pharmacokinetics of propofol in pigs with Hemorrhagic shock under volume controlled[J]. Chin J Mod Appl Pharm, 2016, 33(6): 771. |
| [15] |
[H]GPT 5-1. 化学药物非临床药代动力学研究技术指导原则[S]. 2005 [H]GPT 5-1. Guiding principles for the study of chemical drugs non clinical pharmacokinetics[S].2005 |
 2017, Vol. 37
2017, Vol. 37 
