2. 浙江省中药制药技术重点实验室, 杭州 310052
2. Zhejiang Provincial Key Laboratory of Traditional Chinese Medicine Pharmacecutical Technology, Hangzhou 310052, China
银杏叶为银杏科植物银杏Ginkgo bilobaL.的干燥叶,银杏叶提取物已成为国内外普遍使用的重要原料以及制剂之一。银杏叶提取物中的主要有效化学成分为黄酮和萜类内酯。现代药理研究表明,银杏黄酮和萜类内酯均具有改善心血管系统,调血脂,抗氧化,抗衰老等作用[1-3]。目前国际通用的银杏叶提取物的标准是以德国Schwabe药厂专利工艺生产的EGB761作为依据[4],要求银杏中黄酮类化合物的占比需高于24%,其主要由小分子黄酮苷元如槲皮素、山柰酚、异鼠李素和其糖苷类化合物组成[5-7]。
由于黄酮类化合物是银杏叶提取物中的主要有效成分,而市面上的银杏叶提取物质量良莠不齐,许多不法商家在银杏叶中掺入槐角提取物以提高黄酮类化合物的含量[8]。本文在已报道的银杏叶提取物相关文献[9-14]的基础上,对10批银杏叶提取物进行分析,建立更加完善的银杏叶提取物HPLC指纹图谱,以判定银杏叶提取物的真伪优劣,并将市售疑似掺假提取物的色谱图与对照指纹图谱相对比,成功地鉴别出掺假提取物。另外,本次实验结合LC-MS分析,对指纹图谱中的20个共有峰进行了结构鉴定,大部分为黄酮类化合物,其中结合文献确定了10个峰对应的化合物,为银杏叶提取物的科学鉴定和质量标准提供参考依据。
1 仪器与试药安捷伦公司Agilent 1200液相色谱仪;UPLC-Triple-TOF 5600+飞行时间液质联用仪;安捷伦公司Agilent Eclipse XDB-C18(4.6 mm×250 mm,5μm;填料:十八烷基硅烷键合硅胶)色谱柱。AL104型梅特勒-托利多仪器(上海)有限公司电子分析天平。
乙腈为色谱纯,甲酸为分析纯,水为重蒸水。
对照品芦丁(批号100081-200907)、槲皮素(批号100081-201509)、山柰酚(批号110861-201209)、异鼠李素(批号110860-201410)购自中国食品药品检定研究院;本实验收集了13批银杏叶提取物(信息见表 1),其中S5~S10批购于不同的生产厂家,经检验合格;因S11~S13批检测出含量较高的染料木素和槐角苷,疑似掺假,为异常批提取物。S1~S4批为根据标准工艺,自制提取物,原料为不同产地的银杏叶,经检验均合格。
|
|
表 1 样品来源 Table 1 Origins of GBE |
色谱条件:采用Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,以0.1%甲酸溶液(A)-乙腈(B)为流动相,梯度洗脱(0~40 min,10%B→36%B;40~45 min,36%B→50%B;45~50 min,50%B→100%B;50~55 min,100%B;55~56 min,100%B→10%B;56~65 min,10%B),流速1 mL·min-1,检测波长254 nm,柱温30 ℃。理论板数按芦丁峰计算应不低于5 000。
质谱条件:采负离子扫描模式,扫描范围m/z 100~1 500,雾化气(GS1)344.8 kPa,干燥气(GS2)344.8 kPa,气帘气(CUR)241.3 kPa,离子源温度(TEM)550 ℃,离子源电压(IS)-4.5 kV;一级扫描:去簇电压(DP)80 V,聚焦电压(CE)10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,CID能量为-20、-40和-60 V,进样前,用CDS泵做质量轴校正,使质量轴误差小于2×10-6。
2.2 供试品溶液的制备取银杏叶提取物(GBE)约100 mg,精密称定,加甲醇约5 mL超声溶解,转移至10 mL量瓶中,用甲醇稀释至刻度,经0.45 μm微孔滤膜滤过,即得。
2.3 参照物溶液的制备取芦丁、槲皮素、山柰酚和异鼠李素的对照品适量,精密称定,加甲醇制成每1 mL含芦丁200 μg,槲皮素10 μg,山柰酚5 μg,异鼠李素5 μg的混合溶液,即得。
2.4 方法学考察 2.4.1 精密度试验取同一份银杏叶提取物供试品溶液,连续进样6次,记录色谱图,将图谱导入中药色谱指纹图谱相似度评价系统(2012版本)软件,进行相似度评价。结果显示,各次测定样品共有峰相似度均大于0.90,说明本法仪器精密度良好。
2.4.2 重复性试验取同一银杏叶提取物样品6份,按“2.2”项下方法制备供试品溶液,分别进样,考察色谱峰相似度。结果显示,各供试品共有峰之间相似度均大于0.90,说明本法重复性良好。
2.4.3 中间精密度由3组人员,3个时间点按“2.2”项下方法制备供试品溶液,于不同液相色谱仪(安捷伦Agilent 1260液相色谱仪、Agilent 1200液相色谱仪)上使用相同色谱柱进行检测,记录色谱图,考察色谱峰相似度。结果显示,各共有峰之间相似度均大于0.90,说明本法中间精密度良好。
2.4.4 溶液稳定性试验取同一供试品溶液,分别在0、2、4、8、18、24 h内按“2.1”项下色谱条件进行测定,记录色谱图,考察色谱峰相似度,结果显示,在24 h内,各共有峰之间相似度均大于0.90。供试品溶液在24 h内稳定。
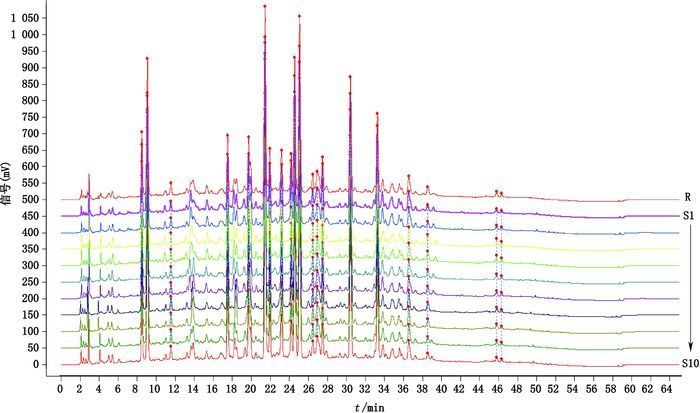
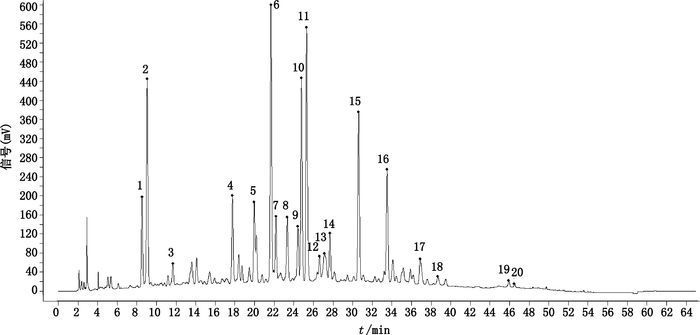
3 结果 3.1 指纹图谱的确定及共有峰的标记以“2.2”项方法制备的10批提取物的供试品溶液,按“2.1”项条件进行测定,得到10批银杏叶提取物的HPLC指纹图谱,见图 1,根据色谱峰中各色谱峰的相对保留时间,确定共有峰,并选取其中20个共有峰作为特征指纹峰,建立了银杏叶提取物的对照指纹图谱,见图 2。
|
图 1 10批银杏叶提取物的HPLC指纹图谱 Figure 1 HPLC fingerprint of 10 batches of samples |
|
1. 6-羟基犬尿喹啉酸(6-hydroxy kynurenic acid),2. 3,4-二羟基苯甲酸(3,4-dihydroxybenzoic acid),3.芦丁(rutin)8.异槲皮素(isoquercetin),10.山柰酚-3-O-芸香糖苷(kaempferol-3-O-rutinoside)11.异鼠李素3-O-芸香糖苷(3-O-rutinoside),13.槲皮苷(quercitrin)18.槲皮素(quercetin)19.山柰酚(kaempferol)20.异鼠李素(isorhamnetin) 图 2 对照指纹图谱 Figure 2 Reference fingerprint of GBE |
为进一步阐述银杏叶提取物的化学成分组成,通过UPLC-Triple-TOF 5600+飞行时间液质联用仪负离子扫描获得了银杏叶提取物指纹图谱中部分色谱峰对应化合物的结构信息,并采用芦丁、槲皮素、山柰酚、异鼠李素对照品对色谱峰进行指认,同时结合相关文献报道[15],确定了10个共有峰对应的化合物,分别为6-羟基犬尿喹啉酸、3,4-二羟基苯甲酸、芦丁、异槲皮素、山柰酚-3-O-芸香糖苷、异鼠李素3-O-芸香糖苷、槲皮苷、槲皮素、山柰酚、异鼠李素。
3.3 10批银杏叶提取物指纹图谱相似度评价10批银杏叶提取物,按“2.2”项下方法制备供试品溶液,进行检测,记录色谱图,以特征指纹图谱共有模式为对照,计算各批次样品的相似度(见表 2)。10批提取物与对照指纹图谱的相似度分别为0.999、0.999、0.997、0.997、0.999、0.999、0.999、0.999、0.998、0.998,各样品的相似度值均大于0.95,相似度符合相关规定,表明各批银杏叶提取物质量稳定。
|
|
表 2 10批银杏叶提取物的指纹图谱 Table 2 HPLC fingerprints of 10 batches of GBE samples |
参考美国药典中银杏叶提取物游离黄酮测定条件,并对其进行优化,获得最终色谱条件。该色谱条件下,色谱峰能达到有效分离。
4.2 检测波长的选择指纹图谱检测的色谱峰主要为黄酮类物质,而该类物质基本在254、360 nm处有最大吸收。用二极管阵列检测器对供试品溶液进行全波长扫描,发现254 nm下色谱峰峰个数较多,响应值较高,部分黄酮类成分如槐角苷、染料木素等在254 nm有最大响应,而360 nm波长处的响应极低,故确定检测波长为254 nm。
4.3 参照峰的确定对多批银杏叶提取物进行检测,记录色谱图。发现银杏叶提取物中芦丁的含量较高,在此色谱条件下获得的色谱峰响应值较高,分离度良好,所以选择芦丁作为参照峰。
4.4 色谱柱考察取同一供试品溶液,比较3个厂家色谱柱[安捷伦公司Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,岛津Inertsil ODS-3(4.6 mm×250 mm,5 μm)色谱柱,北京迪马科技有限公司Diamosil C18(4.6 mm×250 mm,5 μm)色谱柱]对色谱峰的分离情况及相似度影响,结果显示,不同厂家色谱柱对色谱峰的分离影响较大。其中色谱柱2与色谱柱3对色谱分离情况相似,共有峰均能达到良好分离,但色谱柱1对于峰12、13与峰17、18的分离效果差。建议使用色谱柱2与色谱柱3。
4.5 柱温考察取同一供试品溶液,考察不同柱温(25、30、35 ℃)下,各共有峰的分离及相似度变化情况。结果显示,随着柱温的升高,各共有峰的保留时间略有提前,但分离均良好。各共有峰之间相似度均大于0.90。柱温的耐用性考察结果良好。
4.6 检测波长考察取同一供试品溶液,考察不同检测波长(252、254、256 nm)下,各共有峰相似度变化情况。结果显示,波长微小调整,各共有峰的相似度均大于0.90。
4.7 实验分析及结论本研究建立了银杏叶提取物的HPLC指纹图谱,其精密度、稳定性、重复性符合中药指纹图谱相关技术参数要求,证明此方法可操作性强。本法共确定了20个共有峰,对银杏叶提取物中的共有峰化合物进行结构鉴定,共鉴定了10个成分。另将疑似掺假的银杏叶提取物与其他批次的提取物进行相似度评价,发现其相似度差异极大。仔细对比各图谱之间的差异,发现异常批次的提取物较其他批次的提取物,色谱图中芦丁(峰6)响应低,而槲皮素(峰18)、山柰酚(峰19)、异鼠李素(峰20)响应值高。因而,通过HPLC指纹图谱的方法,可以明显地区别提取物是否正常,证明此次建立的银杏叶提取物指纹图谱对银杏叶提取物疑似掺假评判具有指导意义,可用来甄别银杏叶提取物的真伪优劣。
| [1] |
汪素娟, 康安, 狄留庆, 等. 银杏叶提取物主要活性成分药动学研究进展[J]. 中草药, 2013, 44(5): 626. WANG SJ, KANG A, DI LQ, et al. Progress in pharmacokinetic study on main active ingredients of Ginkgo biloba leaf extract[J]. Chin Tradit Herb Drugs, 2013, 44(5): 626. |
| [2] |
李红梅, 刘顺良, 姜静岩. 银杏叶提取物对心脑血管疾病的药理作用研究进展[J]. 时珍国医国药, 2002, 13(2): 105. LI HM, LIU SL, JIANG JY. Research progress in pharmacological action of Ginkgo biloba extract on cardiovascnlar and cerebrovascular diseases[J]. Lishizhen Med Mater Med Res, 2002, 13(2): 105. |
| [3] |
HOSSEINI-SHARIFABAD M, ANVARI M. Effects of Ginkgo biloba extract on the structure of Cornu Ammonis in aged rat:amorphometric study[J]. Iran J Basic MedSci, 2015, 18(9): 932. |
| [4] |
SCHWABE WILLMAR DR, KLOSS PETER DR. Verfahren zur Gewinnung eines vas oaktiven Arzneimittel saus den Blaettern von Ginkgo biloba:German Patent, DE1767098[P]. 1972-05-31
|
| [5] |
冯小龙, 王伟, 张兰桐. 银杏叶总黄酮及其水解物静脉注射给药后在大鼠体内的药动学研究[J]. 中草药, 2009, 40(9): 1402. FENG XL, WANG W, ZHANG LT. Study on pharmacokinetics of total flavones in Ginkgo leaves and its hydrolysate in rats after intravenous administration[J]. Chin Tradit Herb Drugs, 2009, 40(9): 1402. |
| [6] |
张颖, 刘建勋, 林力, 等. HPLC-ECD法测定大鼠血浆中银杏叶黄酮成分及药代动力学研究[J]. 药物分析杂志, 2011, 31(1): 10. ZHANG Y, LIU JX, LIN L, et al. HPLC-ECD determination of flavonols from Ginkgo biloba leaf extracts in rat plasma and its pharmacokinetic study[J]. ChinJ Pharm Anal, 2011, 31(1): 10. |
| [7] |
赵一懿, 王京, 傅欣彤, 等. 银杏叶药材黄酮类成分指纹图谱研究及其中11种黄酮苷类成分定量分析[J]. 中国药学杂志, 2013, 48(18): 1583. ZHAO YY, WANG J, FU XT, et al. Simultaneous determination of eleven flavonoid glycosides in Ginkgo biloba leaves and study on its fingerprint by ultra performance liquid chromatography method[J]. Chin Pharm J, 2013, 48(18): 1583. |
| [8] |
WANG FQ, JIANG KZ, LI ZG. Purification and identification of genistein in Ginkgo biloba leaf extract[J]. Chin J Chromatogr, 2007, 25(4): 509. DOI:10.1016/S1872-2059(07)60019-4 |
| [9] |
DING XP, QI J, CHANG YX. Quality control of flavonoids in Ginkgo biloba leaves by high-performance liquid chromatography with diode array detection and on-line radical scavenging activity detection[J]. J Chromatogr A, 2009, 1216(11): 2204. DOI:10.1016/j.chroma.2008.08.115 |
| [10] |
聂黎行, 鲁静. 银杏叶提取物中总银杏酸的HPLC法限量检查[J]. 药物分析杂志, 2005, 25(8): 909. NIE LX, LU J. Limit test of total ginkgolic acid in the Ginkgo biloba extract by HPLC method[J]. Chin J Pharm Anal, 2005, 25(8): 909. |
| [11] |
姚建标, 金辉辉, 王如伟, 等. 银杏叶提取物中总银杏酸HPLC法限量检测[J]. 药物分析杂志, 2015, 35(11): 2041. YAO JB, JIN HH, WANG RW, et al. Limit determination of ginkgolic acid in Ginkgo biloba extract by HPLC[J]. ChinJ Pharm Anal, 2015, 35(11): 2041. |
| [12] |
姚建标, 方玲, 王如伟, 等. 中国药典和欧洲药典银杏叶提取物中银杏酸限度检测方法比较研究[J]. 药物分析杂志, 2012, 32(11): 2055. YAO JB, FANG L, WANG RW, et al. Comparison on limit detection methods for ginkgolic acid of Ginkgo biloba extract by ChP and EP[J]. Chin J Pharm Anal, 2012, 32(11): 2055. |
| [13] |
VICTOIRE C, HAAG-BERRURIER M, LOBSTEIN-GUTH A, et al. Isolation of flavonol glycosides from Ginkgo biloba leaves[J]. Planta Med, 1998, 54(3): 245. |
| [14] |
GRASEL I, REUTER C. Analysis of 6-hydroxykynurenic acid in Ginkgo biloba and Ginkgo preparations[J]. Planta Med, 1998, 64(6): 566. DOI:10.1055/s-2006-957516 |
| [15] |
Van BEEKTA, MONTORO P. Chemical analysis and quality control of Ginkgo biloba leaves, extracts, and phytopharmaceuticals[J]. J Chromatogr A, 2009, 1216(11): 2002. DOI:10.1016/j.chroma.2009.01.013 |
 2017, Vol. 37
2017, Vol. 37 
