2. 江苏省药物研究所, 南京 211816
2. Jiangsu Provincial Institute of Materia Medica, Nanjing 211816, China
奥拉西坦是吡拉西坦衍生物,是一类GABA受体促智药[1],能选择性作用于大脑皮层和海马区,激活、保护或促进神经细胞的功能恢复,能对抗缺血缺氧引起的脑功能障碍,改善脑血管损害引起的脑代谢障碍,对神经具有一定的保护作用[2]。左旋奥拉西坦(S-oxiracetam)是奥拉西坦左旋异构体,研究表明,左旋异构体药效优于右旋[3],较之消旋体,左旋异构体改善东莨菪碱造成的小鼠学习记忆能力损伤作用更显著[4],奥拉西坦消旋体、左旋异构体与右旋异构体结构如图 1所示。
|
图 1 结构式 Figure 1 Structures |
文献报道未见左旋奥拉西坦组织样本分析方法,相关报道中测定生物样本有人血浆[5]或血清[6]、比格犬血浆[7]、大鼠血浆[8-9]等,测定方法主要有高效液相色谱法、液质联用等方法。这些方法样本处理过程复杂,样本体积需求量大,走样时间长,灵敏度低,线性范围有限的不同的原因。
本文建立一个快速且灵敏度高的LC-MS/MS法测定左旋奥拉西坦血浆和组织样本中的浓度,考察左旋奥拉西坦在孕鼠母代和子代个脏器中分布情况,进一步评价左旋奥拉西坦的生殖毒性,为其安全用药提供依据。
1 材料 1.1 仪器设备Waters 2695 Quattro Micro三重四极杆LC-MS/MS系统(沃特世上海制造有限公司),XTerra MS C18色谱柱(2.1 mm×100 mm,5 μm;填料:十八烷基硅烷键合硅胶;沃特世上海制造有限公司),ZORBAX Eclipse Plus色谱保护柱(2.1 mm×12.5 mm,5 μm;填料:十八烷基硅烷键合硅胶;安捷伦上海制造有限公司),5424型Eppendorf离心机(艾本德中国有限公司),PT1200E型电动匀浆机(瑞士凯恩麦特阁公司),基本型旋涡混合器(TALBOYS制造有限公司),F3JN7743型超净水机(Millipore公司)。
1.2 药物和试剂样品:左旋奥拉西坦注射液(山东罗欣药业集团股份有限公司,批号X711312061,规格为每瓶250 mL);对照品:左旋奥拉西坦对照品(山东罗欣药业集团股份有限公司,HPLC法测得含量为99.2%,批号X711312051),吡拉西坦对照品(中国食品药品检定研究院,含量≥99.0%,批号99100386-200702);试剂:乙腈(TEDIA,含量≥99.9%,批号150995044),乙酸乙酯(永华化学科技有限公司,含量≥99.7%,批号20151028),水(Millipore纯水机制得)。
1.3 实验动物SPF级SD大鼠,雌鼠32只,雄鼠16只,北京维通利华实验动物技术有限公司提供,动物合格证号11400700131075,动物生产许可号为SCXK(京)2012-0001。大鼠饲养于江苏省药物安全性评价中心SPF动物房。
2 色谱条件及质谱条件采用XTerra MS C18色谱柱(2.1 mm×100 mm,5 μm)及ZORBAX Eclipse Plus C18色谱保护柱(2.1 mm×12.5 mm,5 μm),流动相为乙腈-水(35:65),流速0.2 mL·min-1,柱温25 ℃,进样量10 μL。
采用电喷雾离子化源ESI,毛细管电压20 V,雾化气压力10 V,干燥气流速8 L·min-1,干燥气体温度350 ℃,离子化方式为正离子模式,扫描方式为多反应监测,MRM选择离子为左旋奥拉西坦选择离子m/z 159.0/113.9及内标选择离子对m/z 143.1/97.9。
3 对照品储备液、内标溶液与标准血浆样品或组织样品的配制 3.1 对照品储备液精密称取左旋奥拉西坦对照品10.01 mg,置10 mL量瓶中,以甲醇-水(50:50)溶解并定容,得质量浓度约为1 mg·mL-1的溶液,即得。
3.2 内标溶液精密称取吡拉西坦对照品10.03 mg,置10 mL量瓶中,以乙腈-水(50:50)溶解并定容,再以乙腈定量稀释成质量浓度为5 μg·mL-1的溶液,即得;置于4 ℃冰箱保存。
3.3 标准血浆样品或标准组织样品取对照品储备液(1 mg·mL-1)适量,用甲醇逐级稀释,制得左旋奥拉西坦质量浓度为200、500、1 000、2 000、5 000、10 000、20 000、50 000 ng·mL-1的系列对照品溶液。分别精密吸取上述系列对照品溶液10 μL,内标溶液(5 μg·mL-1)10 μL置于1.5 mL离心试管中,再精密加入空白血浆或组织匀浆90 μL,涡旋混匀30 s,即得左旋奥拉西坦质量浓度为20、50、100、200、500、1 000、2 000和5 000 ng·mL-1 8个浓度级别的系列标准血浆样品或标准组织样品。
4 生物样品采集与保存雌雄大鼠按2:1比例合笼交配,如次日检出阴栓或阴道涂片检出精子,则交配日定为妊娠第0天(Gestation Day 0,GD0)。SD孕鼠随机分成溶媒对照组(0.9%氯化钠注射液)和左旋奥拉西坦低(400 mg·kg-1)、中(800 mg·kg-1)、高剂量(1 600 mg·kg-1)3个剂量组(单次给药毒性试验结果显示对SD大鼠单次静脉滴注给药的最小致死量≥5 000mg·kg-1,根据《药物生殖毒性研究技术指导原则》以及相关指导原则要求设计得出给药剂量)。每日给药1次,每组4只孕鼠。动物于妊娠第6天至第20天(GD6~GD20)尾静脉给药。GD20最后1次给药5 min后眼球静脉取血,剖宫,取出仔鼠,解剖,分离母鼠心、肝、脾、肺、肾、脑、胎盘、羊水组织,取胎鼠心脏、肝脏和肺组织[10]。待测组织用生理盐水洗2~3次,除去血液,用滤纸吸干。精密称量组织,加3倍体积生理盐水在冰浴下用匀浆器充分匀浆后,3 000 r·min-1离心10 min,取上清,得组织样品匀浆,-20 ℃保存待测。
5 样品预处理方法精密吸取内标溶液(浓度为5 μg·mL-1)10 μL,置1.5 mL Eppendorf管中,再精密加入室温自然解冻后的待测血浆样品或组织样品100 μL,涡旋震荡30 s,精密加入1 mL乙酸乙酯液液萃取,涡旋震荡3 min,16 000 r·min-1高速离心10 min,取上清液900 μL置另一1.5 mL Eppendorf管中,真空浓缩至干,加入100 μL乙腈-水(35:65)复溶,进样测定。
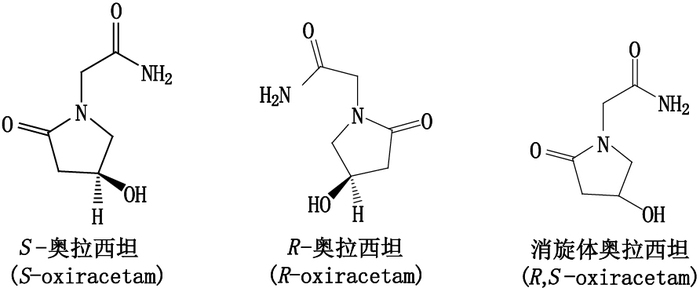
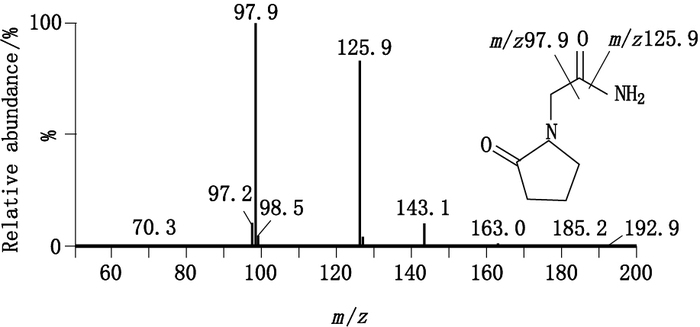
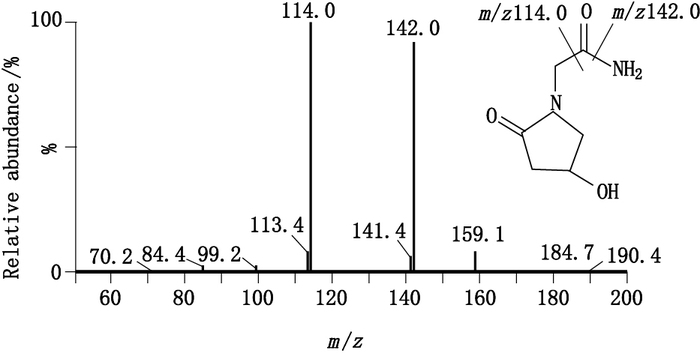
6 方法学考察 6.1 专属性左旋奥拉西坦和内标的质谱特征分别见图 2、3,左旋奥拉西坦定量离子对为m/z 159.1/114.0,内标吡拉西坦定量离子对为m/z 143.1/97.9。分别将来源于6只空白大鼠的生物样品(以肝为例)、空白生物样品加入左旋奥拉西坦和内标,给药后含左旋奥拉西坦的生物样品,按照“5”项下方法预处理后,进行LC-MS/MS分析,见图 4。经比较可见:血浆及各组织匀浆液中内源性物质对左旋奥拉西坦的测定没有影响,该方法专属性好。
|
图 2 内标吡拉西坦的二级质谱图 Figure 2 MS2 spectrum of piracetam(internal standard) |
|
图 3 左旋奥拉西坦的二级质谱图 Figure 3 MS2 spectrum of S-oxiracetam |
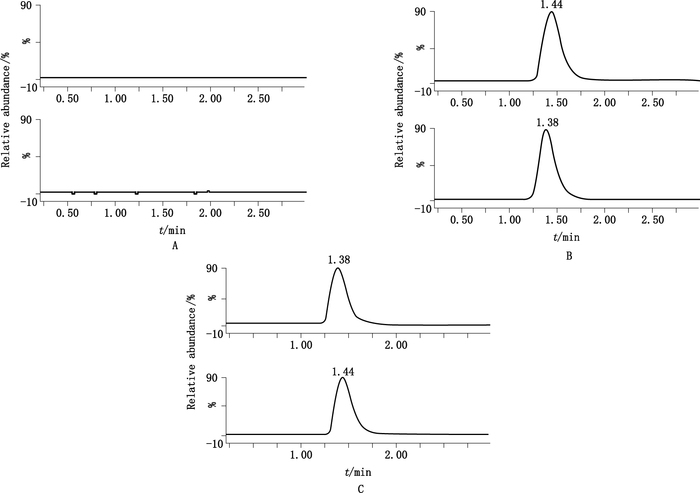
|
A.空白肝组织(blank liver homogenate)B.空白肝组织+对照品(blank liver homogenate containing S-oxiracetam)C.给药后肝组织(liver homogenate after iv administration S-oxiracetam) 图 4 LC-MS/MS色谱图 Figure 4 LC-MS/MS chromatograms |
取“3.3”项中所述8个浓度级别的系列标准血浆样品或各组织样品,按上述“5”项方法操作,并进行色谱分析,记录色谱图。分别以左旋奥拉西坦色谱峰面积与内标色谱峰面积的比值Y对质量浓度(ng·mL-1)进行线性回归计算,得到回归方程见表 1;结果表明,左旋奥拉西坦在20~5 000 ng·mL-1范围内,线性良好。定量下限为20 ng·mL-1,其准确度在92.8%~115.3%,精密度RSD为8.4%。
|
|
表 1 血浆和各组织匀浆中左旋奥拉西坦的回归方程及相关系数(r) Table 1 Regression equations and correlation coefficients of S-oxiracetam in rat plasma and tissues |
取空白血浆和空白组织匀浆,根据各自的标准曲线范围制备低(50 ng·mL-1)、中(500 ng·mL-1)、高(2 000 ng·mL-1)3种浓度的标准样品,每天分别配制5份,按“5”项下方法处理后测定;代入随行标准曲线求出实测浓度,计算准确度。血浆及各组织均考察3 d,即为各组织的日间RSD(n=5)。第1天处理的样品计算日内RSD(n=5),数据结果见表 2。各组织低、中、高浓度的日内和日间精密度RSD均 < 15.0%,表明此方法精密度和准确度均较高,重现性好。
|
|
表 2 测定方法的精密度和提取回收率 Table 2 Precision and extraction recovery of the method |
配制左旋奥拉西坦低(50 ng·mL-1)、中(500 ng·mL-1)、高(2 000 ng·mL-1)3个浓度的样品,每个浓度平行制备5份,按照“5”项下所述方法处理后进样到色谱分析系统,记录样品峰面积和内标峰面积之比记为A1;另分别取空白血浆90 μL,按“5”项下的方法操作,将空白血浆提取后加入对照品和内标溶液制得左旋奥拉西坦低(50 ng·mL-1)、中(500 ng·mL-1)、高(2 000 ng·mL-1)3个浓度样品,记录样品峰面积和内标峰面积之比记为A2。提取回收率=A1×A2-1×100%,测试结果见表 2。提取回收率结果在85%~115%,符合方法学要求。
6.5 稳定性试验制备低(50 ng·mL-1)、中(500 ng·mL-1)、高(2 000 ng·mL-1)3个浓度的样品各5份,分别考察样品提取后于室温放置8 h和反复冻融3次的稳定性。测定结果以测定值的平均值与配制的理论浓度(加入值)比较,计算RSD,测定数据见表 3。结果表明,血浆及各组织样品反复冻融3次及提取后放置8 h药物浓度无明显变化,稳定性良好,符合生物样本检测要求。
|
|
表 3 3次冻融稳定性与提取后8 h稳定性 Table 3 Stablity of freeze-thaw for 3 cycles and extracted for 8 h |
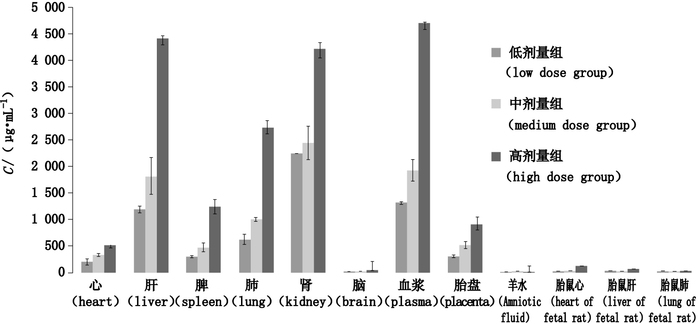
将孕鼠血浆样品和各组织样品按“5”项下方法处理后进入色谱系统测定,峰面积代入相应的标准曲线计算求得各组织和血浆中左旋奥拉西坦的浓度。结果图 5。
|
图 5 血浆及各组织5 min是含左旋奥拉西坦的含量 Figure 5 Content of S-oxiracetam in plasma and various tissues at 5 min |
本文开发了一种高效的检测方法,可应用于临床前大鼠胚胎-胎仔发育毒性中左旋奥拉西坦体内组织分布研究。该方法操作简单,灵敏度高(定量下限为20 ng·mL-1),样品需要量小(100 μL),分析时间短(运行时间3 min),线性范围广,简单经济,无内源性物质干扰。左旋奥拉西坦在孕鼠体内组织分布研究表明该物质广泛分布于各个组织器官,其中肝和肾的浓度较高,可透过血脑屏障和胎盘屏障。
8.2 讨论左旋奥拉西坦作为一类良好的促智药,对神经具有保护作用,能改善学习记忆能力[11],药理作用好,副作用小,对血管性痴呆病[12]、腔隙性脑梗死合并认知功能障碍[13]、帕金森病[14]等脑部疾病均有疗效。本文在建立分析方法的过程中,对流动相比例进行考察,最终确定为乙腈-水(65:35),此条件下,峰形最好,分析时间缩短。在提取方法选择过程中,尝试了蛋白沉淀与液液萃取;分别使用乙腈和甲醇作为蛋白沉淀剂,液液萃取剂分别尝试乙酸乙酯和甲基叔丁基醚;根据试验最终提取回收率,干扰物质的影响以及左旋奥拉西坦与内标的响应值的考察,选择乙酸乙酯液液萃取为最终提取方法。
左旋奥拉西坦在孕鼠体内组织分布结果表明肝和肾的浓度较高,这可能因为肝脏和肾药物的代谢有关,肝脏的血流量比较丰富。在脑中也有少量分布,原因可能是左旋奥拉西坦能够透过血脑屏障刺激特异性中枢神经通路[15],达到治疗作用。同时,胎仔心脏、肝脏和肺检测到少量,但均低于母体胎盘的含量,可得出左旋奥拉西坦可以透过胎盘屏障,对胎鼠可能造成一定的影响,之后还需要结合左旋奥拉西坦生殖毒性研究和围产期毒性研究,为进一步探讨其生殖毒理机制,为新药安全性评价提供依据。
| [1] |
李获, 张晓宇. 奥拉西坦在犬体内的药动学研究[J]. 中国药房, 2013, 24(37): 3473. LI H, ZHANG XY. Study on pharmacokinetics of oxiracetam in dogs[J]. China Pharm, 2013, 24(37): 3473. DOI:10.6039/j.issn.1001-0408.2013.37.07 |
| [2] |
WANG W, JI H, LI T, et al. Pharmacokinetic comparisons of S-oxiracetam and R-oxiracetam in Beagle dogs[J]. Acta Pharm, 2016, 66(2): 279. |
| [3] |
金磊, 李博, 叶雷, 等. 奥拉西坦的临床前药理学研究[J]. 中国临床药理学与治疗学, 2011, 16(3): 354. JIN L, LI B, YE L, et al. Preclinical pharmacology research of oxiracetam[J]. Chin J Clin Pharmacol, 2011, 16(3): 354. |
| [4] |
李坤, 王瑛瑛, 于媛媛, 等. 促智药物(S)-奥拉西坦的合成[J]. 中国新药杂志, 2011, 20(19): 1920. LIN K, WANG YY, YU YY, et al. Synthesis of the nootropic drug S-stereoisomer of oxiracetam[J]. Chin J New Drugs, 2011, 20(19): 1920. |
| [5] |
张丹, 杨漫, 张娅喃, 等. LC-MS/MS法测定人血浆中奥拉西坦的浓度及其两种口服制剂在健康中国人体的生物等效性[J]. 中国新药与临床杂志, 2014, 33(4): 281. ZHANG D, YANG M, ZHANG YN, et al. LC-MS/MS method for quantitation of oxiracetam in human plasma:application to a bioequivalence study of its two oral formulations in healthy Chinese subjects[J]. Chin J New Drugs Clin Rem, 2014, 33(4): 281. |
| [6] |
焦效兰, 於东晖, 邹安庆, 等. 高效液相色谱法定人血清及尿中奥拉西坦的浓度[J]. 药学学报, 1994, 29(8): 570. JIAO XL, YU DH, ZOU QA, et al. Methodological study on the determination of oxiracetam concentration in serum and urine by HPLC[J]. Acta Pharm Sin, 1994, 29(8): 570. |
| [7] |
ZHANG Q, WEI Y, ZHANG Q, et al. Enantioselective HPLC determination of oxiracetam enantiomers and application to a pharmacokinetic study in beagle dogs[J]. J Chromatogr B, 2015, 993-994: 9. DOI:10.1016/j.jchromb.2015.04.033 |
| [8] |
WAN X, HE W, MA P, et al. Simultaneous determination of oxiracetam and its degraded substance in rat plasma by HPLCMS/MS and its application to pharmacokinetic study after a single high-dose intravenous administration[J]. J Chromatogr B, 2014, 969: 95. DOI:10.1016/j.jchromb.2014.07.041 |
| [9] |
ZHANG Q, WEI Y, YUE Y, et al. Comparative pharmacokinetic studies of racemic oxiracetam and its pure enantiomers after oral administration in rats by a stereoselective HPLC method[J]. J Pharm Biomed Anal, 2015, 111: 153. DOI:10.1016/j.jpba.2015.03.039 |
| [10] |
常艳. 新药生殖发育毒性评价及胚胎毒性体外筛检方法的建立和应用[D]. 上海: 上海医药工业研究院, 2005 CHANG Y. Reproductive and Developmental Toxicity Evaluation for New Drugs and Establishment and Application of an in vitro Embroyotoxicity Screening Test[D]. Shanghai:Shanghai Institute of Pharmaceutical Industry, 2005 http://cdmd.cnki.com.cn/Article/CDMD-85901-2005125603.htm |
| [11] |
WANG WS, HUI JI, XIE HT, et al. A sensitive and specific UPLCMS/MS analysis and preliminary pharmacokinetic characterization of (S)-oxiracetam in Beagle dogs[J]. Chin J Clin Pharmacol Ther, 2012, 17(9): 988. |
| [12] |
王红梅, 张渊. 奥拉西坦治疗血管性痴呆的疗效与安全性的系统评价[J]. 中国药房, 2013, 24(48): 4581. WANG HM, ZHANG Y. A systematic review of efficacy and safety of oxiracetam for vascular dementia[J]. China Pharm, 2013, 24(48): 4581. DOI:10.6039/j.issn.1001-0408.2013.48.27 |
| [13] |
陈娜, 陆连生, 吕晓培, 等. 奥拉西坦治疗腔隙性脑梗死合并认知功能障碍疗效观察[J]. 河北医药, 2015, 37(10): 1485. CHEN N, LU LS, LV XP, et al. The efficacy of oxiracetam for lacunar cerebral infarction and cognitive impairment[J]. Hebei Med J, 2015, 37(10): 1485. |
| [14] |
王龚奋飞, 梁朵朵. 奥拉西坦联合美多芭治疗帕金森病临床观察[J]. 中国实用神经疾病杂志, 2014, 17(13): 30. WANG GFF, LIANG DD. Clinical observation of oxiracetam combined with madopar in the treatment[J]. Chin J Pract Nerv Dis, 2014, 17(13): 30. |
| [15] |
PARNETTI L. Clinical pharmacokinetics of drugs for Alzheimer's disease[J]. Clin Pharmacokinet, 1995, 29(2): 110. DOI:10.2165/00003088-199529020-00005 |
 2017, Vol. 37
2017, Vol. 37 
