2. 福建农林大学菌草研究所, 福州 350002
2. Juncao Research Institute, Fujian Agriculture and Forestry University, Fuzhou 350002, China
谷胱甘肽是生物体内抗氧化防御系统中最重要的小分子活性寡肽[1],是细胞内含量最丰富的巯基低分子肽[2],具有重要的抗氧化作用和整合解毒作用[3-4],分为还原型谷胱甘肽(N-(N-L-γ-谷氨酰基-L-半胱氨酰基)甘氨酸,GSH)和氧化型谷胱甘肽(N-(N-L-γ-谷胺酰基-L-半胱胺酰基)甘氨酸-2,2-二硫化物,GSSG)。谷胱甘肽与其他寡肽不同,就在于含有1个由半胱氨酸氨基与谷氨酸的γ-羧基构成的特殊肽键[5],主要功能基团半胱氨酸巯基参与还原和共轭反应[6-7]。GSH在自由基、抗氧化剂与营养素及其代谢的协调关系中起着至关重要的作用[8-10],还可抑制某些病原体(病毒和细菌)的复制或存活,具有免疫治疗剂的作用[11]。GSH可清除生物体内有害自由基或脂质过氧化物,使其转换成脂肪酸和水,而GSH被氧化成GSSG。GSH固体较为稳定,但在水溶液中很不稳定,易被氧化成为GSSG,失去其原有的生物活性,给生物体带来不良影响[8]。有报道发现少量的GSSG共存下,对GSH清除自由基有协同催化作用[1],GSH/GSSG的配比对自由基清除率有明显影响:当GSH/GSSG的配比大于50:1时,自由基清除率比同浓度的GSH大,且自由基清除率随GSH和GSSG的绝对浓度的增加而明显增加。2015年版中国药典谷胱甘肽片质量标准的有关物质检查项中新增关于GSSG含量控制的规定[12],即含氧化型谷胱甘肽不得过谷胱甘肽标示量的2.0%。因此,研究控制GSH中GSSG的含量,是谷胱甘肽相关产品生产控制的重点之一。
已有研究表明蛹虫草与谷胱甘肽组方对酒精性肝损伤具有保护作用[13],其作用机制与清除自由基、抑制脂质过氧化作用有关。九苷肽蛹虫草软胶囊以蛹虫草、谷胱甘肽、天然维生素E等为主要原料,制成具有对化学性肝损害有辅助保护功能、增强免疫力功能的保健食品。目前,同时测定GSH和GSSG的方法有液相色谱质谱联用(LC-MS)法[14],报道更多的是液相色谱法(HPLC):有用邻苯二甲醛(OPA)衍生化后以荧光检测器(FLD)检测[10],其样品前处理操作烦琐,所用衍生化试剂即引入新的杂质并可能损伤色谱柱;有采用蒸发光散射检测器(ELSD)[15],但ELSD并非通用检测器,还需要配置高压氮气或空气,在实验室并不普及,其灵敏度远不如紫外检测器,具有一定的的局限性;有的在甲醇流动相中加入磷酸盐缓冲液与庚烷磺酸钠离子对试剂,在紫外波长210 nm处检测[12],由于烷基磺酸盐离子对试剂与色谱柱的固定相结合需要较长的平衡时间,稳定性差,灵敏度较低,加上磷酸盐都有可能破坏色谱系统,对色谱柱损耗大,清洗难等,这些都给检测实验带来许多困难。
因此,本研究开发和验证了同时测定GSH和GSSG的简单、高效、快速、准确,且广泛适用的反相高效液相色谱-紫外检测法,为谷胱甘肽产品的工艺研究和质量控制、评价提供便捷、可靠的方法。
1 仪器与材料LC 20型高效液相色谱仪系统配SPD-M20A型二极管阵列检测器(岛津公司);Atlantis T3(4.6 mm×250 mm,5 µm;填料:高纯度硅胶及三官能团键合十八烷基硅烷;Waters公司)色谱柱;Millipore Direct-Q纯水系统(Millipore公司);KQ-250DE数控超声波清洗器(昆山市仪器有限公司);CPA225D十万分之一电子天平(赛多利斯公司)。
还原型谷胱甘肽对照品(纯度≥98%,批号SLBK1031V,SIGMA公司),氧化型谷胱甘肽对照品(纯度≥98%,批号SLBM9313V,SIGMA公司);甲醇、乙腈及三氟乙酸(TFA)为色谱纯。样品九苷肽蛹虫草软胶囊(每粒0.6 g)由江苏学府生物工程有限公司提供,批号为20140806、20140807、20140808。
2 溶液的制备 2.1 混合对照品溶液分别准确称取对照品(按纯度标示折算)GSH 50.42 mg和GSSG 6.18 mg,置于50 mL棕色量瓶中,以流动相溶解并定容至刻度,制成质量浓度分别为1.008 mg·mL-1和0.124 mg·mL-1的单一成分对照品溶液;各取5 mL上述2种溶液于10 mL棕色量瓶中,以流动相制成质量浓度分别为0.504 mg·mL-1和0.062 mg·mL-1的混合溶液;吸取混合对照品溶液0、1、2、4、5 mL,分别置于10 mL棕色量瓶中,以流动相定容至刻度,混匀,得GSH质量浓度分别为0、50.4、101、202、252、504 μg·mL-1和GSSG质量浓度分别为0、6.2、12、25、31、62 μg·mL-1的混合对照品溶液系列。各溶液均临用新配,冰箱(4 ℃)保存。
2.2 供试品溶液精密称取蛹虫草软胶囊内容物约0.15 g于25 mL棕色量瓶中,以流动相超声(500 W,40 kHz)提取10 min,定容,取上清液过0.45 µm滤膜,即得。溶液均临用新配,冰箱(4 ℃)保存。
2.3 阴性样品溶液根据九苷肽蛹虫草软胶囊配方比例制备不含GSH和GSSG的阴性样品,按“2.2”项下方法制备阴性样品溶液。溶液均临用新配,冰箱(4 ℃)保存。
3 色谱条件及系统适用性试验色谱柱:Waters Atlantis T3(4.6 mm×250 mm,5 µm);流动相:0.1%三氟乙酸-乙腈(95:5);流速:1.0 mL·min-1;检测波长:203 nm;进样量:10 μL;柱温:35 ℃。
在上述色谱条件下,理论塔板数均大于5 000,混合对照品、样品、阴性样品色谱图见图 1。结果表明,GSH和GSSG的色谱峰与相邻峰的分离度均大于1.5,样品中的其他成分对2个待测成分的测定无干扰。
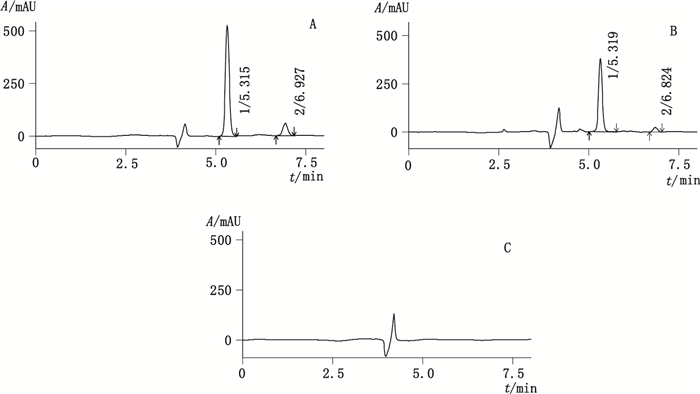
|
1.GSH 2.GSSG 图 1 混合对照品(A)、样品(B)及阴性样品(C)HPLC色谱图 Figure 1 HPLC chromatograms of mixed reference substances(A), sample(B)and negative sample without GSH and GSSG(C) |
取“2.1”项下系列混合对照品溶液进样分析,以谷胱甘肽的质量浓度X与对应的峰面积Y进行线性回归,GSH和GSSG在各自的线性范围内呈良好线性;将混合对照品溶液以流动相逐级稀释后进样测定,按实际样品的处理过程计算,得到2个组分的LOD(S/N=3)。GSH和GSSG的线性关系考察结果及方法检测结果见表 1。
|
|
表 1 GSH和GSSG的线性关系考察及方法检测限测定结果 Table 1 Results of linear and LODs of GSH and GSSG |
精密量取同一供试品溶液10 μL,连续进样6次,结果GSH和GSSG峰面积的RSD为1.7%和3.0%,表明仪器精密度良好。
4.3 稳定性试验取同一供试品溶液,分别于0、4、8、12、24 h进样10 μL进行分析测定,24 h结果供试品溶液中GSH和GSSG峰面积的RSD分别为3.7%和4.1%,表明供试品溶液在24 h内稳定性良好。
4.4 回收率和重复性试验选取样品约75 mg于25 mL量瓶中,对GSH和GSSG进行了3个添加水平(分别加入GSH和GSSG的单一对照品溶液各1、3、5 mL),每个添加水平3份,共9份,按“2.2”项方法制备供试溶液,进样分析,考察方法的回收率和重复性。结果GSH的低、中、高浓度的回收率(n=3) 分别为101.3%、95.2%、96.1%,RSD分别为3.3%、1.6%、2.9%,平均回收率(n=9) 为97.5%;GSSG的低、中、高浓度的回收率(n=3) 分别为98.5%、93.7%、88.1%,RSD分别为3.1%、2.9%、3.8%,平均回收率(n=9) 为93.4%。结果表明样品在不同的添加水平下的回收率及重复性良好。
5 样品测定分别取3批次的样品各3份进行平行测定,以外标法计算含量样品中GSH和GSSG,结果见表 2,表明3批样品中GSSG的量均小于谷胱甘肽总量的2.0%。
|
|
表 2 样品中谷胱甘肽的含量(mg·g-1,n=3) Table 2 Contents of Glutathione in capsules |
分别采用Waters Symmetry C18(十八烷基硅烷键合硅胶,4.6 mm×250 mm,5 µm)、Thermo Beta Basic-18(十八烷基硅烷键合硅胶,4.6 mm×250 mm,5 µm)及Waters Atlantis T3(三官能团键合十八烷基硅烷硅胶,4.6 mm×250 mm,5 µm)对GSH和GSSG混合对照品溶液进样分析,发现2个C18柱分析GSH和GSSG,均未能全部检测出目标峰,而用T3柱则2个成分均能出峰且分离良好。C18柱是长链烷基键合相,有较好的疏水性,适用于分析非极性化合物,而Atlantis T3色谱柱采用三官能团键合C18烷基键合相,保证键合密度,以及优化的孔径和端基封尾技术[16],能提升极性化合物的保留,并能平衡一对不同极性的化合物均有合适的保留。实验表明,T3柱的确适合保留和分析谷胱甘肽,GSH与GSSG在8 min内能有效分离,并且方法开发简便快速,HPLC图谱峰形好,不拖尾,基线相对平稳,灵敏度也满足分析要求。
6.2 流动相的选择现行方法[7]在甲醇流动相中加入磷酸盐缓冲液与庚烷磺酸钠离子对试剂,在紫外波长210 nm处检测。由于烷基磺酸盐离子对试剂与色谱柱的固定相结合需要较长的平衡时间,出峰稳定性差,灵敏度较低,加上磷酸盐都有可能破坏色谱系统,对色谱柱损耗大,清洗难等。三氟乙酸(TFA)是反相色谱分离肽类物质中常用的离子修饰剂。TFA通过与疏水键合相和残留的极性表面以多种模式相互作用,来改善峰形,克服峰展宽和拖尾问题。TFA与肽上的正电荷及极性基团相结合以减少极性保留,并把肽带回到疏水的反相表面。同样,TFA屏蔽了固定相上残留的极性表面。TFA容易挥发,低浓度(0.1%)的TFA对色谱系统损耗小并易除去。TFA的紫外最大吸收峰低于200 nm,对多肽在低波长处的检测干扰很小。考察0.1%TFA-乙腈(95:5) 和0.1%TFA-甲醇(90:10) 等度洗脱效果,结果表明以0.1%TFA-甲醇为流动相时,目标峰附近杂峰干扰严重,基线不平整;而使用0.1%TFA-乙腈时,各目标峰得到完全分离,且基线较平,峰形良好。
6.3 检测波长的选择对GSH和GSSG对照品溶液进行紫外扫描,得到各组分峰的最大吸收波长均在203 nm左右,观察203 nm下样品色谱图,其基线稳定且主峰附近并无干扰峰,因此选定作为检测波长。
6.4 柱温的选择考察30、35、40℃ 3种柱温对供试品溶液中GSH和GSSG分离效果的影响,结果30 ℃时,主成分峰形不够尖锐,GSSG峰拖尾;35 ℃时,主成分特别是GSSG,峰形对称,分离度也满足要求;40 ℃时,GSSG分离度 < 1.5。因此柱温定为35 ℃。
6.5 溶液的稳定性谷胱甘肽的固体较为稳定,但其在水溶液中很不稳定。为进一步研究谷胱甘肽的稳定性变化,分别选取0.1%TFA-乙腈(95:5) 与纯水为提取溶剂,制成小样,分别比较置于棕色瓶与透明瓶,存于冰箱(4℃)与室温(30℃),GSH与GSSG随时间的变化:每24 h进样分析,记录峰面积。结果表明:样品以0.1%TFA-乙腈(95:5) 提取,置于棕色瓶,存于冰箱冷藏,更有利于GSH的稳定性,GSH和GSSG的峰面积在48 h内RSD均 < 4.9%。而纯水提取,置于透明瓶,室温条件下,GSH含量随着时间的延长减少较明显。因此对照品溶液与供试品溶液应临用新配,并存于棕色瓶,低温,并及时进样。
6.6 有关物质检查鉴于中国药典(2015年版)谷胱甘肽片[7]质量标准中有关物质检查项中新增关于对其主要降解产物GSSG含量控制的规定,即含氧化型谷胱甘肽不得过谷胱甘肽标示量的2.0%。本产品谷胱甘肽中含GSSG的量3批次分别为1.8%、1.9%、1.8%,均小于2.0%。目前,保健食品中谷胱甘肽还未有相关质量标准,因此,建议增加含谷胱甘肽保健食品中GSSG的含量控制。
6.7 小结谷胱甘肽片为常用肝病辅助用药,中国药典(2015年版)修订了其质量标准中有关物质检查项,新增关于GSSG含量控制的规定,含量测定采用高效液相色谱紫外检测法,在甲醇流动相中加入磷酸盐缓冲液与庚烷磺酸钠离子对试剂。保健食品中的谷胱甘肽目前并无相关质量标准。本文所建立的蛹虫草软胶囊中GSH和GSSG含量测定方法,采用Waters Atlantis T3色谱柱,以0.1%TFA-乙腈(95:5) 为流动相,检测波长203 nm,方法专属性强,结果准确可靠,操作简单快捷,并建议增加含谷胱甘肽保健食品中GSSG的含量控制,为保健食品中谷胱甘肽的质量控制提供一定的科学依据。
| [1] |
金春英, 崔京兰, 崔胜云. 氧化型谷胱甘肽对还原型谷胱甘肽清除自由基的协同作用[J]. 分析化学, 2009, 37(9): 1349. JIN CY, CUI JL, CUI SY. Synergetic effect by oxidized glutathione for radical scavenging activities of reduced glutathione[J]. Chin J Chem, 2009, 37(9): 1349. |
| [2] |
WU GY, FANG YZ, YANG S, et al. Glutathione metabolism and its implications for health[J]. J Nutr, 2004, 134(3): 489. |
| [3] |
BARFIELD M, SPOONER N, LAD R, et al. Application of dried blood spots combined with HPLC-MS/MS for the quantification of acetaminophen in toxicokinetic studies[J]. J Chromatogr B Anal Technol Biomed Life Sci, 2008, 870(1): 32. DOI:10.1016/j.jchromb.2008.05.025 |
| [4] |
PAULSEN CE, CARROLL KS. Orchestrating redox signaling networks through regulatory cysteine switches[J]. ACS Chem Biol, 2010, 5(1): 47. DOI:10.1021/cb900258z |
| [5] |
HANSENA JM, HARRISB C. Glutathione during embryonic development[J]. Biochim Biophys Acta, 2015, 1850(8): 1527. DOI:10.1016/j.bbagen.2014.12.001 |
| [6] |
FORMAN HJ, ZHANG H, RINNA A. Glutathione:overview of its protective roles, measurement, and biosynthesis[J]. Mol Aspects Med, 2009, 30(1-2): 1. DOI:10.1016/j.mam.2008.08.006 |
| [7] |
KANĎÁR R, ŠTRÁMOVA X, DRÁBKOVÁ P, et al. Determination of total glutathione in dried blood spot samples using a highperformance liquid chromatography[J]. J Chromatogr Sci, 2015, 53(6): 879. DOI:10.1093/chromsci/bmu135 |
| [8] |
方允中, 杨胜, 伍国耀. 自由基、抗氧化剂、营养素与健康的关系[J]. 营养学报, 2003, 25(4): 340. FANG YZ, YANG S, WU GY. Free radicals, antoxidants, and nutrients in relation to health[J]. Acta Nutr Sin, 2003, 25(4): 340. |
| [9] |
MUSGRAVE WB, YI H, KLINE D, et al. Probing the origins of glutathione biosynthesis through biochemical analysis of glutamate-cysteine ligase and glutathione synthetase from a model photosynthetic prokaryote[J]. Biochem J, 2013, 450(1): 63. DOI:10.1042/BJ20121332 |
| [10] |
GAWLI MKRZYZANOWSKA W, BOGUMILA GM, et al. Optimization of determination of reduced and oxidized glutathione in rat striatum by HPLC method with fluorescence detection and pre-column derivatization[J]. Acta Chromatogr, 2014, 24(2): 335. |
| [11] |
FRATERNALE A, BRUNDU S, MAGNANI M. Glutathione and glutathione derivatives in immunotherapy[J]. Biol Chem, 2017, 398(2): 261. |
| [12] |
中国药典2015年版. 二部[S]. 2015: 512 ChP 2015. Vol Ⅱ[S]. 2015:512 |
| [13] |
颜燕, 谢玮, 郭婕, 等. 人工蛹虫草与谷胱甘肽组方对酒精性肝损伤保护作用的实验研究[J]. 毒理学杂志, 2014, 28(6): 471. YAN Y, XIE W, GUO J, et al. Experimental study of artificial Cordyceps and glutathione prescription for the protective effect of alcoholic liver injury[J]. J Toxicol, 2014, 28(6): 471. |
| [14] |
RABAB MS, GHADA MH, RANDA AAS, et al. Quantitative determination of glutathione in presence of its degradant in a pharmaceutical preparation using HPLC-DAD and identification by LC-ESI-MS[J]. J Liq Chromatogr Relat Technol, 2013, 37(4): 548. |
| [15] |
林志兴, 吕永琴, 谭天伟. 高效液相色谱-蒸发光散射检测器定量分析谷胱甘肽含量[J]. 食品与发酵工业, 2007, 33(4): 119. LIN ZX, L YQ, TAN TW. Quantification analysis of glutathione by HPLC with evaporative light scatter detector(ELSD)[J]. Food Ferment Ind, 2007, 33(4): 119. |
| [16] |
林宏琳. HPLC法同时测定核苷酸花粉胶囊中5种核苷酸含量[J]. 药物分析杂志, 2015, 35(12): 2121. LIN HL. Simultaneous determination of five kinds of nucleotids in nucleotide pollen capsules by HPLC[J]. Chin J Pharm Anal, 2015, 35(12): 2121. |
 2017, Vol. 37
2017, Vol. 37 