2. 衢州市食品药品检验研究院, 衢州 324002
2. Quzhou Institute for Food and Drug Control, Quzhou 324002, China
蜂蜜是指蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物结合后,经充分酿造而成的天然甜物质[1]。蜂蜜营养物质丰富,主要包括碳水化合物、蛋白质、矿物质、维生素、有机酸、黄酮、酚酸、酶和其他的植物化学物质[2]。其中黄酮类成分含量较微,但种类繁多,包括黄酮、黄酮醇、二氢黄酮、异黄酮、花色素类及黄烷-3,4-二醇类等,是一类广泛存在于植物中的次生代谢产物[3],是很好的植物源标记物,其中黄酮化合物的种类受其植物来源的影响。目前,在不同蜂蜜中发现的黄酮类成分已经有几十余种,包括苷元和苷类成分,如:Martos等[4-5]发现澳大利亚的灌木凝胶蜜和桉树蜜中均含有槲皮素、毛地黄黄酮和山柰酚,但灌木凝胶蜜中不含五羟基黄酮;Yao等[6]发现澳大利亚和欧洲桉树蜜中均含有五羟基黄酮、槲皮素和木樨草素等。但是,比较少发现有一种黄酮类化合物在某种蜜中独有的情况,大多数都是以某组化合物的形式出现。王笑笑等[7]以洋槐花作为“对照药材”同时分析洋槐蜜与洋槐花中的黄酮类组分时发现洋槐蜜与洋槐花中同时含有柚皮素、槲皮素、木犀草素、染料木素、山柰酚、芹菜素和汉黄芩素,且在含量上存在一定的相关性,并指出以蜜源花作为“对照药材”寻找蜂蜜中的特征黄酮类组分具有一定的可行性意义。本文以柑橘蜜、油菜蜜和紫云英蜜及其蜜源花作为研究对象,寻找各自的共有组分,并比较三者之间的差异性。
1 仪器与试药液质联用仪由岛津公司LC-30AD型超高效液相系统和LCMS-8040型三重四极杆串联质谱仪组成,配有Nexera X2 LC-30AD二元高压梯度泵、SIL-30AC自动进样器、CTO-20AC柱温箱、电喷雾离子源、PEAK氮气发生器和Lab Solution工作站;Inertsil ODS-3色谱柱(2.1 mm×75 mm,2 µm;填料为十八烷基硅烷键合硅胶;岛津公司);成都超纯科技有限公司UPT-Ⅱ-10T型制水器;梅特勒-托利多公司XS-205型电子天平;梅特勒-托利多公司ME1002E型电子天平。
儿茶素(批号877-200001,纯度100%)、表儿茶素(批号110878-200102,纯度100%)、芦丁(100080-200707,供含量测定用纯度为90.5%)、木犀草素(批号111520-200504,100%)、芹菜素(批号111901-201102,纯度99.6%)、染料木素(批号111704-201302,纯度99.1%);高良姜素(批号111699-200501,纯度100%);汉黄芩素(批号1514-200202,供鉴别用)购于中国食品药品检定研究院;白杨素(批号00003620-001,仅供定性用)、槲皮素(批号00017030-566,纯度95.0%)、山柰酚(批号00011021-901,纯度97.7%)、生松素(批号00016840-158,仅供定性用)、杨梅素(批号00013921-524,纯度95.3%)、桑黄素(批号00013896-415,纯度91.0%),柚皮素(纯度00014205-603,纯度98.7%)购于ChromaDex公司;芸香柚皮苷(批号MUST-13041206,纯度≥98%)购于中国科学院成都生物研究所。超纯水(用于配制流动相)和蒸馏水均由UPT-Ⅱ-10T型制水器当日制备,电阻率>18 mΩ;D101型大孔吸附树脂(净品型),天津市海光化工有限公司;甲醇为色谱纯,其他试剂均为分析纯。
本文中所用蜂蜜分别由浙江千红蜂产业有限公司(简称千红)、浙江江山恒亮蜂产品有限公司(简称恒亮)、胡氏蜂蜜、金华蜂农、董家蜂农和姜氏蜂农处分批购入。所用油菜花、柑橘花和紫云英花由本人亲自采摘或蜂农提供。另有玫瑰花蜜是从市场上购买,用于蜂蜜的提取回收率和基质效应等方法学验证试验。具体信息见表 1。
|
|
表 1 蜂蜜及蜜源花样本信息汇总 Table 1 Information of honeys and their related flowers |
色谱柱:Inertsil ODS-3(2.1 mm×75 mm,2 µm);流动相:甲醇(A)-0.02%甲酸水溶液(B),梯度洗脱(0~5 min,2%A→15%A;5~10 min,15%A→17%A;10~15 min,17%A→32%A;15~30 min,32%A→42%A;30~40 min,42%A;40~45 min,42%A→50%A;45~50 min,50%A→65%A;50~55 min,65%A→70%A;55~56 min,70%A→2%A;56~58 min,2%A);流速:0.4 mL·min-1;柱温:40 ℃;进样量:2 µL。
2.2 质谱条件采用电喷雾离子源(ESI),多反应监测(MRM),离子源参数设置:雾化气流量3 L·min-1,脱溶剂温度250 ℃,加热块温度400 ℃,载气流量15 L·min-1;不同对照品的母离子质量数(Q1) m/z、子离子质量数(Q3) m/z、驻留时间(dwell time)、Q1 Pre Bias、碰撞电压(CE)和Q3 Pre Bias具体情况见表 2。
|
|
表 2 质谱参数值 Table 2 Parameters of mass spectrometry |
分别精密称取儿茶素、表儿茶素、桑黄素和山柰酚的对照品适量,置同一100 mL量瓶中;其余12种对照品分别以甲醇为溶剂配制成一定浓度的对照品溶液,再精密量取1 mL置上述100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成含儿茶素83.5 µg·mL-1,表儿茶素56.2 µg·mL-1,芸香柚皮苷4.76 µg·mL-1,芦丁1.307 µg·mL-1,桑黄素40.2 µg·mL-1,杨梅素9.00 µg·mL-1,柚皮素0.69 µg·mL-1,槲皮素4.495 µg·mL-1,染料木素4.055 µg·mL-1,木犀草素3.665 µg·mL-1,山柰酚163.0 µg·mL-1,芹菜素1.072 µg·mL-1,生松素1.18 µg·mL-1,汉黄芩素0.353 µg·mL-1,白杨素2.925 µg·mL-1,高良姜素11.12 µg·mL-1的混合溶液,即得。
2.4 蜜源的提取纯化样品处理方法参考了文献[2-3]中蜂蜜的提取方法:取蜂蜜100 g,加入pH为2.0的盐酸溶液500 mL,搅拌溶解后用盐酸溶液调节pH至2.0,再加入已处理好的D101型大孔吸附树脂(粒度范围0.3~1.2 mm)150 g,搅拌10 min,装柱,用酸水(盐酸调节pH至2.0的水溶液)250 mL和蒸馏水300 mL先后冲洗柱子除去糖及其他组分,再用甲醇400 mL以每秒1~2滴的流速解吸附,收集甲醇,40 ℃低温旋转蒸干;最后用蒸馏水10 mL溶解,水溶液用乙醚(10、10、10 mL)提取纯化3次,合并乙醚液,水浴蒸干,甲醇溶解至10 mL量瓶中,摇匀,用微孔滤膜(0.22 µm)滤过,取续滤液作为供试品溶液。供试品的总离子流(TIC)色谱图见图 1。
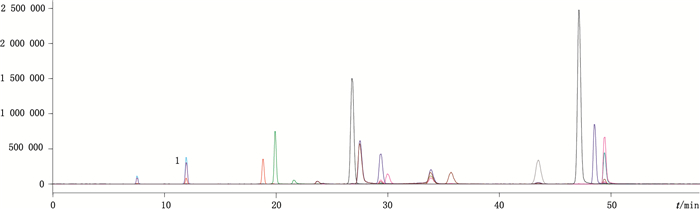
|
1.儿茶素(catechin) 2.表儿茶素(epicatechin) 3.芸香柚皮苷(narirutin) 4.芦丁(rutin) 5.杨梅酮(myricetin) 6.桑黄素(morin) 7.柚皮素(naringenin) 8.槲皮素(quercetin) 9.染料木素(genistein) 10.木犀草素(luteolin) 11.山柰酚(kaempferol) 12.芹菜素(apigenin)13.生松素(pinocembrin) 14.汉黄芩素(wogonin) 15.白杨素(chrysin) 16.高良姜素(galangin) 图 1 16个黄酮类化合物的总离子流图 Figure 1 The total ion chromatography of 16 flavonoids |
蜜源花的提取参照王笑笑、颜伟华等的报道[7]:取自然阴干的样本2.0 g,粉碎过2号筛,加入pH 2的酸水溶液80 mL,加热提取1 h,放冷,滤过,滤液加入D101型大孔吸附树脂150 g,搅拌10 min,装柱,先用蒸馏水300 mL冲洗柱子,再用甲醇400 mL以每秒1~2滴的流速解吸附,收集甲醇,40 ℃低温旋转蒸干,采用甲醇溶解至10 mL量瓶中,定容即得。
2.6 方法学考察本次实验方法学的考察内容主要有:最低检测限、最低定量限、线性、精密度、稳定性、蜂蜜的提取回收率和基质效应等,考察结果具体参照王笑笑等[8]的研究报道。
2.7 样本测定按照“2.4”和“2.5”项下方法制备供试品溶液,按上述色谱与质谱条件分别进样2 µL,以外标法计算各黄酮类组分含量,结果见表 3。
|
|
表 3 油菜花蜜、柑橘蜜和紫云英蜜及其蜜源花的测定结果(μg·kg-1) Table 3 Analysis results of canola flower honey, citrus honey, milk vetch honey and their nectar flowers |
从表 3可以看出:油菜花蜜和油菜花中同时检出柚皮素、槲皮素和汉黄芩素;油菜蜜中槲皮素的含量较高,柚皮素较低,汉黄芩素少量;油菜蜜中检出少量生松素、白杨素和染料木素,而花中未检出,其中生松素和白杨素应该是由蜜蜂从蜂蜡或蜂胶蜂巢中带入[9];油菜花蜜1和3检出了大量的山柰酚,油菜花蜜2中未检出,而油菜花中未检出,首先,不同批次油菜花中山柰酚的含量不同可能与地域或采收期有关,也可能与蜂蜜的质量有关,而蜜源与蜜源花间含量差异大,可能与花中含有大量山柰酚的苷类成分有关。邢建军等[10]曾采用离子阱液质联用仪检测出10种黄酮类化合物和4种未知化合物,杨洁[11]采用HPLC-ESI-MS/MS在油菜蜜中检出17种黄酮类化合物(经外标法比较得出的有6种,经质谱分析得出的有9种,还有2种不确定)。两者与本次分析结果交叉一致的有9种,包括柚皮素、槲皮素、木犀草素、汉黄芩素、山柰酚、芹菜素、高良姜素、白杨素和生松素等,本次实验同时做了定量分析,定量结果与齐桂平等[12]采用HPLC-ECD法测定油菜蜜中5种酚类化合物含量和杨洁[12]采用HPLC法建立油菜蜜的指纹图谱结果相似:山柰酚和槲皮素的含量在已知黄酮类物质中所占比例较大。杨洁[11]采用HPLC-ESI-MS/MS分析油菜蜜中黄酮类组分结果发现采用XAD-2树脂分离得到的样本中未检出杨梅酮,采用超声波法在油菜花粉中检出柚皮素、槲皮素和山柰酚、未检出生松素,而本次使用的油菜花未将花和花粉分开进行检测,油菜花又是富含花粉的花,故不论是油菜蜜还是油菜花的检测结果均与杨洁的检测结果相似。同时,本次实验还对染料木素进行了定性和定量分析,发现在油菜蜜中检出了少量的染料木素,但花和花粉中均未检出,是第一次在油菜蜜中鉴定出来的黄酮类物质,其能否成为油菜蜜的标记物需要大量的样本进一步确定。
3.2 柑橘花与柑橘蜜检测结果本次实验中,在柑橘蜜与柑橘花中同时检出柚皮素、木犀草素、芹菜素和汉黄芩素;在柑橘花中检出大量的芸香柚皮苷、芦丁、柚皮素和木犀草素,少量的芹菜素和汉黄芩素,未检出槲皮素、染料木素、山柰酚、白杨素、生松素和高良姜素;在柑橘蜜中检出大量的槲皮素、山柰酚、汉黄芩素和高良姜素,少量的柚皮素、木犀草素、芹菜素和白杨素,此检测结果与Isabel Escriche等[13]的检测结果相似。芦丁的苷元为槲皮素,这是柑橘花中未检出槲皮素而柑橘蜜中检出大量槲皮素的原因。柑橘蜜中的汉黄芩素含量相对其他成分较少,但与其他蜜源蜂蜜中的汉黄芩素含量相比要高很多,故也可作为柑橘蜜的特征性组分之一[8]。
3.3 紫云英花与紫云英蜜检测结果紫云英蜜与紫云英花中同时检出大量的槲皮素和山柰酚,少量的芹菜素和汉黄芩素;在紫云英蜜中还检出了少量的木犀草素和大量的生松素、白杨素、高良姜素;在紫云英花中检出了少量的染料木素。而孙崇臻等[14]在紫云英蜜中检出大量的杨梅酮和槲皮素,检出少量的柚皮素、木犀草素和山奈酚,未检出芹菜素;郭夏丽等[15]在紫云英蜜中检出的木犀草素、山奈酚、生松素、染料木素和白杨素的含量以及未检出槲皮素和芹菜素等,均与本次实验结果有较大的差异。还有更为特殊的成分——染料木素:洋槐蜜和洋槐花中同时检出较多的染料木素;而仅在油菜蜜和紫云英花中检出少量的染料木素,那么,染料木素在不同蜜源蜂蜜中的存在情况如何?这些都有待收集更多的蜂蜜样本进行统计分析才能进一步确认。
3.4 展望此次通过同时分析蜜源花及其蜂蜜发现:有些蜂蜜中大量存在的黄酮苷元在花中的含量较少,如柑橘蜜和紫云英蜜中的槲皮素,油菜花蜜中的山柰酚等,都是花中量低或极少而蜜中大量检出。其中槲皮素的含量高是因为花中芦丁等以槲皮素为苷元的糖苷类化合物经水解酶水解而成。而油菜花中的山柰酚的来源经查阅文献发现主要来自于油菜花粉。杨必成等[16]研究发现酶发酵破壁法和酸水解处理对黄酮类成分影响极大,未经酸水解的未破壁花粉中槲皮素、山柰酚和异鼠李素的含量极低,而经破壁或酸水解处理后三者的含量以10~70倍比例升高,且含量以山柰酚最高,槲皮素其次,异鼠李素较低。这与本次研究结果相似:油菜花蜜中槲皮素含量略低于山柰酚,但其中酸水解前后苷元的含量变化与本次实验结果有一定的差异,这可能与提取方法不同有关。由此发现本次实验采用pH为2的盐酸水溶液提取蜜源花中的黄酮类成分的方法还有待进一步的改进。
本方法采用UPLC-MS/MS法同时分析不同蜜源及其蜜源花中的黄酮类组分,分析结果再一次验证了以蜜源花作为“对照”研究蜂蜜中的黄酮类组分具有一定的意义:① 寻找共有组分作为特征性组分具有更可靠性;② 蜂蜜中黄酮类组分及其含量的数据来源具有可追溯性;③ 可以从两者之间的差异性发现差异的来源并可作为下一步研究的依据。该方法专属性强、灵敏度高,但也存在着无法对未知化合物进行准确鉴定的缺陷,需要更为高端的仪器加入此领域的检测行列。
| [1] |
曹炜, 尉亚辉. 蜂产品保健原理与加工技术[M]. 北京: 化学工业出版社, 2002, 198. CAO W, WEI YJ. Bee Health Principles and Processing Technology[M]. Beijing: Chemical Industry Press, 2002, 198. |
| [2] |
RAMANAUSKIENE K, STELMAKIENE A, BRIEDIS V, et al. The quantitative analysis of biologically active compounds in Lithuanian honey[J]. J Agric Food Chem, 2012, 132(3): 1544. DOI:10.1016/j.foodchem.2011.12.007 |
| [3] |
王锦梅, 程妮, 丰凡, 等. 单花种蜂蜜植物源黄酮标记物的研究进展[J]. 食品与发酵工业, 2013, 39(1): 161. WANG JM, CHENG N, FENG F, et al. Research of flavonoids as botanical origin markers of monofloral honey[J]. Food Ferment Ind, 2013, 39(1): 161. |
| [4] |
MARTOS I, FERRERES F, TOMÁS-BARBERÁN FA. Identification of flavonoid markers for the botanical origin of Eucalyptus honey[J]. J Agric Food Chem, 2000, 48(5): 1498. DOI:10.1021/jf991166q |
| [5] |
MARTOS I, FERRERES F, YAO LH, et al. Flavonoids in monospecific Eucalyptus honeys from Australia[J]. J Agric Food Chem, 2000, 48(10): 4744. DOI:10.1021/jf000277i |
| [6] |
YAO L H, JIANG Y MD ARCY B, et al. Quantitative high performance liquid chromatography analyses of flavonoids in Australian Eucalyptus honeys[J]. J Agric Food Chem, 2004, 52(2): 210. DOI:10.1021/jf034990u |
| [7] |
王笑笑, 颜伟华, 黄华, 等. UPLC-MS/MS法分析洋槐蜜及其蜜源花中的黄酮类成分[J]. 药物分析杂志, 2017, 37(5): 796. WANG XX, YAN WH, HUANG H, et al. Analysis of flavonoids in acacia honey and locust flower by UPLC-MS/MS[J]. Chin J Pharm Anal, 2017, 37(5): 796. |
| [8] |
王笑笑, 周勇, 俞婷婷, 等. UPLC-MS/MS法分析10种不同蜜源蜂蜜中的黄酮类组分[J]. 药物分析杂志, 2016, 36(12): 2180. WANG XX, ZHOU Y, YU TT, et al. Flavonoids components analysis of ten different kind of nectar honey by UPLC-MS/MS[J]. Chin J Pharm Anal, 2016, 36(12): 2180. |
| [9] |
TRUCHADO P, FERRERES F, BORTOLOTTI L, et al. Nectar flavonol rhamnosides are floral markers of Acacia(Robinia pseudacacia)Honey[J]. J Agric Food Chem, 2008, 56(19): 8815. DOI:10.1021/jf801625t |
| [10] |
刑建军, 杨洁, 郑国伟, 等. XAD-2树脂对油菜蜂蜜中黄酮类物质分离条件的优化[J]. 中国蜂业, 2010, 61(12): 9. XING JJ, YANG J, ZHENG GW, et al. Isolation and identification of flavonoids on rape honey through column chromatography and LC/MS/MS[J]. Apic China, 2010, 61(12): 9. DOI:10.3969/j.issn.0412-4367.2010.12.002 |
| [11] |
杨洁. 油菜蜂蜜中黄酮定量、定性分析及指纹图谱的初步建立[D]. 武汉: 华中农业大学, 2011 YANG J. Identification and Quantitative Analysis of Flavonoids and the Establishment of Fingerprint in Rape Honey[D]. Wuhan:Huazhong Agricultural University, 2011 |
| [12] |
齐桂平, 胡月婷, 杨玉杉, 等. 油菜蜜中5种酚类化合物的HPLCECD法测定[J]. 食品与发酵工业, 2010, 36(1): 131. QI GP, HU YT, YANG YS, et al. Determination of five phenolic components in rape honey by HPLC-ECD[J]. Food Ferment Ind, 2010, 36(1): 131. |
| [13] |
ESCRICHE I, KADAR M, JUAN-BORRÁS M, et al. Using flavonoids, phenolic compounds and headspace volatile profile for botanical authentication of lemon and orange honeys[J]. Food Res Int, 2011, 44(5): 1504. DOI:10.1016/j.foodres.2011.03.049 |
| [14] |
孙崇臻, 王超, 蔡子哲, 等. 高效液相色谱测定蜂蜜中的脱落酸、黄酮和酚酸[J]. 食品科学, 2013, 34(10): 281. SUN CHZH, WANG CH, CAI ZZH, et al. Determinaton of flavonoids, phenolic acids and abscisic acid in honeys of different floral origins by HPLC[J]. Food Sci, 2013, 34(10): 281. DOI:10.7506/spkx1002-6630-201310062 |
| [15] |
郭夏丽, 罗丽萍, 冷婷婷, 等. 7种不同蜜源蜂蜜的化学组成及抗氧化性[J]. 天然产物研究与开发, 2010, 22(4): 665. GUO XL, LUO LP, LENG TT, et al. Chemical compositions and antioxidant activities of seven honeys from different floral sources[J]. Nat Prod Res Dev, 2010, 22(4): 665. |
| [16] |
杨必成, 刘海, 杨义芳, 等. 油菜花粉中黄酮类化合物的提取与分析[J]. 中草药, 2011, 42(12): 2451. YANG BC, LIU H, YANG YF, et al. Extraction and analysis of flavonoids in rape bee pollen from Brassica campestis[J]. Chin Tradit Herb Drugs, 2011, 42(12): 2451. |
 2017, Vol. 37
2017, Vol. 37 
