2. 甘肃省医学科学研究院, 兰州 730050;
3. 甘肃中医药大学, 兰州 730030
2. Gansu Academy of Medical Science, Lanzhou 730050, China;
3. Gansu University of TCM, Lanzhou 730030, China
紫斑牡丹(Paeonia rockii)为毛茛科(Ranunculaceae)芍药属(Paeonia)牡丹组(Sect.Moutan)多年生落叶灌木,又名甘肃牡丹、西北牡丹,因花瓣基部有1个明显的色斑而得名[1],是我国中西部地区的特有中药材和花中珍品,分布于四川北部、甘肃南部、陕西秦岭中段以西,也是仅次于中原牡丹品种群的第二大品种群[2],被列为国家珍稀濒危三级重点保护植物[3]。近十年来紫斑牡丹在甘肃陇南、天水、定西、临夏、兰州等地广泛种植,不仅是一种重要的观赏植物,其根皮作为药用丹皮被甘肃省中药材标准收载[4-5]。我国自公布了油菜花粉、松花粉、向日葵花粉、紫云英花粉、养麦花粉、高粱花粉可作为药食兼用花粉之后,花粉作为普通食品得到应有的重视[6-7]。目前国内有关紫斑牡丹花粉发育的细胞形态学[8]、胚离体培养[9-10]、染色体核型[11]、脂肪酸组成[3]、繁殖技术[12]等方面的研究较多,但尚未见对紫斑牡丹花粉氨基酸含量分析的报道。氨基酸的常用检测方法有毛细管电泳法[13]、近红外法[14]、氨基酸分析仪法[15]及高效液相色谱法[16],其中,利用氨基酸分析仪进行样本的测定,方法稳定成熟。为此,本试验采用该法,对甘肃产紫斑牡丹花粉氨基酸的含量进行分析,希冀为其进一步开发利用提供参考。
1 仪器与试药SYKAM公司S-433D氨基酸全自动分析仪(含S7130溶剂存放单元、S5200全自动进样器、S4300氨基酸反应模块、S2100梯度泵);LCAK06/Na型磺酸基强酸性阳离子交换树脂色谱柱(4.6 mm×150 mm,赛卡姆公司产品);Organomation公司N-WVAP 112型氮吹仪;Mettler公司S220-K型酸度计;上海精宏实验设备有限公司恒温干燥箱;Sartorius公司BSA224S-CW型电子天平;默克化工技术(上海)有限公司Milli-Q advantage A 10超纯水系统。
氨基酸对照品(批号SLBM6769V,供氨基酸鉴别和含量测定用,包括Ala、Arg、Asp、Cys、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Pro,Ser、Thr、Tyr、Val),由SIGMA-ALDRICH公司提供;甲醇为色谱纯,水为超纯水,茚三酮及其他试剂均为优级纯。
花粉采集于兰州新区兰州中川牡丹产业有限公司牡丹园,原植物经兰州中川牡丹产业有限公司赵潜龙高级工程师鉴定为毛茛科芍药属植物紫斑牡丹[Paeonia rockii(S.G.Haw.et Laeuner)T.Hang et T.J.Li];破壁紫斑牡丹花粉(破壁率达100%)由甘肃省医学科学研究院药物所提供。
2 方法与结果 2.1 溶液的制备 2.1.1 试液缓冲液A:称取柠檬酸三钠11.8 g及柠檬酸6 g,加入约300 mL的水溶解,再加入乙醇65 mL和浓盐酸5.6 mL,然后用水稀释至1 L(浓盐酸调pH至3.45),并用0.45 μm滤膜过滤,即得。
缓冲液B:称取柠檬酸三钠19.6 g,氢氧化钠3.1 g,硼酸5.0 g,加水溶解并稀释至1 L(浓盐酸调pH至10.85),并用0.45 μm滤膜过滤,即得。
再生液C:称取氢氧化钠20.0 g,乙二胺四乙酸0.2 g,用水溶解并稀释至1 L,并用0.45 μm滤膜过滤,即得。
样品稀释液:称取柠檬酸三钠11.8 g,浓盐酸10.4 mL,用水溶解并稀释至1 L(浓盐酸调pH至2.20),并用0.45 μm滤膜过滤,即得。
茚三酮衍生化试剂:称取茚三酮20 g,苯酚2 g,加入600 ml甲醇中,不断搅拌至茚三酮完全溶解,用0.45 μm的滤膜过滤,然后向滤液中加入400 mL钾钠缓冲液(醋酸钾196.0 g和三水乙酸钠272.0 g用适量去离子水溶解,再加入乙酸200 mL,用去离子水定容至1 L,用0.45 μm滤膜过滤,即得),转移至茚三酮试剂瓶中,用氮气从底部吹大约3~5 min,即得。
2.1.2 混合对照品溶液精密量取取混合氨基酸对照品适量,加稀释液制成浓度为50 nmol·L-1(胱氨酸)和100 nmol·L-1(其余16种氨基酸)的混合溶液,即得。4 ℃保存。
2.1.3 供试品溶液精密称取已过80目筛的样品粉末0.2 g,置于水解管中,加6 mol·L-1盐酸10 mL,加入新蒸馏的苯酚3滴;将水解管置于-18 ℃冰箱中冷冻5 min后,通氮气封口,置110 ℃烘箱内水解22 h,取出放冷至室温,打开水解管,将水解液过滤后,用去离子水多次冲洗水解管,将水解液全部转移至250 mL量瓶中,用去离子水定容;吸取上述溶液1 mL于10 mL烧杯内,蒸干,残留物用1 mL水溶解,再蒸干,反复进行2次。将残渣用1 mL样品稀释液溶解至离心管中,10 000 r·min-1离心10 min,0.45 μm微孔滤膜滤过,即得。
2.2 色谱条件色谱柱:LCAK 06/Na型磺酸基强酸性阳离子交换树脂色谱柱(4.6 mm×150 mm,5 μm);流动相:缓冲液A、缓冲液B、再生液C;衍生化试剂:茚三酮;梯度洗脱程序见表 1;流速:A泵(洗脱泵)0.45 mL·min-1,M泵(衍生泵)0.25 mL·min-1;检测波长:440 nm(脯氨酸)和570 nm(其余氨基酸);进样量:50 μL。
|
|
表 1 梯度洗脱程序 Table 1 Gradient elution program |
分别精密吸取上述混合对照品溶液和供试品溶液各50 μL,按“2.2”项下色谱条件进行测定。结果选择2个检测波长440 nm(脯氨酸)和570 nm(其余氨基酸),混合对照品和样品中的氨基酸得到了很好的分离,色谱图见图 1。
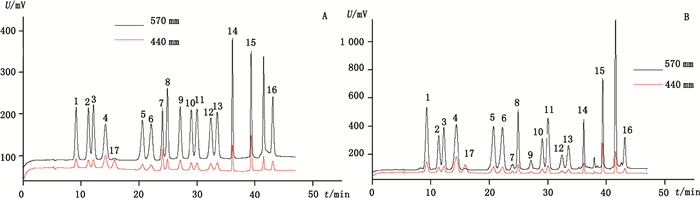
|
1.天冬氨酸(Asp) 2.苏氨酸(Thr) 3.丝氨酸(Ser) 4.谷氨酸(Glu) 5.甘氨酸(Gly) 6.丙氨酸(Ala) 7.缬氨酸(Val) 8.蛋氨酸(Met) 9.胱氨酸(Cys) 10.异亮氨酸(Ile) 11.亮氨酸(Leu) 12.酪氨酸(Tyr) 13.苯丙氨酸(Phe) 14.组氨酸(His) 15.赖氨酸(Lys) 16.精氨酸(Arg) 17.脯氨酸(Pro) 图 1 混合对照品(A)和紫斑牡丹花粉样品(B)色谱图 Figure 1 HPLC chromatograms of mixed amino acids standard(A)and Paeonia rockii pollen sample(B) |
分别精密吸取混合对照品溶液,配制成浓度分别为20、40、80、160、200 nmol·L-1的系列对照品溶液,按上述色谱条件注入氨基酸分析仪,测定峰面积,以峰面积Y对氨基酸质量浓度X(μg·mL-1)进行线性回归,得回归方程见表 2。
|
|
表 2 17种氨基酸的线性关系 Table 2 Linear relations of 17 amino acids |
精密吸取“2.4.1”项下浓度为160 nmol·L-1的混合对照品溶液50 μL,按上述色谱条件连续进样5次,测定峰面积,结果17种氨基酸峰面积的RSD在0.10%~1.6%之间,表明仪器精密度良好。
2.4.3 重复性试验精密称取同一批次未破壁花粉样品5份,按“2.1.3”项下方法平行制备供试品溶液,按上述色谱条件测定含量,结果RSD为0.20%~1.5%,表明本方法重复性良好。
2.4.4 加样回收率试验精密称取已知含量的未破壁花粉样品200 mg,共6份,分别精密加入相当于样品各待测氨基酸原有量100%的各对照品,按“2.1.3”项下方法制备供试溶液,按“2.2”项下条件进样分析,结果见表 3,表明该方法加样回收试验结果良好。
|
|
表 3 样品加样回收试验(n=6) Table 3 Results of recovery test |
精密称取破壁前后紫斑牡丹花粉样品,分别按“2.1.2”项下方法平行制备供试品溶液各3份;按上述色谱条件,分别精密吸供试品溶液各50 μL进样测定,以外标法计算含量,测定结果:破壁前紫斑牡丹花粉中平均总氨基酸含量为31.669%,破壁紫斑牡丹花粉中平均总氨基酸含量为33.048%,见表 4。
|
|
表 4 紫斑牡丹花粉中水解氨基酸的测定结果(%,n=3) Table 4 The contents of amino acids in Paeonia rockii pollen |
本研究前期利用福斯凯氏定氮仪对紫斑牡丹花粉中氮含量进行测定,结果表明含氮量为62.16 g·kg-1,依氮与蛋白质的换算系数6.25[17]进行计算,该花粉中粗蛋白含量为38.85%。结合粗蛋白含量,对供试品溶液制备称样量进行考察,分别称取含蛋白质20、60、120、240、300及360 mg的样品进行水解,制备供试品溶液,以各峰面积的总和计,评价最佳样品取样量。含量测定结果表明,伴随着取样量的增加,各供试品溶液中色谱峰峰面积总和近乎呈现线性增加,而后增加不明显。最终确定最佳取样量为约含蛋白质20~120 mg。
3.2 最佳酸水解浓度的选择考察了不同浓度盐酸(3、6、9 mol·L-1)水解作用的影响,以各峰面积总和计算,结果表明随着盐酸浓度的增加,各色谱峰的峰面积增加。但用9 mol·L-1盐酸进行样品水解时,水解管上层可见有少量已碳化的黑色颗粒,同时各色谱峰面积总和降低,且小于用6 mol·L-1盐酸进行样品的水解;综合考量,最终确定用6 mol·L-1盐酸作为水解溶剂。
3.3 小结花粉是植物生命的精华,具有很高的营养价值、药用价值和区域的特有性,富含蛋白质、黄酮等多种活性成分。在花粉的利用过程中,由于其外部有一层坚硬的孢子壁,阻碍了内部营养物质的溶出,破壁有利于活性物质的释放[3],提高生物利用率。通过对紫斑牡丹花粉破壁前后水解氨基酸的含量进行测定,发现花粉破壁前后氨基酸的总量及各氨基酸含量没有显著性差异,究其原因可能与它们均经过水解且都水解的比较彻底有关。
目前,国内外氨基酸分析方法主要采用衍生化分析法,分为柱前、柱上和柱后衍生化3种模式,有各自的优势[18-19]。本试验将样品酸水解处理,采用柱后衍生阳离子交换色谱法,建立的测定甘肃紫斑牡丹花粉中17种氨基酸的方法,具有操作方便、快捷、稳定性好等特点。分析结果表明:紫斑牡丹花粉中,含有人体必须氨基酸总含量达130.6 mg·g-1,营养丰富,值得深入开发和利用。
| [1] |
李熙莉, 李平平, 岳桦. 紫斑牡丹研究进展[J]. 北方园艺, 2007(5): 129. LI XL, LI PP, YUE H. Advances of the study on Paeonia rockii[J]. Northern Hortic, 2007(5): 129. |
| [2] |
何登文. 紫斑牡丹的研究概况[J]. 甘肃中医, 2005, 18(3): 34. HE DW. A brief review on Paeonia rockii[J]. Gansu J Tradit Chin Med, 2005, 18(3): 34. |
| [3] |
李子璇, 秦公伟, 何建华, 等. 紫斑牡丹种仁种皮中脂肪酸组成比较分析[J]. 种子, 2010, 29(1): 34. LI ZX, QIN GW, HE JH, et al. Comparative analysis of fatty acids in seed kernel and seed coat of Paeonia rockii[J]. Seed, 2010, 29(1): 34. |
| [4] |
甘肃省卫生厅. 关于颁布《第四批24种中药材质量标准(试行)》的通知[S]. 1996: 58 Gansu Health Department. Notice on Promulgating Fourth Batch Quality Standard of 24 Kinds Chinese Herbal Medicine(Trial Implementation)[S]. 1996:58 |
| [5] |
杨树声, 宋平顺, 罗兴平, 等. 紫斑牡丹各部位中丹皮酚和芍药苷的含量分析[J]. 西北药学杂志, 2001, 16(3): 108. YANG SS, SONG PS, LUO XP, et al. Analysis of paeonol and paeoniflorin in different parts of Paeonia rockii(S. G. Haw et L. A. Laeuner)T. Hong et J. J. Li[J]. Northwest Pharm J, 2001, 16(3): 108. |
| [6] |
王开发. 我国常见八种花粉的功效探讨[J]. 蜜蜂杂志, 2010, 30(12): 5. WANG KF. Research on efficacy of 8 pollen in China[J]. J Bee, 2010, 30(12): 5. DOI:10.3969/j.issn.1003-9139.2010.12.003 |
| [7] |
李彬彬. 卫生部公布第三批药食两宜名单[J]. 江苏调味副食品, 1999(3): 23. LI BB. China Ministry of Health's third batch name list of medicine and food dual purposes material[J]. Jiangsu Hortic Subsidiary Food, 1999(3): 23. |
| [8] |
成仿云. 紫斑牡丹花粉发育的细胞形态学研究[J]. 园艺学报, 1998, 25(4): 367. CHENG FY. Cytomorphological studies on the pollen development of blotched tree peony(Paeonia rochii)[J]. Acta Hortic Sin, 1998, 25(4): 367. |
| [9] |
曹小勇. 濒危植物紫斑牡丹胚离体培养[J]. 氨基酸与生物资源, 2003, 25(2): 35. CAO XY. In vitro culture of embryo of endangered plant Paeonia rochii[J]. Amino Acid Biotic Res, 2003, 25(2): 35. |
| [10] |
安阿莉, 苏小玲, 毛娟, 等. 紫斑牡丹幼胚离体培养试验[J]. 甘肃农业大学学报, 2009, 44(6): 63. AN AL, SU XL, MAO J, et al. A study on immature embryo culture of Paeonia rochii in vitro[J]. J Gansu Agric Univ, 2009, 44(6): 63. |
| [11] |
于玲, 何丽霞, 李嘉珏. 甘肃紫斑牡丹与中原牡丹类群染色体的比较研究[J]. 园艺学报, 1997, 24(1): 79. YU L, HE LX, LI JJ. Comparative studies on chromosome in varieties of Paeonia rockii and Paeonia suffruticosa[J]. Acta Hortic Sin, 1997, 24(1): 79. |
| [12] |
刘文兰, 唐红, 张亮, 等. 甘肃紫斑牡丹茎扦插繁殖技术初探[J]. 东北林业大学学报, 2012, 40(11): 19. LIU WL, TANG H, ZHANG L, et al. Propagation techniques of stem cuttings of Paeonia suffruticosa var. papaveracea in Gansu[J]. J Northeast Forest Univ, 2012, 40(11): 19. DOI:10.3969/j.issn.1000-5382.2012.11.005 |
| [13] |
杨新, 梅兴国, 汪爱顺, 等. 高效毛细管电泳法测定红豆杉悬浮培养细胞中游离芳香氨基酸[J]. 氨基酸和生物资源, 2002, 24(1): 50. YANG X, MEI XG, WANG AS, et al. Direct determination of free aromatic amino acid in suspension of Taxus chinensis cell by high performance capillary electrophoresis[J]. Amino Acids Biotic Resour, 2002, 24(1): 50. |
| [14] |
石岩, 王钢力, 林瑞超. 近红外技术测定冬虫夏草中氨基酸含量[J]. 药物分析杂志, 2007, 27(1): 90. SHI Y, WANG GL, LIN RC. NIR determination of amino acid from Cordyceps sinensis(Berk.)Sacc.[J]. Chin J Pharm Anal, 2007, 27(1): 90. |
| [15] |
王棘, 潘雪妍, 杨宏伟. HPLC法和氨基酸分析仪(AAA)法测定肠外营养注射液(25) 中18种氨基酸的含量的比较[J]. 药物分析杂志, 2012, 32(6): 1085. WANG J, PAN XY, YANG HW. Comparison of HPLC and amino acid analyzer methods in analyzing 18 different amino acids in total parenteral nutrition injection(25)[J]. Chin J Pharm Anal, 2012, 32(6): 1085. |
| [16] |
赵岩, 侯莹莹, 唐国胜, 等. 柱前衍生RP-HPLC测定淫羊藿中氨基酸含量[J]. 药物分析杂志, 2014, 34(8): 1412. ZHAO Y, HOU YY, TANG GS, et al. Determination of amino acids in Epimedium brevicornu Maxim. by RP-HPLC[J]. Chin J Pharm Anal, 2014, 34(8): 1412. |
| [17] |
潘葳, 宋永康, 黄星. 自动凯氏定氮仪测定灵芝中蛋白质的不确定度评定[J]. 现代科学仪器, 2009(2): 92. PAN W, SONG YK, HUANG X. Evaluation of uncertainty measuring protein content in Ganoderma with Kjeltec 2300 protein analyzer[J]. Mod Sci Instr, 2009(2): 92. |
| [18] |
程显隆, 肖新月, 邹秦文, 等. 柱前衍生化HPLC法同时测定阿胶中4种主要氨基酸的含量[J]. 药物分析杂志, 2008, 28(12): 1997. CHENG XL, XIAO XY, ZOU QW, et al. Pre-column derivatization HPLC simultaneous determination of 4 main amino acids in donkeyhide glue[J]. Chin J Pharm Anal, 2008, 28(12): 1997. |
| [19] |
艾则孜莫合买提, 沙丽娜, 巴哈尔古丽黄尔汗, 等. 柱后衍生阳离子交换色谱法测定桦菌芝中氨基酸的含量[J]. 药物分析杂志, 2012, 32(11): 1972. AZIZ MHMT, SHA LN, BAHARGULI HEh, et al. Determination of amino acids in Pyropolyporus fomentarius by post-column derivatization cation-exchange chromatography[J]. Chin J Pharm Anal, 2012, 32(11): 1972. |
 2017, Vol. 37
2017, Vol. 37 
