2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
天然人促卵泡激素(hFSH)是脑垂体前叶嗜碱性细胞分泌进入血液循环中的一种糖蛋白激素,由α、β 2个亚基通过非共价键连接。α亚基由92个氨基酸组成,含有5对二硫键,2个糖基化位点(Asn 52,Asn 78);β亚基由111个氨基酸组成,含有6对二硫键,2个糖基化位点(Asn 7,Asn 24)[1]。由绝经妇女尿液中提取的FSH在生殖健康领域内具有重要药用价值,它的促排卵作用用于自然生产或人工授精[2]。文献报道,尿源高纯促卵泡激素存在N端不均一现象[3]。α亚基易缺失N端1~3个氨基酸,N端缺失α亚基分子比例约为40%;而β亚基易缺失N端2个氨基酸,N端缺失β亚基分子比例约为50%[4]。推测这种现象的产生是由于蛋白质翻译后修饰所引起。长期的临床实践显示,上述比例的缺失亚基与临床安全性无较大关系[3],一般不会影响药效学活性[5-7]。
rhFSH是采用重组DNA技术,由仓鼠卵巢细胞表达,蛋白序列及糖基化位点与hFSH完全一致的重组糖蛋白,其纯度更高,安全性更好。由于我国人口基数较大,且2016年开放了二胎政策,使得不孕不育的临床治疗需求增加。目前国内外多家企业正在积极进行rhFSH的临床前和临床研究。文献报道上市产品Gonal-F中,N端缺失β亚基的比例约为50%,而N端缺失α亚基的比例与高纯尿源FSH不同,约为1%~2%[3]。目前,EP 8.0及BP 2017收载了rhFSH原液标准,中国药典尚未收载。上述标准检查项目中均未包括N末端不均一性这一重要控制项目。由于rhFSH为复杂的糖蛋白,目前的大量文献集中在对糖链引起的不均一性研究上[7-12],而对rhFSH的2个亚基蛋白肽链的N端不均一性研究较少[13-14],该项目尚无准确便捷的质控方法。
一些早期文献采用蛋白酶酶切β亚基,收集糖肽后进行氨基酸测序,利用HPLC定量测定肽段每一次循环降解得到的乙内酰硫脲(PTH)氨基酸,以此计算完整与缺失肽段的比例[13]。由于rhFSH糖链不均一性的影响,且未考虑氨基酸的收率,该方法较为粗放,准确性较差。RP-HPLC法分辨率高,操作便利,在药品质量控制中使用广泛。本文通过对rhFSH亚基的还原修饰条件、烷基化处理方法、糖苷酶切条件及色谱方法的优化,建立了基于RP-HPLC的新方法,将完整亚基与缺失亚基有效分离,并利用2种高分辨率质谱对这2种亚基进行了定性鉴别。随后,分别选取了参比国内外已上市及处于临床阶段的2个企业的rhFSH原液,利用所建立的方法,对其进行N端不均一性比对研究。结果显示,国内外rhFSH原液具有相似比例的N端不均一性亚基,表明国内外rhFSH原液的N末端不均一性一致。
1 药物与试剂重组人促卵泡激素原液(批号BFEA1503,规格0.5 mg·mL-1,默克雪兰诺医药研发有限公司),1号样品;重组人促卵泡激素原液(批号140902DS,规格0.46 mg·mL-1,康宁杰瑞(吉林)生物科技有限公司),2号样品;重组人促卵泡激素原液(批号C20151103,规格0.7mg·mL-1,长春金赛药业有限责任公司),3号样品。
氢氧化钠(国药集团化学试剂有限公司)、三羟甲基氨基甲烷(Tris,MP Biomedicals)、氯化钠(国药集团化学试剂有限公司)、无水醋酸钠(国药集团化学试剂有限公司)、冰醋酸(国药集团化学试剂有限公司)、三氟乙酸(TFA,Alfa Aeasar公司)、乙腈(Fisher公司)均为色谱纯。三丁基膦(上海梯希爱化成工业发展有限公司)、2-乙烯吡啶(SIGMA公司)、碳酸氢铵(国药集团化学试剂有限公司)、尿素(国药集团化学试剂有限公司)、乙二胺四乙酸二钠(EDTA-2Na,国药集团化学试剂有限公司)、二硫苏糖醇(DTT,北京欣经科生物技术有限公司)、碘乙酸(Sigma-Aldrich公司)均为分析纯。
2 材料PNGase F试剂盒(BioLabs);色谱柱:(1)Supelcosil LC-304保护柱,20 mm×4.6 mm(Sigma公司);(2)SupelcosilLC-318,5 μm,250 mm×4.6 mm(Sigma公司);(3)Supelcosil LC-318保护柱,5 μm,20 mm×4.6 mm(Sigma公司);(4)Symmetry 300TM C4,5 μm,4.6 mm×250 mm(Waters公司);(5)XBridge Peptide BEH C18 Column,5 μm,4.6mm×250mm(Waters公司)。
3 仪器MP230K酸度计(METTLER公司);Neofuge 23R高速冷冻离心机(中国力康生物医疗科技控股有限公司);2401A紫外分光光度计(岛津公司);LC-20A高效液相色谱仪(岛津公司);XEVO G2-S QTOF质谱仪(Waters公司);MALDI-TOF质谱仪(岛津公司)。
4 方法 4.1 溶液配制 4.1.1 溶液A取三丁基膦10μL,加入2 mL丙醇中。
4.1.2 溶液B取2-乙烯吡啶20μL,加入180 μL丙醇中。
4.1.3 溶液C取尿素480 g,溶于600 mL水中,加水稀释至1 L,加混床树脂3~5 g,搅拌1 h。
4.1.4 溶液D取碳酸氢铵15.8 g,EDTA-2Na 8.3 g,溶于800 mL水中,用80 g·L-1氢氧化钠溶液调节pH至7.8并混匀,加水稀释至1 L。
4.1.5 80 g·L-1氢氧化钠溶液取氢氧化钠80 g,溶于1 L水中,溶解混匀。
4.1.6 EDTA-2Na储备液取EDTA-2Na 5 g于100 mL量瓶中,加水溶解并稀释至刻度。
4.1.7 RCM缓冲液(临用新制)取尿素4.8 g,加水5 mL,加37%盐酸8 μL,混合约15 min,使尿素溶解,加Tris 0.44 g,EDTA-2Na储备液240 μL,用37%盐酸调pH至8.6,加水定容至10 mL。
4.1.8 DTT溶液取DTT 1.54 g,加水溶解定容至10 mL。
4.1.9 碘乙酸溶液取碘乙酸186 mg,加1 mol·L-1氢氧化钠溶液1 mL溶解。
4.1.10 PNGase F缓冲液储备液取氯化钠180 g,加无水醋酸钠82 g,加水1 700 mL,溶解,用冰醋酸调pH至7.6,加水定容至2 L。
4.1.11 PNGase F缓冲液取“4.1.10”下的PNGase F缓冲液储备液100 mL,加水900 mL,混匀即得。
4.2 方法1 4.2.1 rhFSH原液中β亚基的分离收集取适量rhFSH原液至超滤离心管中,4 ℃,6 000 r·min-1离心,用紫外可见分光光度计测定其蛋白浓度,并加水制备成2 mg·mL-1的溶液;取此溶液200 μL注入HPLC色谱仪。HPLC条件:采用色谱柱(4),柱温40 ℃,流动相A为0.1% TFA,流动相B为0.1% TFA-95%乙腈,梯度洗脱(0~2 min,0%B;2~8 min,0%B→24%B;8~17 min,24%B;17~36 min,24%B→30%B;36~41 min,30%B→75%B;41~46 min,75%B;46~47 min,75%B→0%B回到初始状态),流速1.0 mL·min-1,检测波长226 nm。在色谱柱的流出端接收α、β亚基的出峰时间段内的样品并冻干。
4.2.2 β基的变性及还原修饰处理取冻干的β亚基,加溶液C 75 μL溶解,37 ℃孵育1 h,加溶液A 25 μL,37 ℃孵育1.5 h,加溶液B 3 μL,37 ℃孵育45 min,加10%TFA 25 μL,终止反应,用流动相A稀释至210 μL,取此溶液200 μL注入HPLC色谱仪。HPLC条件:采用色谱柱(1),柱温25 ℃,流动相A为0.1%TFA的水溶液;流动相B为0.1%TFA-70%乙腈,梯度洗脱(0~7 min,0%B;7~27 min,0%B→100%B;27~28 min,100%B→0%B,回到初始状态),流速1.0 mL·min-1,检测波长226 nm。在色谱柱的流出端接收β亚基的出峰时间段内的样品并冻干。
4.2.3 β亚基糖侧链的切除及验证用43 μL溶液C溶解冻干样品,室温放置30 min,加溶液D 43 μL,混匀,取混合液20 μL加流动相A稀释至50 μL作为对照溶液,向余下的65 μL溶液中加PNGase F 2 μL,混匀,37 ℃孵育过夜,用流动相A稀释至160 μL,作为切除糖链的β亚基溶液。取对照溶液50 μL、切除糖链的β亚基溶液100 μL注入HPLC色谱仪。将对照溶液与切除糖链的β亚基溶液的色谱图进行比对,验证糖侧链切除效果。
4.2.4 RP-HPLC法分析β亚基N端不均一性采用色谱柱(2)、(3),柱温55 ℃,流动相A为0.1%TFA,流动相B为0.1%TFA-70%乙腈,梯度洗脱(0~40 min,40%B→46%B;40~45 min,46%B→60%B;45~50 min,60%B;50~51 min,60%B→40%B,回到初始状态),流速1.0 mL·min-1,检测波长214 nm。进样100 μL,在色谱柱流出端用离心管收集完整与N末端不均一性β亚基的出峰时间段内的样品并冻干,以备质谱鉴别。
4.3 方法2 4.3.1 rhFSH原液的变性、还原修饰取原液适量冻干,向冻干样品中加入RCM缓冲液,稀释为1 mg·mL-1,80 ℃加热5 min变性。取该溶液1 mL,加入DTT溶液10 μL,37 ℃孵育1 h;加入碘乙酸溶液25 μL,室温避光反应30 min,加入DTT溶液50 μL终止反应。
4.3.2 糖侧链的切除及验证用PNGase F缓冲液透析“4.3.1”项溶液过夜,取透析液50 μL作为对照溶液,向余下的100 μL溶液中加入PNGase F10 μL,37 ℃孵育1 h,即得切糖溶液。将对照溶液与切糖溶液进行色谱图比对,验证糖链切除效果。
4.3.3 RP-HPLC法分析亚基N端不均一性采用色谱柱(5),柱温60 ℃,流动相A为0.1%TFA,流动相B为0.1%TFA-乙腈,梯度洗脱(0~30 min,30%B;30~32 min,30%B→34%B;32~75 min,34%B→38%B;75~80 min,38%B→80%B;80~85 min,80%B;85~86 min,80%B→30%B,回到初始状态),流速1.0 mL·min-1,检测波长214 nm,进样量25 μL。在色谱柱流出端用离心管收集完整与N末端不均一性亚基的出峰时间段内的样品并冻干,以备质谱鉴别。
4.4 质谱检测 4.4.1 Q-TOF-MS检测方法1冻干样品用0.1%甲酸10 μL溶解。质谱条件:毛细管电压3 kV,锥孔电压40 kV,源温度120 ℃,偏转电压80 kV,脱溶剂气温度400 ℃,锥孔气流速20.0 L·h-1,脱溶剂气流速800 L·h-1。
4.4.2 MALDI-TOF检测方法2冻干样品用50%乙腈40 μL溶解。质谱条件:线性操作模式,检测分子质量范围m/z 2 000~20 000。
5 结果与讨论rhFSH的α与β亚基均带有侧链糖基,受糖链复杂性的影响,难以直接对完整蛋白进行N端不均一性研究。本实验室前期研究结果显示,需要将rhFSH充分变性并还原烷基化,将蛋白充分展开后才能有效切糖[14]。因此尝试了不同的还原烷基化、变性、亚基分离制备方法,并摸索了不同的切糖与色谱条件,形成了方法1与方法2这2种N端分析方法。此外,方法1和方法2采用了不同的还原烷基化试剂(2-乙烯吡啶/碘乙酸)进行二硫键的还原修饰处理,故2个方法中目的蛋白还原烷基化后的理论分子量有所不同。
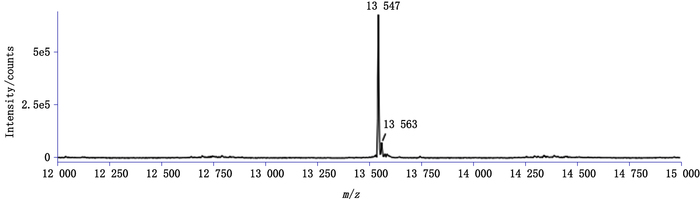
5.1 分析方法1由图 1可知,方法1可将rhFSH完整与缺失β亚基有效分离,分离度约为1.6。采用质谱法测定β亚基的相对分子质量(图 2、图 3、表 1),β1为缺失β亚基,β2为完整β亚基。国内外企业缺失β亚基的含量相似(表 2),约为45%左右,与尿源hFSH基本一致。采用本方法进行首次测定时发现样品1号的N端缺失β亚基含量为28.9%,明显低于尿源hFSH缺失β亚基的比例,与样品2号和样品3号的测定结果也不同。回顾分析发现,该方法需要手动收集2个亚基,冻干后还需进行4步前处理。操作步骤较多,实验周期长,手动收集很可能干扰最后的定量分析。严格固定手动收集峰范围,经重复实验发现,参比样品1号的N末端缺失β亚基的相对含量回归正常,与尿源FSH基本一致。这一现象提示该方法耐用性存在不足。因此,未进行α亚基不均一性研究,转而尝试不需手动收集、前处理步骤较少的方法2。

|
A. 1号样品(sample No. 1)B. 2号样品(sample No. 2)C. 3号样品(sample No. 3) 图 1 N端缺失β亚基图谱(方法1) Figure 1 Chromatogram of N-terminal lossing β subunit (method 1) |
|
图 2 rhFSH缺失β亚基质谱代表图谱(3号样品) Figure 2 Mass spectrogram of rhFSH lossing β subunit (sample No. 3) |

|
图 3 rhFSH完整β亚基质谱代表图谱(3号样品) Figure 3 Mass spectrogram of rhFSH integrated β subunit(sample No. 3) |
|
|
表 1 相对分子质量检测结果(方法1) Table 1 Relative molecular mass results (method 1) |
|
|
表 2 方法1与方法2 N端不均一性测定结果 Table 2 N-terminal heterogeneity results of method 1 and method 2 |
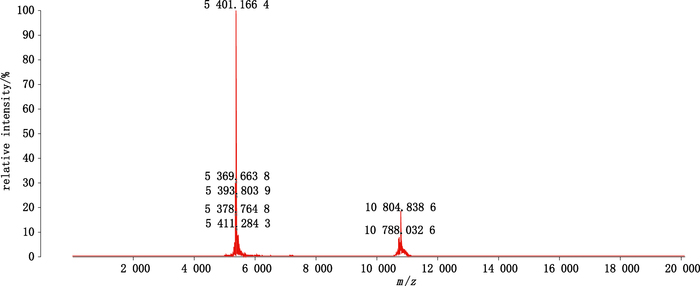
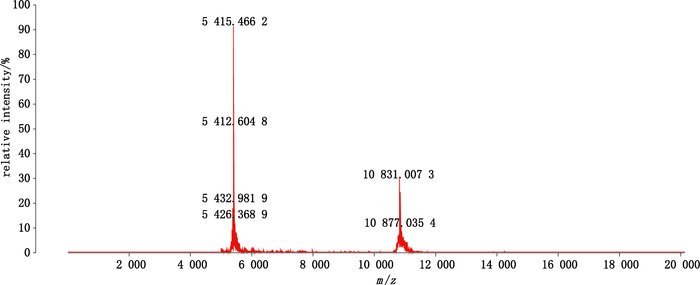
方法2的还原修饰步骤参考文献[15],并进行了优化。操作周期仅需2 d,且不受手动收集的影响。由图 4可知,方法2将α亚基分离出3个色谱峰,以出峰前后顺序命名为α1、α2、α3;采用质谱法对分离收集的α、β亚基进行相对分子质量检测,结果显示(表 3、图 5~7),α2的检测值与完整α亚基相差0.5个质量数,推测α2为完整α亚基;α1比完整α亚基多约16个质量数,推测α1为α亚基的某1个Met发生氧化后形成的氧化亚基;α3的检测值比完整α亚基多约48个质量数,推测α3为α亚基中的3个Met发生氧化后形成的氧化亚基。从实测分子量分析,α1、α3不是N端缺失了氨基酸的α亚基。同时,3个α亚基峰的质谱放大图中均未见缺失α亚基的质量数。这一现象提示,缺失α亚基含量可能较低。从疏水性角度分析,由于Ala与Pro为非极性氨基酸,缺失这2个氨基酸的α亚基极性降低,在反相色谱上应比完整α亚基先洗脱。而图 4中未见缺失α亚基,可能该缺失亚基实际含量确实较低。文献报道产品Gonal-F中,含有痕量的缺失α亚基(1%~2%)[3],3家企业的实测结果与文献报道一致。

|
A. 1号样品(sample No. 1)B. 2号样品(sample No. 2)C. 3号样品(sample No. 3) 图 4 N端缺失β亚基图谱(方法2) Figure 4 Chromatogram of N-terminal lossing β subunit (method 2) |
此外,方法2可分离缺失与完整的β亚基,分离度约为1.2。经质谱鉴别(表 3),β1为缺失β亚基,β2为完整β亚基(图 4)。国内外企业缺失β亚基的含量相似(表 2),约为45%,与尿源FSH基本一致。
|
|
表 3 相对分子质量检测结果(方法2) Table 3 Relative molecular mass results (method 2) |
|
图 5 rhFSH α1质谱代表图谱(3号样品) Figure 5 Mass spectrogram of rhFSH α1(sample No. 3) |

|
图 6 rhFSH完整α亚基(α2)质谱代表图谱(3号样品) Figure 6 Mass spectrogram of rhFSH integratedαsubunit (α2)(sample No. 3) |
|
图 7 rhFSH α3质谱代表图谱(3号样品) Figure 7 Mass spectrogram of rhFSH integrated α3(sample No. 3) |
本研究建立的2种分析方法均可用于分析rhFSH的N末端不均一性及其比例。方法1首先分别手动收集rhFSH原液的α、β亚基,再进行RP-HPLC分析,冻干次数较多,试验周期较长,人为影响较大;方法2直接对rhFSH原液进行处理,可以同时分离α亚基及其氧化产物、缺失与完整的β亚基。与方法1相比,方法2中缺失与完整β亚基之间的分离度虽稍低,但整个方法前处理简单,耐用性及准确性均较高。利用建立的分析方法检查国内外3家企业rhFSH原液的N端不均一性,结果相似。
根据生物类似药研发与技术评价指导原则[16],今后应积累多批次的1号样品与国内企业的rhFSH样品,力图从统计学角度深入评价国内外rhFSH产品N端不均一性的相似性。此外,还应优化蛋白酶切条件与反相色谱条件,尝试采用定量肽图法进行N端不均一性研究。
本文为rhFSH的质量研究补充了新的质控项目与质控方法,可为重组激素类生物类似药的比对研究提供技术积累。
| [1] |
陈宁. 重组人促卵泡激素的质量研究[D]. 长春: 吉林大学, 2007. CHEN N. Quality of the Recombinant Human Follicle Stimulating Hormone[D].Changchun:Jilin University, 2007 |
| [2] |
刘金钏, 彭贵子, 卢智俊, 等. 重组人促卵泡激素研究进展[J]. 中国药科大学学报, 2013, 44(3): 283. LIU JC, PENG GZ, LU ZJ, et al. Advances of recombinant human follicle-stimulating hormone[J]. J China Pharm Univ, 2013, 44(3): 283. DOI:10.11665/j.issn.1000-5048.20130319 |
| [3] |
Human FSH Product Development Group. Recombinant follicle stimulating hormone:development of the first biotechnology product for the treatment of infertility[J]. Hum Reprod Update, 1998, 4(6): 862. DOI:10.1093/humupd/4.6.862 |
| [4] |
RATHNAM P, SAXENA BB. Primary amino acid sequence of follicle-stimulating hormone from human pituitary glands[J]. J Biol Chem, 1975, 250(17): 6735. |
| [5] |
SIEGEL ET, KIM HG, NISHIMOTO HK, et al. The molecular basis of impaired follicle-stimulating hormone action:evidence from human mutations and mouse models[J]. Reprod Sci, 2013, 20(3): 211. DOI:10.1177/1933719112461184 |
| [6] |
CHAPPEL SC. Heterogeneity of follicle stimulating hormone:control and physiological function[J]. Hum Reprod Update, 1995, 1(5): 479. DOI:10.1093/humupd/1.5.479 |
| [7] |
BORROMEO V, AMSTERDAM A, BERRINI A, et al. Characterization of biologically active bovine pituitary FSH purified by immunoaffinity chromatography using a monoclonal antibody[J]. Europe PMC, 2004, 139(2): 179. |
| [8] |
GERVAIS A, HAMMEL YA, PELLOUX S, et al. Glycosylation of human recombinant gonadotrophins:characterization and batch-tobatch consistency[J]. Glycobiology, 2003, 13(3): 179. DOI:10.1093/glycob/cwg020 |
| [9] |
BOUSFIELD GR, BUTNEV VY, RUEDA-SANTOS MA, et al. Macro and micro heterogeneity in pituitary and urinary follicle stimulating hormone glycosylation[J]. J Glycomics Lipidomics, 2014, 4: pii:1000125. |
| [10] |
MEHER BR, DIXIT A, BOUSFIELD GR, et al. Glycosylation effects on FSH-FSHR interaction dynamics:a case study of different FSH glycoforms by molecular dynamics simulations[J]. PLoS One, 2015, 10(9): e0137897. DOI:10.1371/journal.pone.0137897 |
| [11] |
BOUSFIELD GR, BUTNEV VY, WHITE WK, et al. Comparison of follicle-stimulating hormone glycosylation microheterogenity by quantitative negative mode nano-electrospray mass spectrometry of peptide-N glycanase-released oligosaccharides[J]. J Glycomics Lipidomics, 2015, 5(1): 129. |
| [12] |
BUTNEV VY, MAY JV, SHUAI B, et al. Production, purification, and characterization of recombinant hFSH glycoforms for functional studies[J]. Mol Cell Endocrinol, 2015, 405: 42. DOI:10.1016/j.mce.2015.01.026 |
| [13] |
SHOME B, PARLOW AF, LIU WK, et al. A reevaluation of the amino acid sequence of human follitropin β-subunit[J]. J Protein Chem, 1988, 7(4): 325. DOI:10.1007/BF01024882 |
| [14] |
WANG H, CHEN X, ZHANG XX, et al. Comparative assessment of glycosylation of a recombinant human FSH and a highly purified FSH extracted from human urine[J]. J Proteome Res, 2016, 15(3): 923. DOI:10.1021/acs.jproteome.5b00921 |
| [15] |
梁成罡, 沈舒, 杨化新. 重组人促卵泡激素(rhFSH)肽图分析方法研究[J]. 中国生化药物杂志, 2010, 31(5): 333. LIANG CG, SHEN S, YANG HX. Study on the method of the peptide mapping analysis of recombinant human follicle stimulating hormone (rh-FSH)[J]. Chin J Biochem Pharm, 2010, 31(5): 333. |
| [16] |
国家食品药品监督管理总局. 生物类似药研发与评价技术指导原则(试行)[EB/OL]. [2015-03-03]. http://www.sda.gov.cn./WS01/CL0051/115102.html. China Food and Drug Administration.Technical Guidelines on Development and Evaluation of Biosimilar(Trial)[EB/OL].[2015-03-03]. http://www.sda.gov.cn./WS01/CL0051/115102.html. |
 2017, Vol. 37
2017, Vol. 37 
