2. 浙江华海药业股份有限公司, 临海 317024
2. Zhejiang Huahai Pharmaceutical Co., Ltd., Linhai 317024, China
氢氯噻嗪(hydrochlorothiazide)是一种利尿剂,为治疗中等程度水肿的首选药物。可用于各种类型的水肿,对心脏性水肿如充血性心力衰竭引起的水肿很有效。氢氯噻嗪降压作用强度中等,目前仍为降压治疗的基础药物之一,临床上广泛用于各种类型的高血压,常与其他降压药合用增强降压效果。在氢氯噻嗪原料药合成工艺中使用了甲醛,中国药典和人用药物注册技术要求国际协调会(ICH)均未要求对甲醛的残留进行检测。众所周知,甲醛具有毒性和挥发性,对人类身体健康有较大危害,并且甲醛还可能会被氧化成甲酸,因甲醛及甲酸这2种物质对人体均有较大的损伤,故迫切需要对在氢氯噻嗪产品中甲醛和甲酸的残留做严格控制,建立一种稳定、有效的残留量检测方法。
在WHO关于饮用水质量的指南文件[1]中讨论了甲醛的毒性以及明确指出已有证据表明甲醛经口服途径不是致癌物质,在文献中甲醛经口服摄入的日可耐受摄入量(TDI)为0.15 mg·kg-1,以成年人50 kg体重和假设每天最大的摄入来源为10 g,可计算得到甲醛0.075%的限度要求。而甲酸是ICH指南Q3C[2]和各国药典明确规定的3类溶剂,限度为0.5%。本文建立了一种高灵敏度和特异性的同时测定甲醛和甲酸的方法,结果表明该方法适用于氢氯噻嗪中微量甲醛和甲酸的含量控制。
甲醛含量的测定方法比较多,主要有分光光度法和色谱法。分光光度法中最被广泛应用的是乙酰丙酮比色法和酚试剂比色法[3-7],但该法试验操作较烦琐,灵敏度不高,选择性较低,易受酚试剂和其他醛类物质的干扰,造成测定结果有一定的误差。甲醛相对分子质量小,用气相色谱法分析时出峰时间早,且在FID检测器中响应较低,灵敏度不高;用液相色谱法分析,由于甲醛极性大,出峰时间早,且在紫外检测器中无吸收,因此用普通的气相色谱法和液相色谱法均难以直接检测,一般需要先对甲醛进行衍生化。常用的衍生试剂为2,4-二硝基苯肼(2,4-dinitrophenylhydrazine),再用气相色谱法或液相色谱法进行测定,但操作复杂耗时[8-12],在特定化学原料药检测过程中可能存在干扰而造成重复性较差。目前也有文献报道用直接进样毛细管气相色谱法测定氢氯噻嗪中甲醛的残留量,但直接进样易污染色谱柱,灵敏度较低[13]。
本研究是利用甲醛和甲酸在1%对甲基苯磺酸乙醇溶液环境中60 ℃反应,甲醛和甲酸可完全转化成二乙氧基甲烷和甲酸乙酯[14],因该反应在顶空气相色谱检测的顶空瓶保温过程中即可发生,无需额外增加人工衍生步骤,从而简化了操作,提高了精密度和准确度。
1 化学衍生化反应原理甲醛和甲酸在少量对甲基苯磺酸催化条件下,可以分别和乙醇反应,形成二乙氧基甲烷和甲酸乙酯,在此条件下这2个反应基本可以达到定量转化,反应式如图 1所示:
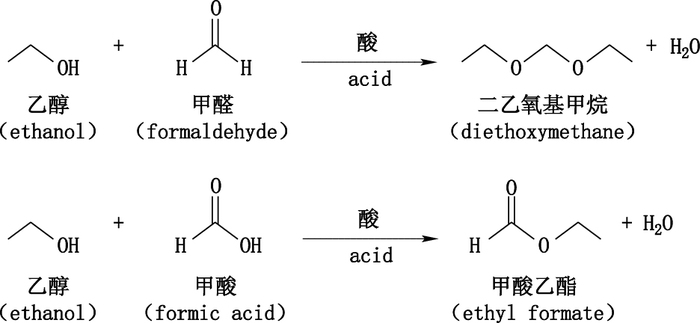
|
图 1 衍生化反应方程式 Figure 1 Reaction equation of derivation |
Agilent 7890A & 7697A自动顶空气相色谱仪配备FID检测器(Agilent公司)。Stabliwax(30 m×0.53 mm×1.0 μm;固定液:聚乙二醇;RESTEK公司)。
乙醇(分析纯,杭州化学试剂有限公司),对甲基苯磺酸(分析纯,临安青山化工厂),二甲亚砜(色谱纯,ROE公司),甲酸(分析纯,上海凌峰化学试剂有限公司),甲醛溶液(37%~40%)(分析纯,杭州化学试剂有限公司),甲酸乙酯(分析纯,偃师市新鑫香料厂),二乙氧基甲烷(分析纯,阿拉丁公司),氢氯噻嗪样品(浙江华海药业制备)。
2.2 溶液的配制稀释液:1%对甲基苯磺酸乙醇溶液-二甲亚砜(4:1)。
空白溶液:稀释液。
储备溶液A:称取甲酸乙酯6.44 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,即得(甲酸乙酯质量浓度:64.4 μg·mL-1)。
储备溶液B:称取二乙氧基甲烷13.88 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,即得(二乙氧基甲烷质量浓度:138.8 μg·mL-1)。
标准溶液:准确移取储备溶液A 10.0 mL和储备溶液B 10.0 mL于100 mL量瓶中,用稀释液稀释至刻度,混匀,即得(甲酸乙酯质量浓度:6.44 μg·mL-1;二乙氧基甲烷质量浓度:13.88 μg·mL-1)。
2.3 实验步骤 2.3.1 色谱条件色谱柱:Stabliwax(30 m×0.53 mm×1.0 μm);载气:氮气;柱流量:5.0 mL·min-1;分流比:1:1;程序升温:40 ℃保持10 min,然后以20 ℃·min-1上升到140 ℃,保持5 min;检测器温度:260 ℃;进样口温度:140 ℃;进样量:1.0 mL;顶空瓶保温温度:60 ℃;顶空瓶保温时间:60 min。
2.3.2 样品溶液配制称取氢氯噻嗪样品0.1 g,精密称定,置20 mL顶空瓶中,加稀释液5.0 mL,加盖密封,振摇混匀,即得质量浓度为0.02 g·mL-1的样品溶液。
2.3.3 样品分析按照色谱条件依次进样空白溶液、标准溶液和样品溶液,记录峰面积。甲醛和甲酸的定性分别以衍生化产物二乙氧基甲烷和甲酸乙酯色谱峰保留时间作为依据。
2.3.4 计算方法甲醛和甲酸含量分别以下列公式来计算:
| $甲醛含量=\frac{{{C}_{\text{s}}}\times {{R}_{\text{t}}}}{{{C}_{\text{t}}}\times {{R}_{\text{s}}}}\times \frac{30.30}{104.15}$ |
式中,Cs为标准溶液中二乙氧基甲烷的质量浓度(μg·mL-1),Ct为样品溶液的质量浓度(g·mL-1),Rs为标准溶液所得到的色谱图中二乙氧基甲烷的峰面积,Rt为样品溶液所得到的色谱图中二乙氧基甲烷的峰面积,30.03为甲醛的摩尔质量(g·mol-1),104.15为二乙氧基甲烷的摩尔质量(g·mol-1)。
| $甲酸含量=\frac{{{C}_{\text{s}}}\times {{R}_{\text{t}}}}{{{C}_{\text{t}}}\times {{R}_{\text{s}}}}\times \frac{46.03}{74.08}$ |
式中,Cs为标准溶液中甲酸乙酯的质量浓度(μg·mL-1),Ct为样品溶液的质量浓度(g·mL-1),Rs为标准溶液所得到的色谱图中甲酸乙酯的峰面积,Rt为样品溶液所得到的色谱图中甲酸乙酯的峰面积,46.03为甲酸的摩尔质量(g·mol-1),74.08为甲酸乙酯的摩尔质量(g·mol-1)。
3 结果讨论 3.1 衍生化时间和温度对结果的影响以稀释液配制14.15 μg·mL-1的二乙氧基甲烷溶液和8.23 μg·mL-1的甲酸乙酯溶液,分别考察了顶空瓶不同保温时间(10、20、30、40、50、60和70 min)和顶空瓶不同保温温度(40、50、60和70 ℃)条件下二乙氧基甲烷和甲酸乙酯的峰面积的影响。由表 1可以得出,从顶空瓶保温时间10 min开始,二乙氧基甲烷和甲酸乙酯的峰面积基本没有明显变化,说明10 min的衍生化时间即可达到反应平衡,且衍生化时间对结果的影响不大。由表 2可以得出,从顶空瓶保温温度40 ℃开始,二乙氧基甲烷和甲酸乙酯的峰面积呈上升趋势,说明衍生化温度越高,气液平衡时所得的二乙氧基甲烷和甲酸乙酯的峰面积越大。但由于稀释液是乙醇,它在常压下的沸点为78 ℃,顶空瓶保温温度太高,溶剂挥发太多,压力增加,可能会导致瓶子破裂等情况。故方法选择顶空瓶保温温度60 ℃,在这个衍生温度下,方法学研究能保证足够的灵敏度和转化率即可。
|
|
表 1 衍生化时间的影响 Table 1 Influence of derivation time |
|
|
表 2 衍生化温度的影响 Table 2 The Influence of derivation temperature |
将空白溶液、标准溶液分别进样分析,从所得色谱图中发现,空白溶液中有约甲酸乙酯最低检测限1/2水平的干扰峰存在,即相当于样品含量为24 μg·g-1的甲酸乙酯干扰,二乙氧基甲烷没有干扰峰存在,甲酸乙酯和二乙氧基甲烷之间的分离度在1.5以上,均不影响样品的检测。色谱图见图 2。
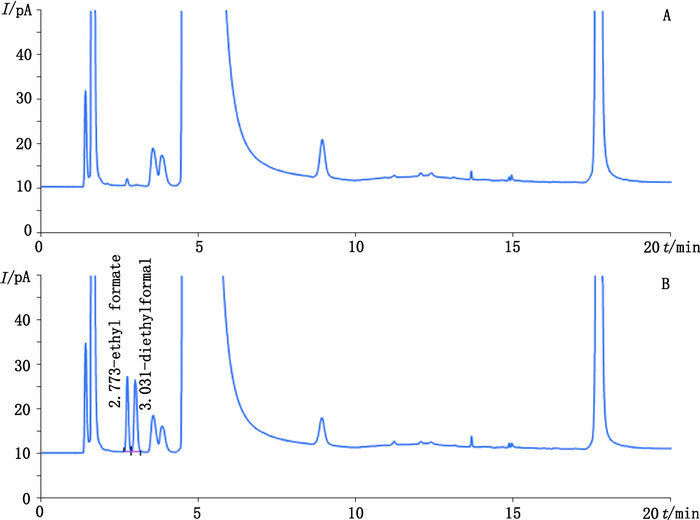
|
图 2 空白溶液(A)与标准溶液(B)GC图谱 Figure 2 GC chromatograms of blank solution(A)and standard solution(B) |
分别称取二乙氧基甲烷14.33 mg和甲酸乙酯6.46 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,采用逐步稀释法来确定方法的检测限和定量限。检测限定义为信噪比约等于3时所检测到的浓度,本方法中的二乙氧基甲烷的检测限为2.1495 μg·mL-1,相当于样品含量为107 μg·g-1,换算成甲醛相当于样品含量为31 μg·g-1;甲酸乙酯的检测限为0.969 μg·mL-1,相当于样品含量为48 μg·g-1,换算成甲酸相当于样品含量为30 μg·g-1。定量限定义为信噪比约等于10时所检测到的浓度,本方法中的二乙氧基甲烷的定量限为6.93 μg·mL-1,相当于样品含量为347 μg·g-1,换算成甲醛相当于样品含量为100 μg·g-1;甲酸乙酯的定量限为3.2 μg·mL-1,相当于样品含量为160 μg·g-1,换算成甲酸相当于样品含量为99 μg·g-1。定量限色谱图见图 3。
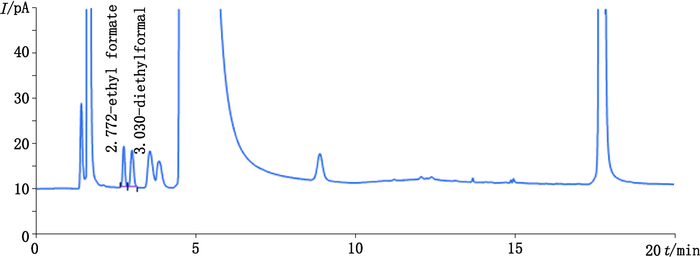
|
图 3 定量限图谱 Figure 3 GC chromatogram of quantification limit |
分别考察了甲醛、甲酸、二乙氧基甲烷和甲酸乙酯的线性范围。
甲醛线性范围:称取甲醛溶液11.45 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,取该溶液逐步稀释成质量浓度为2.12、2.544、3.392、4.24、5.088和6.36 μg·mL-1的一系列甲醛溶液,考察方法的线性。结果表明在2.12~6.36 μg·mL-1范围内线性关系良好,标准方程:
Y=8.259X-3.836 r²=0.996 4
甲酸线性范围:称取甲酸4.06 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,取该溶液逐步稀释成质量浓度为2.03、2.436、3.248、4.06、4.872和6.09 μg·mL-1的一系列甲酸溶液,考察方法的线性。结果表明在2.03~6.09 μg·mL-1范围内线性关系良好,标准方程:
Y=12.348X+4.817 2 r² = 0.998 2
二乙氧基甲烷线性范围:称取二乙氧基甲烷14.33 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,取该溶液逐步稀释成质量浓度为7.165、8.598、11.464、14.33、17.196和21.495 μg·mL-1的一系列二乙氧基甲烷溶液来考察方法的线性。结果表明在7.165~21.495 μg·mL-1范围内线性关系良好,标准方程:
Y=8.750X-9.215 r²=0.982 8
甲酸乙酯线性范围:称取甲酸乙酯6.46 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,取该溶液逐步稀释成浓度为3.23、3.876、5.168、6.46、7.752和9.69 μg·mL-1的一系列甲酸乙酯溶液来考察方法的线性。结果表明在3.23~9.69 μg·mL-1范围内线性关系良好,标准方程:
Y=12.15X+5.542 r²=0.993 8
转化率考察:用线性浓度通过在2种不同的体系中目标物的单位浓度峰面积来考察甲醛和二乙氧基甲烷、甲酸和甲酸乙酯之间的转化率。见表 3和表 4。
|
|
表 3 甲醛与二乙氧基甲烷之间的转化率计算结果 Table 3 Percent conversion from formaldehyde to diethylformal |
|
|
表 4 甲酸与甲酸乙酯之间的转化率计算结果 Table 4 Percent conversion from formic acid to ethyl formate |
| $甲醛与二乙氧基甲烷之间转化率=\frac{{{C}_{\text{s}}}\times {{R}_{\text{t}}}}{{{C}_{\text{t}}}\times {{R}_{\text{s}}}}\times 100%$ |
式中,Cs为二乙氧基甲烷体系中二乙氧基甲烷的浓度(μg·mL-1),Ct为甲醛体系中由甲醛换算成二乙氧基甲烷的理论浓度(g·mL-1),即Ct为甲醛浓度×104.15/30.03(104.15为二乙氧基甲烷的摩尔质量(g·mol-1),30.03为甲醛的摩尔质量(g·mol-1)),Rs为二乙氧基甲烷体系中所得到的色谱图中二乙氧基甲烷的峰面积,Rt为甲醛体系中所得到的色谱图中二乙氧基甲烷的峰面积。
| $甲酸与甲酸乙脂之间转化率=\frac{{{C}_{\text{s}}}\times {{R}_{\text{t}}}}{{{C}_{\text{t}}}\times {{R}_{\text{s}}}}\times 100%$ |
式中,Cs为甲酸乙酯体系中甲酸乙酯的浓度(μg·mL-1),Ct为甲酸体系中由甲酸换算成甲酸乙酯的理论浓度(g·mL-1),即Ct为甲醛浓度×74.08/46.03(74.08为甲酸乙酯的摩尔质量(g·mol-1),46.03为甲酸的摩尔质量(g·mol-1)),Rs为甲酸乙酯体系中所得到的色谱图中甲酸乙酯的峰面积,Rt为甲酸体系中所得到的色谱图中甲酸乙酯的峰面积。
3.2.4 方法的回收率及精密度分别称取二乙氧基甲烷13.88 mg和甲酸乙酯6.44 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,准确移取该溶液10.0 mL至100 mL量瓶中,用稀释液稀释至刻度,混匀,即得储备溶液;称取氢氯噻嗪样品0.1 g,精密称定,置于20 mL顶空瓶中,加储备溶液5.0 mL,加盖密封,振摇混匀。平行制备6份测试溶液,溶液中含氢氯噻嗪质量浓度为0.02 g·mL-1,二乙氧基甲烷质量浓度为13.88 μg·mL-1,甲酸乙酯质量浓度为6.44 μg·mL-1,测定二乙氧基甲烷和甲酸乙酯回收率并计算RSD。由表 5可以得出,二乙氧基甲烷和甲酸乙酯的日内和日间回收率的RSD均小于5%,表明方法均有较好的精密度。
|
|
表 5 方法的日内、日间回收率和精密度 Table 5 Precision and recovery for intra-day and inter-day |
分别称取二乙氧基甲烷13.88 mg和甲酸乙酯6.44 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,分别准确移取该溶液5.0、8.0、10.0、12.0 mL至100 mL量瓶中,用稀释液稀释至刻度,混匀,即得各储备溶液;称取氢氯噻嗪样品0.1 g,精密称定,置于20 mL顶空瓶中,加各储备溶液5.0 mL,加盖密封,振摇混匀。使用这4个浓度(二乙氧基甲烷:6.94、11.104、13.88、16.656 μg·mL-1;甲酸乙酯:3.22、5.152、6.44、7.728 μg·mL-1)的溶液来考察方法回收率。回收率的计算以添加氢氯噻嗪(终浓度为0.02 g·mL-1)测得的待测物峰面积与未添加氢氯噻嗪时的峰面积的比值表示。由表 6中可以得出,二乙氧基甲烷和甲酸乙酯的回收率在90%~110%之间。
|
|
表 6 方法的准确度 Table 6 Accuracy of the method |
分别称取二乙氧基甲烷13.88 mg和甲酸乙酯6.44 mg,精密称定于100 mL量瓶中,用稀释液稀释至刻度,混匀,准确移取该溶液10.0 mL至100 mL量瓶中,用稀释液稀释至刻度,混匀。分别在0 h和6 h使用该溶液进样测定。结果表明样品在室温环境下放置6 h内没有发生明显变化。
3.3 样品测定使用建立的顶空气相色谱方法对连续生产的不同批次的氢氯噻嗪进行检测,均未检出甲酸,甲醛含量在0.007%左右,在最低定量限水平以下。色谱图见图 4。
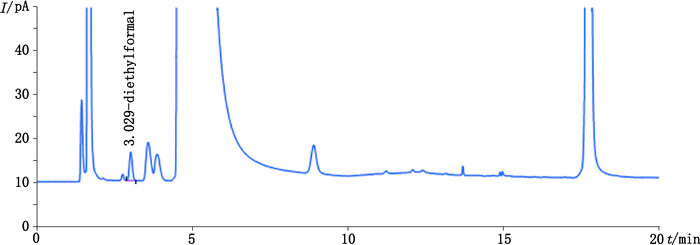
|
图 4 样品溶液图谱 Figure 4 GC chromatogram of sample solution |
本文建立了一种衍生顶空气相色谱分析氢氯噻嗪中微量甲醛和甲酸的检测方法。使用建立的方法对氢氯噻嗪样品进行检测,结果表明该方法具有样品处理简单,灵敏度高,特异性好等优点,非常适用于氢氯噻嗪等原料药中微量甲醛和甲酸的准确快速检测。
| [1] |
World Health Organization(WHO). Formaldehyde in DrinkingWater:Background Document for Development of WHO Guidelines for Drinking-Water Quality(GDWQ)[EB/OL]. 2005[2016-05-26]. http://www.who.int/water_sanitation_health/water-quality/guidelines/chemicals/formaldehyde/en/
|
| [2] |
The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(ICH). Impurities:Guideline for Residual Solvents Q3C[EB/OL].(2011-02-04)[2016-05-26]. http://www.ich.org/products/guidelines/quality/article/qualityguidelines.html
|
| [3] |
刘文君, 赵红, 白亮, 等. 分光光度法测定室内空气中甲醛的方法研究[J]. 中国环境监测, 2003, 19(4): 32. LIU WJ, ZHAO H, BAI L, et al. Study on the determination of the indoor air formaldehyde by spectrometer-photometry method[J]. Environ Monit China, 2003, 19(4): 32. |
| [4] |
吕玉琼, 林凯, 侯穗波. 香菇中甲醛含量的监测报告[J]. 中国卫生检验杂志, 2002, 12(6): 701. LÜ YQ, LIN K, HOU SB. Monitoring report of formaldehyde content in the mushroom[J]. Chin J Health Lab Technol, 2002, 12(6): 701. |
| [5] |
宋建华, 殷晓梅, 刘红霞, 等. 酚试剂分光光度法测定空气中甲醛[J]. 理化检验-化学分册, 2008, 44(3): 278. SONG JH, YIN XM, LIU HX, et al. Phenol reagent spectrophotometry determination of formaldehyde in the air[J]. Phys Test Chem Anal Part B:Chem Anal, 2008, 44(3): 278. |
| [6] |
王军鹏, 陈素玲, 曹丽玲, 等. 酚试剂比色法测定水发产品中甲醛含量方法研究[J]. 中国煤炭工业医学杂志, 2007, 10(10): 1233. WANG JP, CHEN SL, CAO LL, et al. Study on determination of formaldehyde in waterishlogged food products by phenol reagent colorimetric method[J]. Chin J Coal Ind Med, 2007, 10(10): 1233. DOI:10.3969/j.issn.1007-9564.2007.10.094 |
| [7] |
王芳, 杨文英. 新酚试剂比色法测定工作场所空气中的甲醛[J]. 中国卫生检验杂志, 2006, 16(7): 810. WANG F, YANG WY. New phenol reagent colorimetric method for determination of formaldehyde in workplace air[J]. Chin J Health Lab Technol, 2006, 16(7): 810. |
| [8] |
顾娟红, 朱振华, 陈军, 等. 衍生气相色谱法测定纺织品中的游离甲醛[J]. 能源环境保护, 2011, 25(1): 29. GU JH, ZHU ZH, CHEN J, et al. Determination of free formaldehyde in textiles by derivative gas chromatography[J]. Energy Environ Prot, 2011, 25(1): 29. |
| [9] |
范衍琼, 周韬, 李玉萍, 等. 直接进样毛细管气相色谱测定空气中甲醛的研究[J]. 现代预防医学, 2005, 32(7): 779. FAN YQ, ZHOU T, LI YP, et al. Study on the method for determination of formaldehyde in the air by direct injection capillary gas chromatography[J]. Mod Prev Med, 2005, 32(7): 779. |
| [10] |
陈笑梅, 施旭霞, 朱卫建, 等. 高效液相色谱直接测定甲醛衍生物反应条件的研究[J]. 分析化学, 2004, 32(11): 1489. CHEN XM, SHI XX, ZHU WJ, et al. A study of the reaction condition for direct determination of formaldehyde derivative by HPLC[J]. Chin J Anal Chem, 2004, 32(11): 1489. DOI:10.3321/j.issn:0253-3820.2004.11.017 |
| [11] |
徐炜, 魏春青. 食品中游离甲醛的高效液相色谱测定方法的研究[J]. 中国食品卫生杂志, 2006, 18(3): 230. XU W, WEI CQ. Determination of free formaldehyde in foods by HPLC[J]. Chin J Food Hyg, 2006, 18(3): 230. |
| [12] |
李军, 朱凤妹, 彭涛, 等. 啤酒中甲醛的液相荧光色谱检测方法研究[J]. 中国食品学报, 2007, 7(5): 128. LI J, ZHU FM, PENG T, et al. Study on the determination of formaldehyde in beer by LC-FLU[J]. J Chin Inst Food Sci Technol, 2007, 7(5): 128. |
| [13] |
可钰, 张建业, 阎学斌, 等. 用毛细管气相色谱法测定氢氯噻嗪中甲醛的残留量[J]. 光谱实验室, 2005, 22(5): 1111. KE Y, ZHANG JY, YAN XB, et al. Determination of residual amount of formaldehyde in hydrochlorothiazide by capillary GC[J]. Chin J Spectrosc Lab, 2005, 22(5): 1111. |
| [14] |
FARRELL TP, FERRIZZI D. Determination of trace formic acid and formaldehyde in film coatings comprising polyvinyl alcohol(PVA)[J]. AAPS J, 2008, 10(S2): 773. |
 2017, Vol. 37
2017, Vol. 37 
