2. 四川省食品药品检验检测院, 成都 610079
2. Sichuan Provincial Institute for Food and Drug Control, Chengdu 610079, China
朱砂为硫化物类矿石辰砂组辰砂,主含硫化汞(HgS)。收载于中国药典2015年版一部,具有镇惊安神、清热解毒的功效,可用于心悸易惊、失眠多梦、癫痫发狂、小儿惊风、口疮、喉痹、疮疡肿毒[1]。文献[2-5]中对朱砂的研究多集中在HgS的含量测定、毒性和朱砂炮制工艺,但本课题(该课题是国家“十二五”科技重大专项课题“中药安全监测技术及标准平台”中子课题“中药质量安全监测和风险控制技术平台”)组前期市场调研发现,朱砂价格不等,且颜色差异较大,单凭常规鉴别已很难区分是否添加了化学染料。有文献报道[6]市场上存在以808猩红和碳酸钙粉制成的朱砂药材,808猩红为常见的偶氮类化工染色剂,常用于油漆、皮革、油墨等的着色剂,其在体内经过生物转化分解,形成相应的苯胺类及萘酚类物质;胺类可直接作用于肝细胞,引起中毒性肝病,甚至诱导肝细胞基因变异,增加了人体癌变的几率,萘酚类具有致癌、致畸、致敏、致突变的潜在毒性,国际癌症研究机构(IARC)将苯胺和苏丹红归为第3类可致癌物质[7-9]。因此本实验对从市场上购买的11批疑似添加色素的朱砂样品进行了HPLC-Q-TOF/MS分析,以及对照品对照分析,确定了这些朱砂样品中确实添加了金光红C、808猩红、苏丹红Ⅳ 3种偶氮类色素;同时本课题组还建立了以上3种色素的TLC、HPLC检测方法,为朱砂药材的质量控制提供科学依据。
1 材料 1.1 仪器硅胶G板(10 cm×20 cm;青岛海洋化工分厂),可剪裁硅胶G板(10 cm×20 cm;天津思利达科技有限公司),Agilent 1200高效液相色谱仪(Agilent公司),Agilent 6540 QTOF飞行时间质谱仪(Agilent公司),Agilent Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm;填料:十八烷基硅烷键合硅胶;Agilent公司),Welch Ultimate®XB-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;月旭材料科技上海有限公司)。MS1602S电子天平(METTLER TOLEDO公司),CPA225D电子天平(Sartorius公司),HS-20500D超声清洗仪(500 W,40 kHz,上海重逢科学仪器有限公司),Millipore Milli-QA超纯水器(Millipore公司),Sigma 3-30k离心机(Sigma公司)。
1.2 试药11批市售朱砂药材;朱砂阴性样品:四川省食品药品检验检测院标本室留样;金光红C对照品(北京振翔科技有限公司,批号130910,纯度99.8%),808猩红对照品(中国食品药品检定研究院,供检查用,使用前无需处理,批号111940-201201),苏丹红Ⅳ对照品(Labor Dr.Ehrenstorfer-Schafers Bgm-Schlosser-Str.6A 86199Augsburg Germany,批号40121,纯度94.0%)。乙腈为色谱纯,水为自制超纯水,其他试剂均为分析纯。
2 方法与结果 2.1 添加色素的确认 2.1.1 液质联用色谱条件色谱条件:采用Agilent Poroshell 120 EC-C18色谱柱(3.0 mm×100 mm,2.7 μm),柱温35 ℃,流动相为乙腈(A)-0.02 mol·L-1乙酸铵溶液(B),梯度洗脱(0~27 min,95%A→5%A;27~35 min,5%A),流速0.4 mL·min-1。二极管阵列检测器检测。
质谱条件:扫描模式为ESI+,质谱扫描范围m/z 100~1 500,干燥器温度325 ℃,干燥气体流速8 L·min-1,雾化器压力380 kPa,鞘气体温度350 ℃,鞘气流速11 L·min-1,毛细管电压4 kV,碰撞电压135 V。
2.1.2 溶液的制备 2.1.2.1 供试品溶液取朱砂药材0.5 g,加N,N-二甲基甲酰胺20 mL,超声(500 W,40 kHz)处理20 min,取续滤液作为供试品溶液。进样前过0.22 μm的微孔滤膜。
2.1.2.2 对照品储备液取金光红C、808猩红、苏丹红Ⅳ的对照品适量,加N,N-二甲基甲酰胺分别制成每1 mL含0.5 mg的溶液,即得。进样前过0.22 μm的微孔滤膜。
2.1.2.3 阴性样品溶液取朱砂阴性样品0.5 g,加N,N-二甲基甲酰胺20 mL,超声(500 W,40 kHz)处理20 min,取续滤液,作为阴性样品溶液。进样前过0.22 μm的微孔滤膜。
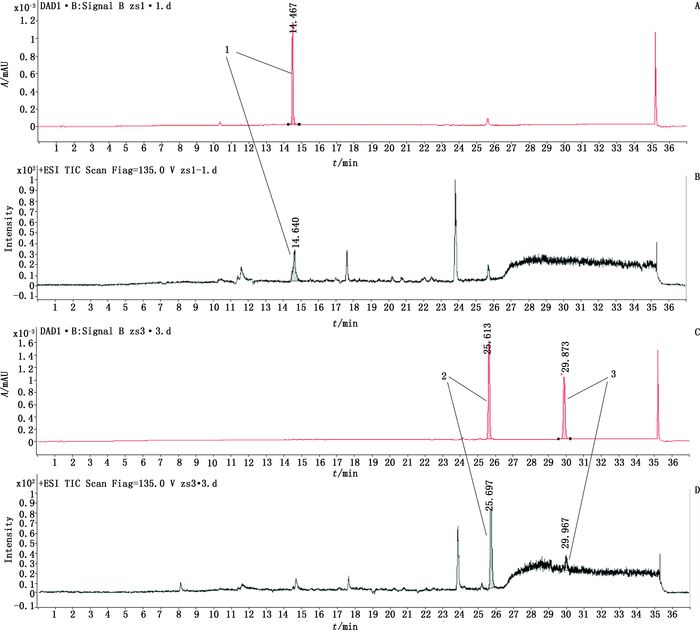
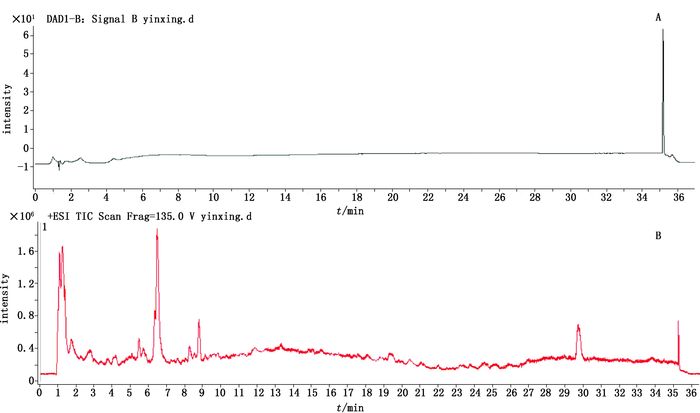
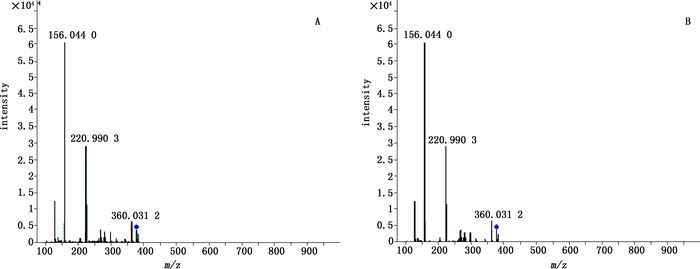
2.1.3 样品的HPLC-Q-TOF/MS分析取“2.1.2.1”项下的供试品溶液,按照“2.1.1”项下条件进行HPLC-Q-TOF/MS分析,得到各朱砂供试品的总离子流色谱图(TIC)和液相色谱图(HPLC),部分样品的图谱见图 1;与朱砂阴性样品色谱图(图 2)相比;朱砂样品的TIC及HPLC谱图中出现了保留时间分别为14.461、25.613、29.873 min的色谱峰,按照顺序依次标为1、2、3。在TIC中,谱峰1给出m/z 377.036 0的[M+H]+准分子离子峰,谱峰2给出m/z 368.139 0的[M+H]+准分子离子峰,谱峰3给出m/z 381.171 0的[M+H]+准分子离子峰。对m/z 377.036 0[M+H]+进行MS裂解分析,质谱给出m/z 220.990 3、156.044 0、360.031 2的碎片离子,对m/z 368.139 0[M+H]+进行MS裂解分析,质谱给出m/z 275.080 8、219.090 1的碎片离子,对m/z 381.171 0[M+H]+进行MS裂解分析,质谱给出m/z 224.117 4、156.043 3、276.116 9的碎片离子,相应的谱图见图 3~8。通过与现有色素数据库、谱库查询及查阅文献[10-14],初步推断谱峰1为金光红C,谱峰2为808猩红,谱峰3苏丹红Ⅳ。
|
1.金光红C(lake red C)2. 808猩红(808 scarlet)3.苏丹红Ⅳ(sudan Ⅳ) 图 1 朱砂样品1液相色谱图(A)及LC-MS总离子流色谱图(B)和朱砂样品3液相色谱图(C)及LC-MS总离子流色谱图 Figure 1 HPLC chromatogram(A)and LC-MS total ion chromatogram(B)of cinnabar sample 1, HPLC chromatogram(C)and LC-MS total ion chromatogram(D)of cinnabar sample |
|
图 2 朱砂阴性样品液相色谱图(A)和LC-MS总离子流色谱图(B) Figure 2 HPLC chromatogram(A)and LC-MS total ion chromatogram(B)of negative cinnabar sample |
|
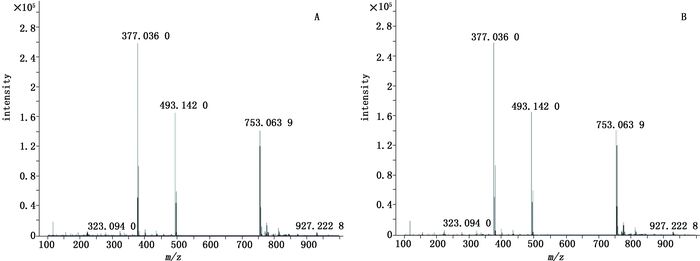
A.对照品(standard)B.样品1(sample1) 图 3 金光红C的一级质谱图 Figure 3 The primary mass spectrogram of lake red C |
|
A.对照品(standard)B.样品1(sample1) 图 4 金光红C的二级质谱图 Figure 4 The secondary mass spectrogram of lake red C |
|
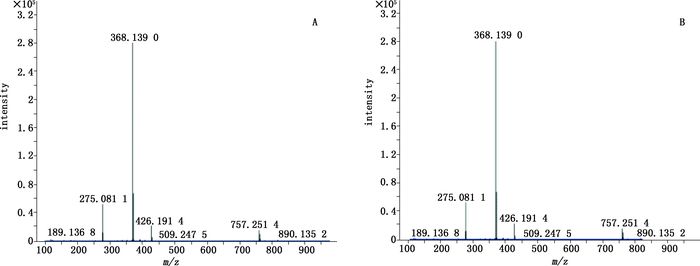
A.对照品(standard)B.样品1(sample1) 图 5 808猩红的一级质谱图 Figure 5 The primary mass spectrogram of 808 scarlet |
|
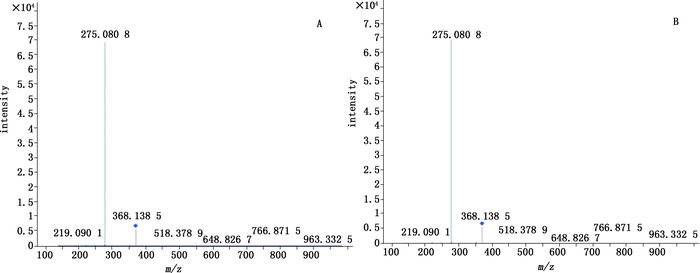
A.对照品(standard)B.样品1(sample1) 图 6 808猩红的二级质谱图 Figure 6 The secondary mass spectrogram of 808 scarlet |
|
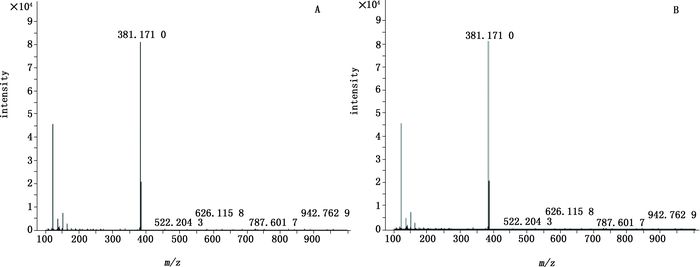
A.对照品(standard)B.样品3(sample3) 图 7 苏丹红Ⅳ的一级质谱图 Figure 7 The primary mass spectrogram of sudan Ⅳ |
|
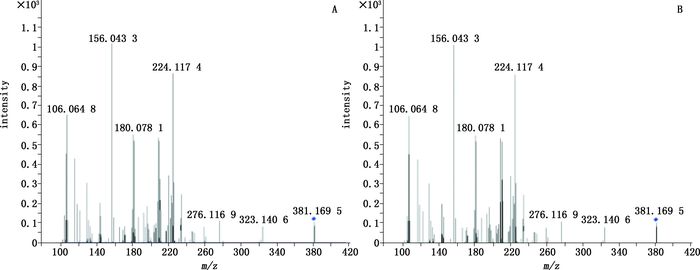
A.对照品(standard)B.样品3(sample3) 图 8 苏丹红Ⅳ的二级质谱图 Figure 8 The secondary mass spectrogram of sudan Ⅳ |
取“2.1.2.2”项下的对照品储备液,加N,N-二甲基甲酰胺稀释至0.05 mg·mL-1。按照“2.1.1”项下条件进行HPLC-Q-TOF/MS分析,得到各对照品MS裂解图,结果金光红C的一级、二级质谱均与谱峰1一致,808猩红的一级、二级质谱均与谱峰2一致,苏丹红Ⅳ的一级、二级质谱图均与谱峰3一致,最终确定朱砂中非法添加的色素为808猩红,苏丹红Ⅳ和金光红C,相应的图谱见图 3~8。值得注意的是,金光红C固体时[M-H]+二聚体与Ba2+结合成盐,结构式见图 9,其在溶液中ESI+模式[(2M-Ba)/2+H]+ m/z377.036 0离子峰响应较高,同时可得到二聚体[2M-Ba+H]+ m/z为753.063 9(见图 3)的离子峰。
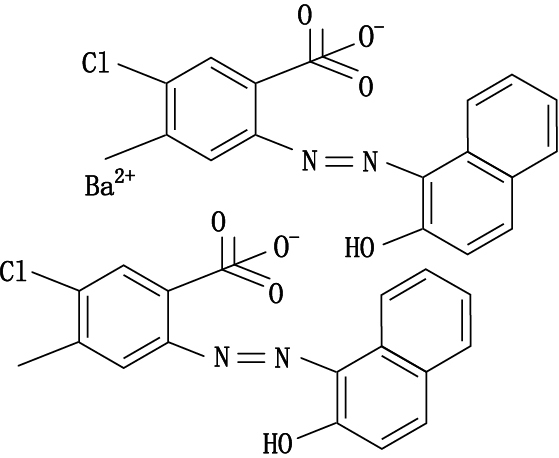
|
图 9 金光红C的结构式 Figure 9 The structural formula of Lake red C |
薄层板:硅胶G板;展开剂:环己烷-乙酸乙酯-无水乙醇-冰乙酸(7:1:2:0.5);点样:供试品溶液与对照品溶液分别点样10 μL;展开方式:上行展开,展距8~10 cm;日光下检视;色谱识别:样品色谱中,在与对照品色谱相应的位置上,能否显相同颜色的斑点。
2.2.2 溶液的制备同“2.1.2”项方法制备供试品溶液、对照品储备液及阴性样品溶液。
2.2.3 检测限考察取各对照品储备液适量,分别加N,N-二甲基甲酰胺稀释,制备金光红C对照品溶液(5.36 μg·mL-1)、808猩红对照品溶液(5.600 μg·mL-1)和苏丹红Ⅳ对照品溶液(3.038 μg·mL-1);分别精密吸取上述3种对照品溶液各1~10 μL,分别点于同一硅胶G薄层板上,在上述色谱条件下,展开10 cm,日光下检视。结果当点样量为3 μL时金光红的斑点可见,当点样量为4 μL时808猩红、苏丹红Ⅳ的斑点可见。因此金光红的薄层检测限确定为16.08 ng,808猩红薄层检测限确定为22.40 ng,苏丹红Ⅳ薄层检测限确定为12.15 ng。
2.2.4 专属性考察取金光红C对照品储备液、808猩红对照品储备液、苏丹红Ⅳ对照品储备液、供试品溶液及阴性样品溶液各10 μL,分别点于同一硅胶G薄层板上,按上述色谱条件展开10 cm,日光下检视,如图 10所示。供试品溶液在与金光红C、808猩红、苏丹红Ⅳ的对照品溶液相应的位置上,有相同颜色的色谱斑点,而阴性样品溶液在与各对照品溶液相应的位置上,均无相同颜色的色谱斑点,说明朱砂阴性样品对金光红C、808猩红及苏丹红Ⅳ的检出无干扰。

|
1.样品1(sample 1)2.样品2(sample 2)3.样品3(sample 3)4. 808猩红(808 scarlet)5.金光红C(lake red C)6.苏丹红Ⅳ(sudan Ⅳ)7.样品4(sample 4)8.阴性样品(negative sample)9.样品5(sample 5)10.样品6(sample 6)11.样品7(sample 7) 图 10 对照色素及朱砂样品TLC图 Figure 10 TLC chromatograms of reference substances and cinnabar samples |
分别使用不同来源(青岛海洋化工分厂,规格10 cm×20 cm;天津思利达科技有限公司,规格10 cm×20 cm;自制板,硅胶G购自于青岛邦凯高新科技材料有限公司,规格10 cm×20 cm)的硅胶G薄层板,改变点样方式(手动点样和自动点样),改变温度(10、20、30 ℃),按“2.2.1”项条件进行薄层层析,日光下检视。结果3种不同来源的硅胶G薄层板、不同的点样方式及温度的改变对金光红C、808猩红、苏丹红Ⅳ 3种色素色谱斑点分离度无影响,且各色谱斑点均无拖尾现象,表明不同来源的硅胶G薄层板、点样方式、温度对808猩红、金光红C、苏丹红Ⅳ的检出结果无影响。
2.2.6 样品的鉴别取11批朱砂样品粉末,照“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下条件进行薄层层析,记录色谱图。结果见表 1,部分供试品及对照试剂的薄层色谱图见图 10。
|
|
表 1 样品的检测结果 Table 1 Determination results of samples |
采用Welch Ultimate®XB-C18(4.6 mm×250 mm,5 μm)色谱柱,柱温35 ℃,以乙腈(A)-0.05 mol·L-1醋酸铵溶液(B)为流动相,按表 2进行梯度洗脱,流速1 mL·min-1,采用Agilent 1200 DAD检测器,检测波长520 nm,进样体积10 μL。在上述色谱条件下,各成分均达到基线分离,各成分的理论塔板数均大于2 000。
|
|
表 2 梯度洗脱程序 Table 2 The gradient elution program |
精密称取金光红C对照品、808猩红对照品、苏丹红Ⅳ的对照品,加N,N-二甲基甲酰胺制成每1 mL含5 μg的混合对照品溶液;称取朱砂药材约0.5 g,精密称定,置锥形瓶中,精密加入N,N-二甲基甲酰胺20 mL,称量,超声(500 W,40 kHz)处理20 min,放冷,再称量,用N,N-二甲基甲酰胺补足减失的量,摇匀,滤过,取续滤液,即得供试品溶液。另取朱砂阴性样品,同法制备阴性样品溶液。
2.3.3 专属性考察精密吸取混合对照品溶液,供试品溶液及阴性样品溶液各10 μL,在上述色谱条件下,分别注入色谱仪,得相应的色谱图,见图 11。供试品在与808猩红,金光红C及苏丹红Ⅳ对照品相应的位置上,有相同保留时间的色谱峰,而阴性样品在与808猩红,金光红C及苏丹红Ⅳ对照品相应位置上无色谱峰,说明阴性样品对808猩红,金光红C及苏丹红Ⅳ的检出无干扰。
2.3.4 检测限考察对“2.3.2”项下混合对照品逐级稀释,按“2.3.1”项下色谱条件进行测定,得出808猩红、苏丹红Ⅳ及金光红C的检测限(S/N=3:1)分别为0.047、0.039和0.035 mg·kg-1。
2.3.5 耐用性考察分别考察WelchUltimate®XB-C18(4.6 mm×250 mm,5 μm;填料:十大烷基硅烷键合硅胶;月旭材料科技上海有限公司),DIKMA PLATISILTMODS(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;北京迪科马科技有限公司),Agilent Eclipse plus C18(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;Agilent公司)3种色谱柱,色谱柱温度(30±5)℃,检测波长(520±10)nm,流动相流速(1.0±0.2)mL·min-1及流动相配比变化5 %,测定同一供试品溶液,结果3种类型色谱柱及色谱柱温度、检测波长、流动相比例、流动相流速、流动相配比有小的变动时,对于金光红C、808猩红以及苏丹红Ⅳ的检测结果无显著影响。
2.3.6 样品的测定取朱砂样品11批次,按“2.3.2”项下方法制成供试品溶液;精密吸取混合对照品溶液及供试品溶液各10 μL,按“2.3.1”项下色谱条件进行检测,检测结果见表 1,部分供试品色谱图见图 11。
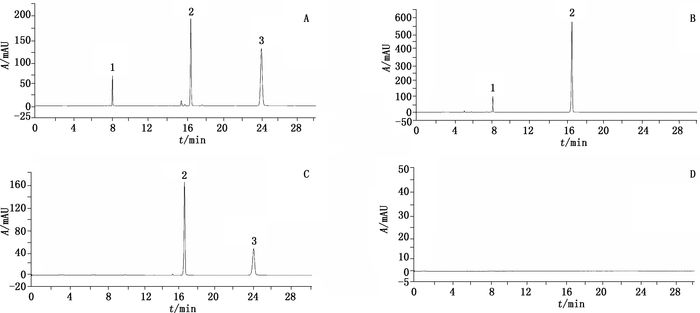
|
1.金光红C(lake red C)2. 808猩红(808 scarlet)3.苏丹红Ⅳ(sudan Ⅳ) A.对照品(standard)B.样品1(sample 1)C.样品3(sample 3)D.阴性样品(negative sample) 图 11 对照品、阴性样品及样品HPLC图谱; Figure 11 HPLC chromatograms of reference substances, negative sample and cinnabar sample |
通过查阅文献[12]发现金光红C性质稳定,溶解性差,本实验选择了甲醇、无水乙醇、乙腈、甲醇-乙腈(1:1)、二甲亚砜、四氢呋喃、N,N-二甲基甲酰胺7种溶剂,对金光红C、808猩红、苏丹红Ⅳ的提取溶剂进行了考察;结果表明,甲醇、无水乙醇、乙腈、甲醇-乙腈(1:1)、二甲亚砜、四氢呋喃对金光红C的提取率均较低,而N,N-二甲基甲酰胺对金光红的提取率较高,同时发现N,N-二甲基甲酰胺对808猩红、苏丹红Ⅳ的提取率均高于其他6种提取溶剂;最终选择N,N-二甲基甲酰胺为金光红C、808猩红、苏丹红Ⅳ的提取溶剂。
3.2 检测波长的选择分别对金光红C、808猩红及苏丹红Ⅳ的对照品溶液进行紫外波长扫描,发现808猩红在484 nm处具有最大吸收,而金光红C和苏丹红Ⅳ在520 nm处具有最大吸收,参照国家食品药品监督管理总局已颁布血竭补充检验方法中苏丹红Ⅳ和808猩红检测波长,综合考虑,最终选取520 nm为检测波长。
3.3 朱砂样品检测本实验利用HPLC-MS联用的方法在收集的疑似添加色素的朱砂样品中检测出添加的色素金光红C,并对本课题组前期分别购买于成都荷花池、安徽亳州、广西玉林、桂林市场、河北安国专业药材市场购买的疑似添加色素的7批朱砂样品和购于不同生产企业的4批朱砂药材及饮片样品进行了添加色素的筛查,结果11批均检出有808猩红,7批均检出金光红C,3批检出苏丹红Ⅳ。由于本课题收集样品较少,不能充分说明市场上朱砂、辰砂样品染色问题,因此在后续实验中有必要对市售朱砂、辰砂样品进一步研究鉴别。
本文确定的3种色素金光红C、808猩红和苏丹红Ⅳ均为偶氮类色素,其多含有R-N=N-R′键和其他芳香环或其衍生物的结构,越来越多的研究证明一些肿瘤疾病与细胞中染色体变异有关,而摄入有机毒素是导致染色体变异的常见化学诱因,而偶氮类色素体内代谢物苯胺和萘胺也分别被列为三级致癌物和一级致癌物[7]。808猩红已被补充检验方法所收载,用于控制朱砂染色掺假行为,除朱砂外亦被不法商人用于其他中药品种的染色[15],在本试验中发现所有样品均使用其进行掺伪染色,说明即使已出台相关检测技术监管,朱砂掺染808猩红现象仍旧泛滥。更重要的是,此次8批样品均同时染有2种色素,说明市场上朱砂染色掺假现象普遍,此类现象在本课题组研究的其他药材中亦有发生。此前朱砂中染有苏丹红Ⅳ的行为尚未见报道,金光红C虽在朱砂染色中已有报道[12],但未有检测方法的研究报道。本课题组将对以上3种色素在朱砂中的染色情况做了进一步研究,并建立了朱砂中非法添加色素金光红C、808猩红及苏丹红Ⅳ的HPLC-Q-TOF/MS快速筛查方法和基于TLC和HPLC的通用检测方法,为朱砂药材的质量控制提供一定的科学依据。
| [1] |
中国药典2015年版. 一部[S]. 2015: 137. ChP 2015. Vol Ⅰ[S]. 2015:137 |
| [2] |
陈萍, 魏少阳, 朱胤龙, 等. 朱砂中HgS含量、形态和晶形研究[J]. 中国实验方剂学杂志, 2012, 18(6): 116. CHEN P, WEI SY, ZHU YL, et al. Study on HgS content, species and crystal construction of cinnabar[J]. Chin J Exp Tradit Med Form, 2012, 18(6): 116. |
| [3] |
梁爱华, 王金华, 薛宝云, 等. 朱砂对大鼠的肝肾毒性研究[J]. 中国中药杂志, 2009, 34(3): 312. LIANG AH, WANG JH, XUE BY, et al. Study on hepatoxicity and nephrotoxicity of cinnabar in rats[J]. China J Chin Mater Med, 2009, 34(3): 312. |
| [4] |
陆远富, 时京珍, 石京山, 等. 科学评价含雄黄朱砂中成药的安全性[J]. 中国中药杂志, 2011, 36(24): 3402. LU YF, SHI JZ, SHI JS, et al. Safety evaluation of realgar and cinnabar-containing traditional Chinese medicine[J]. China J Chin Mater Med, 2011, 36(24): 3402. |
| [5] |
李超英, 滕利荣, 魏秀德, 等. 朱砂水飞炮制工艺及质量标准研究[J]. 中成药, 2008, 30(12): 1806. LI CY, TENG LR, WEI XD, et al. Study on processing and quality standard of vermilion cinnabar[J]. Chin Tradit Pat Med, 2008, 30(12): 1806. DOI:10.3969/j.issn.1001-1528.2008.12.025 |
| [6] |
张春辉, 傅超, 陈安珍. 跌打丸中非法染色剂808猩红的检测[J]. 中国药事, 2015, 29(10): 1069. ZHANG CH, FU C, CHEN AZ. Detection of illegally added 808 scarlet in Dieda pills[J]. Chin Pharm Aff, 2015, 29(10): 1069. |
| [7] |
薛虎寅, 尹永梅, 张太昌, 等. 偶氮类合成色素检测技术的研究进展[J]. 生物技术进展, 2012, 2(3): 171. XUE HY, YIN YM, ZHANG TC, et al. Research on analysis of azo dyes in food products[J]. Curr Biotechnol, 2012, 2(3): 171. |
| [8] |
秦菲. 食品中苏丹红的毒性及检测方法[J]. 北京联合大学学报, 2008, 22(2): 50. QIN F. Toxicity and analytical methods of sudan dyes in food[J]. J Beijing Union Univ, 2008, 22(2): 50. |
| [9] |
王炫, 沈骎. 偶氮染料-苏丹红[J]. 化学教育, 2005(5): 1. WANG X, SHEN Q. Azo-dyes-sudan red[J]. Chem Educ, 2005(5): 1. |
| [10] |
钱疆, 杨方, 陈驰. 超高效液相色谱飞行时间质谱测定食品中36种合成色素[J]. 食品科学, 2013, 34(6): 215. QIAN J, YANG F, CHEN C. Determination of 36 kinds of synthetic pigment in food by UPLC-Q-TOF-MS[J]. Food Sci, 2013, 34(6): 215. DOI:10.7506/spkx1002-6630-201306048 |
| [11] |
于红伟, 曲青. 液相色谱-质谱法测定辣椒制品中苏丹红(Ⅰ、Ⅱ、Ⅲ、Ⅳ)染料[J]. 中国卫生检验杂志, 2007, 27(2): 274. YU HW, QU Q. Determination of sudan red(Ⅰ, Ⅱ, Ⅲ, Ⅳ)in Chili by HPLC-MS[J]. Chin J Health Lab Technol, 2007, 27(2): 274. |
| [12] |
吴萌, 饶伟文. 7批水飞朱砂伪品的鉴定[J]. 湖南中医药大学学报, 2007(27): 97. WU M, RAO WW. Identification of 7 batches of levigated falsified cinnabar[J]. J Hunan Univ Chin Med, 2007(27): 97. |
| [13] |
田富饶, 杨委, 杨兰花, 等. 高效液相色谱法检测化妆品中着色剂罗丹明B、金光红C和染料红57[J]. 化学分析计量, 2012, 21(6): 36. TIAN FR, YANG W, YANG LH, et al. Detection of rhodamine B, lake red C and litholrubin BCA[J]. Chem Anal Meas, 2012, 21(6): 36. |
| [14] |
SCHUMMER C, SASSEL J, BONENBERGER P, et al. Low-level detection of sudan Ⅰ, Ⅱ, Ⅲ and Ⅳ in spices and chili-containing foodstuffs using UPLC-ESI-MS/MS[J]. J Agric Food Chem, 2013, 61(9): 2284. DOI:10.1021/jf400602a |
| [15] |
黄宝斌, 许明哲, 杨青云, 等. 中成药和中药材添加化学物质补充检验方法分析[J]. 药物分析杂志, 2014, 34(9): 1701. HUANG BB, XU MZ, YANG QY, et al. Review of the approved supplementary testing methods and items on identifying adulterated chemical substances in traditional Chinese medicine preparations and herbal medicines[J]. Chin J Pharm Aanl, 2014, 34(9): 1701. |
 2017, Vol. 37
2017, Vol. 37 
