2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
透皮给药系统(transdermal drug delivery system,TDDS)也被叫作“贴剂”,这种剂型可以将有效剂量的药物透过患者的皮肤,从而达到治疗的目的,是药物可产生全身性或局部作用的一种薄片状制剂[1]。与注射剂和口服制剂相比,透皮贴剂在增加患者的顺应性和避免首过效应方面有着巨大的优势。自从1981年东莨菪碱贴剂上市,透皮吸收贴剂就以其独特的优点成为全球重点开发的给药系统。贴剂作为一种特殊的剂型,其释放度是直接影响作用效果的一项重要的质控指标。凝胶膏剂是贴剂的一种,系指提取物、饮片细粉或化学药物与适宜的亲水性基质混匀后,涂布于背衬材料上制成的贴膏剂[2]。凝胶膏剂具有透气性好,过敏率低,使用方便,患者依从性高等特点,该剂型已展现出较高的临床应用价值[3-4]。
吲哚美辛(indomethacin)又名消炎痛,为非甾体抗炎药,是最强的环氧酶制剂之一,有突出的消炎作用。吲哚美辛含量测定方法通常有高效液相色谱法[5]、气相色谱法[6]、紫外分光光度法[7]等。吲哚美辛凝胶膏剂为水凝胶贴剂,主要用于缓解局部软组织疼痛。与传统的贴片剂型相比,具有载药量大,适用范围广,贴敷性与保湿性好,无致敏与刺激性,可反复揭帖,安全性好等优点[8]。
光纤溶出法是利用光纤溶出仪对药物释放度进行实时、在线、全自动的检测方法,是药物溶出度自动检测技术的最新发展之一。光纤溶出法是通过光纤将特定波长的紫外光引入位于溶出杯的探头中,根据探头中溶出液对紫外光的吸收程度进行定量,其基本原理是朗伯比尔定律。光纤溶出仪为了增加仪器对不同样品的通用性,可以通过不同光程探头来达到合适的吸光度,然后根据吸光度来计算溶出度。目前虽然有一些文献有关于凝胶膏剂释放度研究[9-10],基本上都是对于中药凝胶膏剂,并且使用的检查装置大多使用Franc扩散池进行研究,此类研究也大多属于成药前的考察,而2015年版中国药典[11]要求对凝胶膏剂进行释放度的考察,对于制剂的质量控制应该使用药典规定的装置而不是标准化欠缺的扩散池装置,目前很少有使用法定溶出装置对凝胶膏剂的质量控制方面的研究[12]。本文旨在建立一个快速简便的吲哚美辛凝胶膏剂释放度测定方法光纤溶出法,能够快速便捷测得吲哚美辛凝胶膏剂的释放度,且对不同工艺的样本有一定的区分性。
1 仪器与试药 1.1 仪器Agilent 1260高效液相色谱仪(Agilent公司),Shodex ODS C18色谱柱,150 mm×4.6 mm,3 μm;十八烷基硅烷键合硅胶(Shodex公司);708DS溶出度仪(Agilent公司),Mettler-XS205DU电子天平(Mettler-Toledo公司)。
1.2 试药L1为正常生产条件下的吲哚美辛凝胶膏剂,将其作为对照组样本,L2-L5为不同储存条件下对照组样本,L6-L11为厂家按需求定制的样本;吲哚美辛对照品由中国食品药品检定研究院提供,批号100258-200904,含量为100.0%;水为实验室自制超纯水,甲醇为色谱纯,其余试剂均为优级纯或分析纯。
2 方法与结果 2.1 释放方法的建立 2.1.1 释放介质的选择根据以往实验经验,选择释放介质离子种类、离子浓度与有机相比例为考察条件。首先,选择氯化钠溶液与pH 6.8磷酸盐缓冲液进行考察,根据释放曲线选择离子种类为氯化钠;其次,选择0.9%氯化钠溶液与4.0%氯化钠溶液进行考察,根据释放量与更接近体内环境的原则,选择离子浓度为0.9%氯化钠溶液;最后,对0.9%氯化钠溶液-乙醇(50:50)、0.9%氯化钠溶液-乙醇(80:20)、0.9%氯化钠溶液进行考察,根据释放量、释放速率、释放介质中样品的状态,选择释放介质为0.9%氯化钠溶液-乙醇(50:50)。
2.1.2 装置的选择根据该药品注册标准,选择2015年版中国药典四部附录中释放度测定法第三法:浆碟法。
2.1.3 试验参数的选择转速对制剂的释放效率影响明显,考察50 r·min-1和100 r·min-1转速下的溶出情况,根据注册标准与释放量,选择转速为100 r·min-1。释放介质的体积多选择900 mL,故试验释放介质选定为900 mL。释放温度选择为体表温度32 ℃。
2.1.4 样品尺寸的选择根据光纤溶出仪测量探头配置大小、释放介质体积、样品标示量,选择最大直径为6 cm的样品大小。
2.2 溶液的制备 2.2.1 线性考察溶液精密称取吲哚美辛对照品24.04 mg,置于25 mL量瓶中,加甲醇溶解定容至刻度,即得储备溶液;准确移取储备溶液1 mL,置于10 mL量瓶中,用释放介质稀释定容至刻度,即得溶液①。准确移取溶液① 1 mL,置于10 mL量瓶中,用释放介质稀释定容至刻度,即得释放度测定对照溶液。准确量取溶液① 0.1、0.15、0.3、0.6、0.8、1、1.2、1.5、2 mL,分别置于10 mL量瓶中,用释放介质稀释定容至刻度,即得质量浓度分别为0.961 6、1.442 4、2.884 8、5.769 6、7.692 8、9.616、11.539 2、14.424、19.232 μg·mL-1的线性考察溶液。
2.2.2 释放介质精密量取0.9%氯化钠溶液500 mL,加入无水乙醇500 mL,混合均匀,量取900 mL作为释放介质。
2.2.3 样品处理剪裁样品直径为6 cm的圆形,使用双面胶固定于碟片之上,将其置于规定的释放介质当中。
2.2.4 空白溶液将空白贴剂剪裁为直径6 cm的圆形,与“2.2.3”项下同法操作,即得空白溶液。
2.3 HPLC法的建立与验证 2.3.1 色谱条件色谱柱:Shodex ODS C18 (150 mm×4.6 mm,3 μm);流动相:甲醇-0.01%磷酸溶液(67:33);流速:1 mL·min-1;柱温:35 ℃;检测波长:254 nm;进样量:10 μL。
2.3.2 线性关系考察取线性考察溶液,在上述色谱条件下分别进样测定,以吲哚美辛质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,求得回归方程:
| $ \mathit{A}\rm{=2}\rm{.408}\times \rm{1}{{\rm{0}}^{\rm{4}}}\mathit{C}\rm{+3}\rm{.283}\ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{9} $ |
由此可知,吲哚美辛质量浓度在0.9616~19.232μg·mL-1范围内,线性良好。
2.3.3 精密度试验取质量浓度为9.616 μg·mL-1的线性考察溶液,在上述色谱条件下,连续进样6针,计算峰面积的RSD为0.10%,表明精密度良好。
2.3.4 最小检出量取质量浓度为0.961 6 μg·mL-1的线性考察溶液,进样1针,得到S/N为54.0,计算得最小检出量为0.53 ng。
2.3.5 中间精密度取质量浓度为5.769 6、7.692 8、9.616、11.539 2μg·mL-1的线性考察溶液,连续进样6针,计算得RSD分别为0.12%、0.05%、0.10%、0.04%,表明精密度良好。
2.3.6 回收率试验分别取溶液① 0.8、1.0、1.2 mL(分别相当于测定值的80%、100%和120%),每个浓度各3份共9份,分别置于10 mL量瓶中,用空白溶液稀释并定容至刻度,过0.45 μm滤膜,取续滤液进行测定,计算回收率,平均回收率(n=9) 为101.6%,RSD=1.3%,回收率符合要求。
2.4 光纤溶出法的建立与验证 2.4.1 光纤溶出仪条件释放介质:0.9%氯化钠溶液-乙醇(50:50);转速:100 r·min-1;检测波长为254 nm。
2.4.2 线性关系考察取线性考察溶液,在上述光纤溶出法条件下,分6条通路分别进行测定,以吲哚美辛质量浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,分别求得6个溶出杯回归方程:
| $ \begin{align} & \mathit{A}\rm{=36}\rm{.80}\mathit{C}\rm{+}\rm{0}\rm{.021}\ \rm{4}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{5} \\ & \mathit{A}\rm{=36}\rm{.03}\mathit{C}\rm{+}\rm{0}\rm{.026}\ \rm{7}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{5} \\ & \mathit{A}\rm{=36}\rm{.18}\mathit{C}\rm{+}\rm{0}\rm{.028}\ \rm{5}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{6} \\ & \mathit{A}\rm{=36}\rm{.25}\mathit{C}\rm{+}\rm{0}\rm{.031}\ \rm{5}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{6} \\ & \mathit{A}\rm{=36}\rm{.79}\mathit{C}\rm{+}\rm{0}\rm{.027}\ \rm{6}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{7} \\ & \mathit{A}\rm{=36}\rm{.62}\mathit{C}\rm{+}\rm{0}\rm{.027}\ \rm{7}\ \ \ \mathit{r}\rm{=0}\rm{.999}\ \rm{8} \\ \end{align} $ |
由此可知,在该光纤测定条件下,6条通路中,吲哚美辛质量浓度在0.961 6~19.232 μg·mL-1范围内,线性良好。
2.4.3 精密度试验取质量浓度为9.616 μg·mL-1的线性考察溶液,在上述色谱条件下连续读数6针,计算六溶出杯峰面积的RSD分别为1.3%、1.1%、1.7%、1.3%、1.4%、1.2%。
2.4.4 中间精密度取质量浓度为5.769 6、7.692 8、9.616、11.539 2 μg·mL-1的线性考察溶液,连续进样6针,计算得RSD分别为1.0%、1.1%、0.89%、0.92%。
2.4.5 回收率试验分别取溶液① 0.8、1.0、1.2 mL(分别相当于测定值的80%、100%和120%),每个浓度各3份共9份,分别置于10 mL量瓶中,用空白溶液稀释定容至刻度,过0.45 μm滤膜,取续滤液进行读数测定,计算回收率,6个通道的平均回收率(n=9) 为103.6%、102.6%、101.6%、102.0%、102.1%、100.5%,RSD分别为2.6%、2.2%、1.2%、2.1%、1.82%、2.4%。
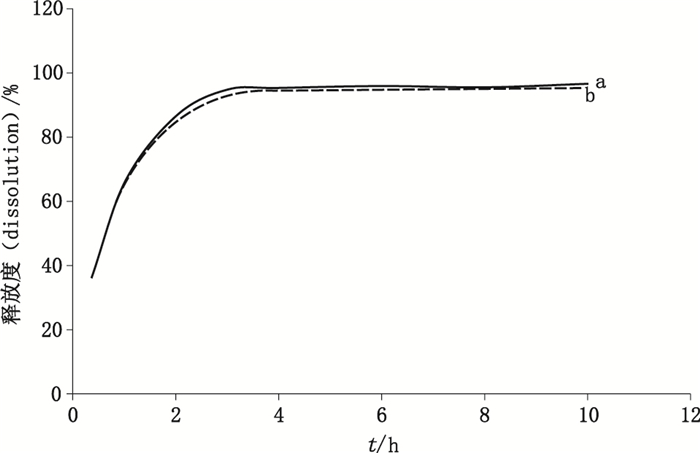
2.5 光纤溶出法与HPLC法比较 2.5.1 绘图法比较按照以上的色谱条件与释放度测定条件,剪裁样品大小为直径6 cm,选取20 min及1、2、3、4、6、8、10 h作为取样点,分别采用HPLC法和光纤溶出法对释放液进行测量,得到了2条释放曲线,见图 1。从该图可以直观地看出光纤溶出法与HPLC法所得到的释放曲线相似性。
|
图 1 相同样品分别使用光纤溶出法(a)与HPLC法(b)测定得到的释放曲线 Figure 1 Dissolution profiles of same samples analyzed by fiber optic method (a) and HPLC method (b) |
以同一释放点测定结果按不同方法分为两组,对均值进行一致性检验。从具体的数据看出光纤溶出法与HPLC法的释放度的区别,具体释放度数据非常相近,见表 1。
|
|
表 1 HPLC法与光纤溶出法溶出度比较(n=6) Table 1 Comparison of dissolution in HPLC method and optical fiber method |
以释放曲线整体测定结果按不同方法分为两组进行Weibull拟合,对重要参数进行相关性检验。Weibull分布是可靠性分析和寿命检验的理论基础,它可以拟合两参数,进行模拟比较,是一种连续型分布[13]。得到了两组数据的特征参数,见表 2。通过拟合,得到了两组数据的相关系数为0.999 8,相关系数在0.99以上,表明光纤溶出法与HPLC法没有明显的差别。
|
|
表 2 光纤溶出法与HPLC法特征参数(n=6) Table 2 HPLC and optical fiber characteristic parameters |
得到了几种不同工艺处方的产品,总结见表 3。
|
|
表 3 不同储存条件与工艺处方吲哚美辛凝胶膏剂 Table 3 Different storage conditions and process formulations indomethacin cataplasm list |
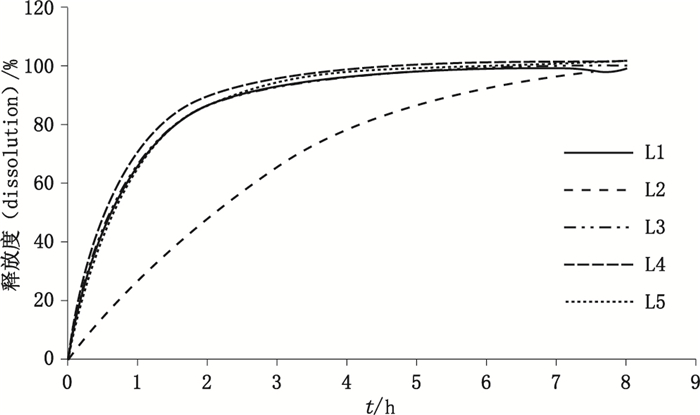
按照以上的溶出测定条件,剪裁样品大小为直径6 cm,进行测定。取样时间定为前1 h每5 min读数1次,后续7 h内皆15 min读数1次。所得到的释放曲线如图 2。
|
图 2 不同储藏处理后吲哚美辛凝胶膏剂释放曲线 Figure 2 Dissolution profiles of indomethacin cataplasm treated in different stored condition |
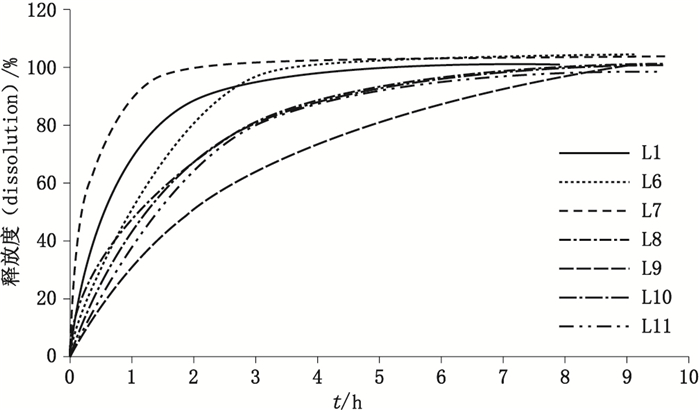
L1为不作处方工艺改变的样本;L2为60 ℃加热1周,高温会使得凝胶内部结构发生变化,从而能显著地影响释放度;L3~L5都为物理上的变化,使其水分减少、温度降低,但都不会改变其内部物质状态和结构,所以并不显著地影响其释放度;L6、L7中氮酮为促渗剂的一种,它可降低角质层细胞间脂质排列的有序性形成孔道[14-15],L7中添加氮酮可以升高药物的释放度[16-17]。L8~L11都为改变工艺参数,根据该吲哚美辛凝胶膏剂生产工艺资料可知,该4种工艺的改变理论上都可以降低药物的释放度。根据得到的图 3可看出,所建立的光纤释放度检测方法可以有效地区分不同工艺的吲哚美辛凝胶膏剂产品,与理论上不同工艺处方对释放度的改变一致。在后续的实验中可以取光纤溶出桨法,以便快速简便得到溶出结果。
|
图 3 不同生产工艺吲哚美辛凝胶膏剂释放曲线 Figure 3 Dissolution profiles of indomethacin cataplasm made in different processes |
对于释放介质中有机相比例的选择,由于在有机相比例低于50%时,样品在释放介质中会吸水膨胀、介质变浑浊影响光纤溶出法的测定,初步猜测凝胶膏剂的骨架遭到了破坏。综合该吲哚美辛凝胶膏剂进口注册标准,选择为50%。更加合适的有机相比例,在后续的试验中会继续探究。
3.2 水分该凝胶膏剂中水分含量较高,经测定约为56%,在释放过程中会失水,对测定结果会有一定的影响。
3.3 光纤溶出仪光纤溶出仪对释放度进行直接读数测定有一定的局限性。首先,朗伯比尔定律针对的是稀溶液,浓度大、吸光度大的时候,曲线偏离会很严重,朗伯比尔定律不适用;其次,光纤溶出仪可以检测释放介质中加了表面活性剂的样品的释放度,只是加了表面活性剂后,溶媒容易产生气泡,做实验前一定要将气泡从光纤探头上排出。释放介质也要一直保持澄清,浑浊会影响仪器的读数测定。但是该法的操作简单快速,可以自动处理数据等众多优点,可以满足普通科研工作的要求,有越来越多的科研工作者选择了这种省时省力的仪器。
| [1] |
陈华, 左宁, 南楠. 透皮贴剂黏附力检测方法的简述[J]. 药物分析杂志, 2014, 34(8): 1343. CHEN H, ZUO N, NAN N. Discussion on adhesion test for transdermal delivery system[J]. Chin J Pharm Anal, 2014, 34(8): 1343. |
| [2] |
杨莉. 透皮的研究进展与临床应用[J]. 继续医学教育, 2006, 20(28): 82. YANG L. Research progress and clinical application of transdermal patch[J]. Contin Med Educ, 2006, 20(28): 82. DOI:10.3969/j.issn.1004-6763.2006.28.017 |
| [3] |
徐月红, 叶卉, 官素桃, 等. 白芥子涂方凝胶膏剂的体外释放及透皮特性研究[J]. 中成药, 2011, 33(12): 2068. XU YH, YE H, GUAN ST, et al. Study on the in vitro release and transdermal characteristics of white mustard paste[J]. Chin Tradit Pat Med, 2011, 33(12): 2068. DOI:10.3969/j.issn.1001-1528.2011.12.012 |
| [4] |
董礼, 徐希明, 余江南, 等. 中药凝胶膏剂研究概述[J]. 中国药师, 2011, 14(1): 129. DONG L, XU XM, YU JN, et al. Overview of traditional Chinese medicine gel ointment[J]. China Pharm, 2011, 14(1): 129. |
| [5] |
张晓璐, 戴夕娣, 丁健. 高效液相色谱法测定复方吲哚美辛乳膏中吲哚美辛的含量[J]. 药物分析杂志, 2007, 27(8): 1269. ZHANG XL, DAI XD, DING J. RP-HPLC determination of indomethacin in compound in indomethacin cream[J]. Chin J Pharm Anal, 2007, 27(8): 1269. |
| [6] |
叶红英. 气相色谱法测定新癀片中吲哚美辛的含量[J]. 海峡药学, 2003, 15(3): 34. YE HY. Determination of indomethacin in Xinhuang tablets by gas chromatography[J]. J Strait Pham, 2003, 15(3): 34. |
| [7] |
中国药典2000年版. 二部[S]. 2000: 295 ChP 2000. Vol Ⅱ[S]. 2000: 295 |
| [8] |
龚受基, 郭文乔, 李小娟, 等. 正交试验法优化雪灵芝巴布剂配方[J]. 中国医院药学杂志, 2009, 29(14): 1176. GONG SJ, GUO WQ, LI XJ, et al. Optimization of kansusanduort cataplasm formulation using orthogonal design[J]. Chin Hosp Pham J, 2009, 29(14): 1176. DOI:10.3321/j.issn:1001-5213.2009.14.009 |
| [9] |
朱力阳, 马建, 涂禾, 等. 丁桂凝胶膏剂与丁桂活络膏体外释放及透皮特性比较研究[J]. 中草药, 2015, 46(15): 2223. ZHU LY, MA J, TU H, et al. Comparison of release and transdermal behavior in vitro between Dinggui gel paste and Dinggui Huoluo rubber patch[J]. Chin Tradit Herb drugs, 2015, 46(15): 2223. DOI:10.7501/j.issn.0253-2670.2015.15.008 |
| [10] |
张锦炳, 李周, 张艳, 等. 温经止痛凝胶膏剂体外释放度及透皮特性的研究[J]. 中国医药导报, 2016, 13(3): 35. ZHANG JB, LI ZH, ZHANG Y, et al. Study on release and permeation behavior of Wenjingzhitong Gel Paste in vitro[J]. Chin Med Rep, 2016, 13(3): 35. |
| [11] |
中国药典2015年版. 四部[S]. 2015: 22 ChP 2015. Vol Ⅳ[S]. 2015: 22 |
| [12] |
陈鹰, 陈湖海, 徐亨隽, 等. 复方双氯芬酸辣椒凝胶贴膏的质量控制及体外透皮[J]. 中国医院药学杂志, 2011, 31(18): 1499. CHEN Y, CHEN HH, XU HJ, et al. Quality control and transdermal penetration in vitro of compound diclofenac capsaicin cataplasm[J]. Chin Hosp Pharm J, 2011, 31(18): 1499. |
| [13] |
郭波涛, 王文昌, 李辉智, 等. Weibull分布拟合的经验似然方法[J]. 中国卫生统计, 2009, 26(1): 7. GUO BT, WANG WC, LI HZ, et al. Empirical likelihood method for fitting Weibull distribution[J]. Chin J Health Stat, 2009, 26(1): 7. |
| [14] |
KANNO Y, OKADA H, YAMAJI Y, et al. Angiotensin-convertingenzyme inhibitors slow down renal decline in IgA nephropathy, independent of tubulointerstitial fibrosis at presentation[J]. QJM, 2005, 98(3): 199. DOI:10.1093/qjmed/hci036 |
| [15] |
ASABA K, TOJO A, ONOZATO ML, et al. Long-term renal prognosis of IgA nephropathy with therapeutic trend shifts[J]. Intern Med, 2009, 48(11): 883. DOI:10.2169/internalmedicine.48.1938 |
| [16] |
李雨辰, 曹岩, 王悦, 等. 盐酸利多卡因纳米高分子脂质体的制备与体外透皮实验研究[J]. 天津医药, 2013, 41(4): 341. LI YC, CAO Y, WANG Y, et al. Preparation and in vitro transdermal permeation of lidocaine hydrochloride nanoparticles[J]. Tianjin Med J, 2013, 41(4): 341. |
| [17] |
丁水生, 肖学成, 李金, 等. 丙酸氟替卡松乳膏体外透皮吸收量测定[J]. 医学导报, 2012, 31(12): 1613. DING SH, XIAO XC, LI J, et al. Determination of in vitro percutaneous absorption of fluticasone propionate cream[J]. Her Med, 2012, 31(12): 1613. |
 2017, Vol. 37
2017, Vol. 37 
