腹水草(Veronicastrum axillare Yamazaki)为玄参科腹水草属植物,在浙江、安徽、江苏、江西、福建和广东等地广泛分布,味苦,微寒,归肝、脾、肾经[1],具有逐水消肿,消炎解毒等功效[2],多以茎叶入药。临床上利用其茎叶水煎剂治疗肝硬化[3]、胸腔积液[4]、急慢性肾炎[2]。据报道[5-7],腹水草中含有黄酮、萜、生物碱、酚酸、多糖等类有效成分,本文研究的咖啡酸、香草酸、阿魏酸、原儿茶酸属于酚酸类成分,木犀草素和金合欢素属于黄酮类成分,均具有不同程度的抗菌、抗氧化、抗病毒等活性,其中木犀草素和阿魏酸还具有一定的抗肿瘤作用。现有的文献仅有关于不同腹水草属和腹水草根部中熊果酸的薄层扫描检测方法[8-9],未见其他关于腹水草成分含量测定的报道,已有检测方法专属性不强,控制成分单一,不能反映腹水草药材的整体质量。指纹图谱是基于对中药物质群整体作用的认识,借助于波谱和色谱等技术获得中药化学成分的光谱或色谱图,是实现鉴别中药真实性,评价质量一致性和产品稳定性的可行模式[10],在中药制剂[11]和中药材[12-13]的质量控制研究中广泛应用。本研究采用高效液相色谱法建立腹水草茎叶的指纹图谱,并对其中咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素6个主要成分进行含量测定方法的研究,为腹水草质量控制提供可靠依据。
1 仪器与试药 1.1 仪器安捷伦公司Agilent 1260高效液相色谱仪、Agilent DAD检测器及Agilent Chemistation色谱工作站,安捷伦公司Agilent Zobax (250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶),梅特勒托利多国际有限公司BS124S电子分析天平,密理博中国有限公司Millipore超纯水机,广东固特超声股份有限公司GT-2227QTS固特超声清洗器。
1.2 试药对照品咖啡酸(批号20160505)、香草酸(批号20160721)、阿魏酸(批号20150925)、原儿茶酸(批号20151021)、木犀草素(批号20160702) 和金合欢素(批号20160716),均购自Soarbio公司,纯度均大于98.0%。
乙腈为色谱纯,超纯水为自制,乙醇、磷酸等试剂为分析纯。
腹水草茎叶通过采集和购买的形式进行收集,具体采集和购买地点及产地见表 1,所有腹水草药材经浙江医药高等专科学校杨雄志教授鉴定为玄参科腹水草Veronicastrum axillare Yamazaki的茎叶。
|
|
表 1 腹水草药材来源 Table 1 Origins of the stems and leaves of Veronicastrum axillare |
取本品粉末(过3号筛)约10.0 g,精密称定,置于具塞锥形瓶中,加入75%乙醇水溶液100 mL,称量,回流提取30 min,放冷至室温,称量后用75%乙醇水溶液补足减失的量,摇匀,用微孔滤膜过滤,收集续滤液,即得。
2.1.2 混合对照品储备液分别称取咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的对照品适量,精密称定,用75%乙醇水溶液配制成混合溶液(咖啡酸0.3 mg·mL-1,香草酸1 mg·mL-1,阿魏酸0.5 mg·mL-1,原儿茶酸1 mg·mL-1,木犀草素1 mg·mL-1,金合欢素0.5 mg·mL-1),即得。
2.1.3 空白溶液75%乙醇水溶液。
2.2 色谱条件色谱柱:Agilent Zobax C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~60 min,0→40%A;60~70 min,40%A→100%A;70~80 min,100% A);流速:1.0 mL·min-1;检测波长:230 nm;柱温:30 ℃;进样量:10 μL。
2.3 HPLC指纹图谱的建立 2.3.1 精密度试验取同一供试品溶液,按上述色谱条件连续进样6次,以金合欢素为参比峰,测得27个共有峰的相对保留时间RSD分别为0.13%、0.32%、0.28%、0.20%、0.09%、0.26%、0.53%、0.57%、0.26%、0.17%、0.10%、0.27%、0.53%、0.30%、0.25%、0.41%、0.33%、0.52%、0.19%、0.34%、0.50%、0.34%、0.65%、0.46%、0.09%、0.10%、0.21%,相对峰面积的RSD分别为0.79%、0.66%、0.82%、0.91%、0.58%、0.02%、0.39%、0.39%、0.65%、0.73%、0.82%、0.96%、0.56%、0.47%、0.69%、0.87%、0.97%、1.31%、0.76%、1.13%、0.59%、0.90%、0.38%、1.77%、0.72%、0.86%、0.54%,表明仪器的精密度良好。
2.3.2 重复性试验取同一批腹水草样品,按照“2.1.1”项下方法制备供试品溶液,并按上述色谱条件分析,以金合欢素为参比峰,测得27个共有峰的相对保留时间RSD分别为0.25%、0.37%、0.18%、0.42%、0.65%、0.06%、0.95%、1.16%、0.93%、0.31%、0.99%、1.05%、0.34%、0.66%、1.22%、1.87%、1.14%、0.83%、0.19%、0.72%、1.03%、1.56%、0.87%、0.76%、0.08%、0.21%、0.17%,相对峰面积的RSD分别为0.56%、0.43%、0.78%、0.24%、0.19%、0.06%、0.10%、0.97%、0.75%、0.05%、1.22%、1.87%、0.15%、0.12%、0.36%、0.93%、1.02%、1.37%、0.21%、1.67%、1.98%、1.56%、1.17%、1.23%、0.31%、0.22%、0.41%,表明指纹图谱测定方法重复性好,符合技术要求。
2.3.3 稳定性试验取同一供试品溶液,在室温放置0、2、4、8、12、24 h后分别进样,以金合欢素为参比峰,测得27个共有峰的相对保留时间RSD分别为0.10%、0.25%、0.37%、0.98%、0.42%、0.65%、0.06%、0.35%、0.16%、0.64%、0.12%、0.42%、1.33%、0.33%、0.25%、0.43%、0.52%、0.36%、0.27%、0.20%、0.67%、0.97%、0.78%、0.24%、0.09%、0.10%、0.22%,相对峰面积的RSD分别为0.16%,0.13%,0.78%,0.04%,0.09%,0.16%,1.10%,0.37%、0.02%、1.17%、1.57%、0.10%、0.08%、0.53%、1.05%、1.24%、1.34%、1.86%、0.17%、0.64%、2.10%、1.55%、1.43%、0.88%、0.21%、0.64%、0.78%,表明供试品溶液在室温放置24 h测定结果稳定。
2.3.4 指纹图谱的建立取10批腹水草样品,按照“2.1”项下方法制备供试品溶液,并按上述色谱条件分析,见图 1。将10批样品的色谱图导入中国药典委员会“中药色谱指纹图谱相似度评价系统2004A版”,建立腹水草HPLC指纹图谱的共有模式,标定了26个共有峰,见图 2。以金合欢素为参比峰,计算27个共有峰的相对保留时间RSD分别为0.15%、0.22%、0.27%、0.05%、0.07%、0.26%、0.17%、0.54%、0.45%、0.01%、0.28%、0.46%、0.05%、0.10%、0.22%、0.16%、0.19%、0.14%、0.08%、0.37%、0.24%、0.36%、0.28%、0.19%、0.08%、0.12%、0.19%,符合指纹图谱的要求。

|
图 1 10批腹水草的HPLC指纹图谱 Figure 1 HPLC fingerprint of 10 batches of the stems and leaves of Veronicastrum axillare |

|
图 2 腹水草的对照指纹图谱 Figure 2 HPLC standard fingerprint of the stems and leaves of Veronicastrum axillare |
将10批样品的色谱图导入中国药典委员会“中药色谱指纹图谱相似度评价系统2004A版”,计算10批样品与混合对照品的相似度分别为0.981、0.969、0.973、0.952、0.990、0.983、0.931、0.943、0.966、0,959,均大于0.93,说明不同产地的腹水草质量相对稳定。
2.4 腹水草中6个成分含量测定 2.4.1 系统适用性试验取供试品溶液、混合对照品溶液和空白溶液,按“2.2”项下色谱条件采集色谱图(见图 3),各待测物色谱峰的分离度大于1.5,理论塔板数大于5 000,拖尾因子在0.9~1.1之间。
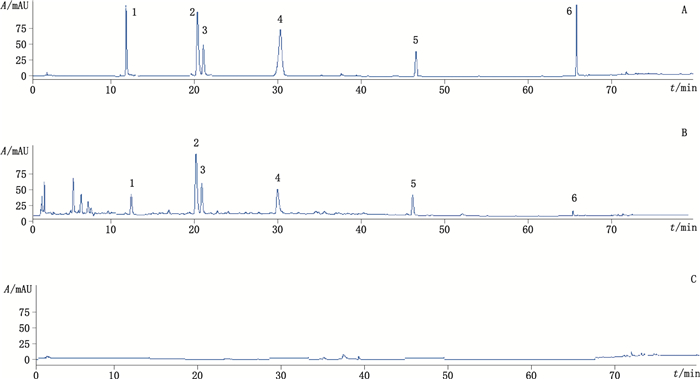
|
1.香草酸(vanillic acid) 2.原儿茶酸(protocatechuic acid) 3.咖啡酸(caffeic acid) 4.阿魏酸(ferulic acid) 5.木犀草素(luteolin) 6.金合欢素(acacetin) 图 3 混合对照品(A)、腹水草供试品(B)和空白溶液(C)HPLC谱图 Figure 3 HPLC chromatograms of mix standard chemicals (A), Veronicastrum axillare sample (B) and blank (C) |
将“2.1.2”项下混合对照储备液以75%乙醇水溶液稀释至5、10、20、50、100倍,制成系列混合对照品溶液,分别进样,以色谱峰峰面积(Y)为纵坐标,浓度(X,μg·mL-1)为横坐标,制作标准曲线,得咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的回归方程和线性范围,结果见表 2。
|
|
表 2 6个对照品的线性关系和范围 Table 2 Regression equations and linear ranges of six reference substances |
取混合对照品储备液稀释20倍,连续进样6次,记录咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的峰面积,计算上述各待测物峰面积的RSD分别为0.23%、0.56%、0.30%、0.18%、0.20%、0.09%,表明仪器精密度良好。
2.4.4 重复性试验取同一批腹水草样品,按照“2.1.1”项下方法制备供试品溶液,并按上述色谱条件分析,将峰面积带入标准曲线回归方程,计算咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的含量分别为27.6、52.3、39.7、62.2、83.9和41.1 μg·g-1,各成分含量的RSD分别为0.92%、1.27%、1.59%、1.82%、1.16%和1.04%,表明方法的重复性良好。
2.4.5 加样回收率试验取已知含量的采腹水草样品约5.0 g,共6份,精密称定,分别加入一定量对照品,按“2.1.1”项下方法制备供试溶液,按“2.2”项下色谱条件进行测定,计算回收率,见表 3。
|
|
表 3 6个成分的加样回收率(n=6) Table 3 The recoveries of the six constituents |
取同一供试品溶液,在室温放置0、2、4、8、12、24 h后分别进样,记录咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的峰面积,计算峰面积的RSD分别为0.22%、0.41%、0.54%、0.47%、0.38%和0.53%,说明6个待测成分在供试品溶液中24 h内稳定,不影响测定。
2.4.7 含量测定取各药材粉末,按“2.1.1”项下方法制备供试品溶液,每个样品平行2份,并按“2.2”项下色谱条件进行测定,将峰面积带入标准曲线回归方程计算各样品中6个成分的含量,结果见表 4。
|
|
表 4 腹水草样品的测定(μg·g-1,n=2) Table 4 Determination of samples |
分别考察提取溶剂(甲醇、75%乙醇、50%甲醇和50%乙醇溶液)、提取时间(30、45、60、90、120 min)、提取方式(超声、回流),以色谱峰个数多及含量较高为指标,确定75%乙醇溶液回流30 min制备供试品溶液。
3.2 色谱条件的选择使用DAD检测器在190~400 nm全波长扫描光谱图,并采集230、254和265 nm处样品色谱图,比较色谱峰数量、基线平稳程度、色谱峰面积、含量测定成分与相邻色谱峰的分离度等因素,确定230 nm为最佳测定波长;分别考察甲醇和乙腈作为有机相,0.1%醋酸水溶液、0.1%磷酸水溶液、醋酸钠缓冲液、磷酸二氢钾缓冲液作为水相,不同组合之后所得的色谱图,以分离度、分析时间为指标,最后确定0.1%磷酸水-乙腈梯度洗脱最为合适。
3.3 相似度评价将10批腹水草样品的HPLC指纹图谱导入“中药色谱指纹图谱相似度评价系统2004A版”,设定不同参考图谱,对共有峰的识别影响不大,所以以鄞州药材公司购买的产地为福建的腹水草HPLC指纹图谱为参照,分别提取面积百分比大于0.1%、0.2%、0.3%、0.4%、0.5%的峰作为有效峰组成相应样本,进行共有峰识别,以共有峰数目并结合DAD光谱吸收曲线为衡量项目,确定提取面积百分比大于0.3%的峰作为有效峰组成相应样本。由相似度计算结果可知,不同产地腹水草具有较好的质量相关性。
3.4 含量测定采用建立的HPLC方法测定了10批5个不同产地的腹水草样品,不同产地相同成分含量差异明显,相同产地同一成分的含量也存在一定差异,所以对腹水草质量进行严格控制至关重要。目前针对腹水草的药效学研究主要集中在治疗水液代谢失调疾病如胃溃疡、胸腔积液[14-15],若能找到有效成分,下一步以HPLC指纹图谱为基础,建立谱效关系档案,将对中药腹水草质量控制和合理应用开发具有更重要的价值。
4 结论本研究所建立的腹水草指纹图谱方法能够较准确反映药材的质量情况,又同时测定了其中咖啡酸、香草酸、阿魏酸、原儿茶酸、木犀草素和金合欢素的含量,方法简便。利用腹水草指纹图谱和6个成分含量同时测定的方法,可以为更加准确灵敏地控制腹水草药材的质量提供参考。
| [1] |
南京中医药大学. 中药大辞典.下册[M]. 第2版. 上海: 上海科学技术出版社, 2006, 3514. Nanjing University of Chinese Traditional Medicine. The Dictionary of Medicinal Plant. The Second Volume[M]. 2nd Ed. Shanghai: Shanghai Science and Technology Publishers, 2006, 3514. |
| [2] |
党旋, 赵兵, 高昂, 等. 腹水草属药学研究概况[J]. 安徽农业科学, 2011, 39(32): 19801. DANG X, ZHAO B, GAO A, et al. Pharmaceutical research of Veronicastrum[J]. Anhui Agric Sci, 2011, 39(32): 19801. |
| [3] |
舒军. 过路黄腹水草治疗肝硬化110例[J]. 实用中医内科杂志, 2005, 19(2): 148. SHU J. The clinical observation of 110 cases of cirrhosis treated by Veronicastrum axillare[J]. J Pract Tradit Chin Intern Med, 2005, 19(2): 148. |
| [4] |
吴金辉. 腹水草治疗胸腔积液[J]. 浙江中医杂志, 2003, 38(1): 11. WU JH. The treatment of pleural effusion by Veronicastrum axillare[J]. Zhejiang J Tradit Chin Med, 2003, 38(1): 11. |
| [5] |
邓雪红. 腹水草(爬岩红)的化学成分及抗炎活性研究[D]. 福州: 福建中医药大学, 2013 DENG XH. Study on Chemical Constituents and Anti-inflammatory Activity of Veronicastrum axillare[D]. Fuzhou:Fujian University of Traditional Chinese Medicine, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10393-1013186264.htm |
| [6] |
刘玥, 王峥涛, 徐国均, 等. 爬岩红的化学成分研究[J]. 中草药, 1999, 30(7): 490. LIU Y, WANG ZT, XU GJ, et al. Study on chemical constituents of Veronicastrum axillare[J]. Chin Tradit Herb Drugs, 1999, 30(7): 490. |
| [7] |
邓雪红, 郑呈剑, 吴宇, 等. 爬岩红化学成分研究[J]. 中国药学杂志, 2013, 48(10): 777. DENG XH, ZHENG CJ, WU Y, et al. Chemical constituents of whole plant of Veronicastrum axillare(Sieb. et Zucc.)Yamazaki[J]. Chin Pharm J, 2013, 48(10): 777. |
| [8] |
赵焕霞, 刘玥, 宋哲, 等. 薄层扫描法测定7种腹水草属植物中熊果甙的含量[J]. 中国野生植物资源, 1997, 16(3): 30. ZHAO HX, LIU Y, SONG Z, et al. Determination of arbutin in 7 species of Veronicastrum herbs by TLC scanning[J]. Chin Wild Plant Resour, 1997, 16(3): 30. |
| [9] |
赵焕霞, 石延榜. 薄层扫描法测定腹水草根部熊果苷的含量[J]. 河南中医学院学报, 2007, 22(4): 33. ZHAO HX, SHI YB. Content determination of arbutin in villosulous veronicastrum herb or root by LSM[J]. J Henan Univ Chin Med, 2007, 22(4): 33. |
| [10] |
李强, 杜思邈, 张忠亮, 等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药, 2013, 44(22): 3095. LI Q, DU SM, ZHANG ZL, et al. Progress in fingerprint technology on Chinese materia medica and prospect of its future development[J]. Chin Tradit Herb Drugs, 2013, 44(22): 3095. |
| [11] |
朱林燕, 谢建峰, 孔子铭, 等. 藏药二十一味寒水石丸的HPLC指纹图谱研究[J]. 药物分析杂志, 2015, 35(8): 1430. ZHU LY, XIE JF, KONG ZM, et al. Study on HPLC fingerprint of Ershiyiwei Hanshuishi pills[J]. Chin J Pharm Anal, 2015, 35(8): 1430. |
| [12] |
刘吉成, 陈大建. 黑草药材HPLC指纹图谱的研究[J]. 药物分析杂志, 2013, 33(3): 424. LIU JC, CHEN DJ. HPLC fingerprint study of the herb of Buchnera cruciata[J]. Chin J Pharm Anal, 2013, 33(3): 424. |
| [13] |
潘伟东, 杜义龙, 赵胜男, 等. 韩信草的高效液相色谱指纹图谱及化学模式识别[J]. 药物分析杂志, 2015, 35(2): 250. PAN WD, DU YL, ZHAO SN, et al. HPLC fingerprint and chemical pattern recognition of Scutellaria indica[J]. Chin J Pharm Anal, 2015, 35(2): 250. |
| [14] |
娄勤进, 徐艳山, 赵伟春, 等. 水液代谢在胃黏膜损伤中的调控及腹水草的干预作用研究[J]. 浙江中医药大学学报, 2016, 40(1): 1. LOU QJ, XU YS, ZHAO WC, et al. Study on the regulation roles of water metabolism in gastric mucosa injury induced by ethanol and the effect of Veronicastrum axillare[J]. J Zhejiang Chin Med Univ, 2016, 40(1): 1. |
| [15] |
徐艳山, 赵伟春, 王丹伊, 等. 腹水草对人胃上皮细胞GES-1的保护作用及其对PKA、CREB、AQP1的调控研究[J]. 浙江中医药大学学报, 2016, 40(3): 173. XU YS, ZHAO WC, WANG DY, et al. Protective effect of Veronicastrum axillare on human gastric epithelial cells(GES-1) and its modulation on the PKA, CREB and AQP1[J]. J Zhejiang Chin Med Univ, 2016, 40(3): 173. |
 2017, Vol. 37
2017, Vol. 37 
