2. 成都军区昆明总医院, 昆明 650032
2. Kunming General Hospital of Chengdu Military Region, Kunming 650032, China
肠外营养(parenteral nutrition,PN)[1],是将机体所需的碳水化合物、氨基酸、脂肪乳、电解质、维生素、微量元素和水这7大营养要素按比例混合在一个输液袋中,称为全营养混合液(total nutrient admixture,TNA),以外周或中心静脉插管输入的方式直接输入机体,使病人在不进食的状况下仍然维持良好的营养状况,减少营养不良风险,改善临床结局,并可以继续生长发育的一种重要的临床治疗方法。TNA本身就是一个多种化合物的热力学不稳定复杂体系,该体系中各种成分之间存在相互影响。国内外由于TNA安全性控制不到位,导致患者行PN治疗后出现严重不良事件甚至导致死亡的案例比比皆是[2-5]。因此,把控TNA的稳定性及各成分的相容性是确保其合理医疗的前提和基础。多年来医务工作者及制药研究者对该项工作开展了多方面的研究。随着分析方法及仪器的不断发展,人们对TNA稳定性及相容性认识也更加清晰和深入。为此,本文拟围绕TNA稳定性及相容性评价技术的实践与应用进行探讨,为合理开展TNA评价提供依据与支持。
1 药物的稳定性与相容性药物的稳定性与相容性所关注的主体不同,涉及的研究内容也不尽相同,但两者常容易混淆[6]。药物稳定性指的是药品在温度、湿度等环境的变化下,保持其物理化学性质及生物、微生物性质的能力[7]。其关注点在于目标药物活性成分的降解或衰变、目标制剂效能的改变及其目标药物性质的改变。在对TNA的研究中,稳定性通常涉及药物的效价降低(如氨基酸含量降低[8])或剂型破坏(如脂肪乳破乳而出现游离分层[9-10])。药物的相容性通常指2种或多种成分能否和谐共存。其关注点在于药物与药物或药物与其他物质之间的相互作用及发生的反应[6]。在对TNA的研究中,不相容通常表现为不溶性沉淀产生(如钙、镁离子同磷酸根离子间发生的沉淀反应[11-12]),变色(如托烷司琼、埃索美拉唑等治疗药物与TNA混合[13]),由于包材的吸附作用使得部分药物损失[如胰岛素会被聚氯乙烯(PVC)容器表面吸附等[14]]。现将已有的关于TNA稳定性和相容性研究评价方法归纳如表 1。
|
|
表 1 TNA稳定性及相容性评价研究项目及方法 Table 1 Evaluation research projects and methods of assessing stability and compatibility of TNA |
脂肪乳能为患者提供能量及必需脂肪酸[15]。脂肪乳剂乳滴粒径一般控制在0.4~1 μm,如果乳滴粒径超过5 μm,静脉输注后容易造成脂肪栓塞[16]。TNA中脂肪乳稳定性的评价技术包括测定pH、测定Zeta电位及测定脂肪乳粒粒径大小和分布3种方法。
2.1 pH测定pH测定是脂肪乳稳定性研究中较多考察的项目。文献报道[17],TNA的pH应控制在5~6之间,在此范围内营养液的稳定性最好。pH低于5,脂肪乳易丧失稳定性,逐渐产生凝聚、变色、液滴边缘不规则;pH偏高,可使葡萄糖及氨基酸产生褐色反应,从而影响整个TNA的稳定性。然而,pH的测定仅能对TNA的稳定性进行粗略评估,该项测定并不能给出精确判定结论,即pH过高或过低TNA都存在不稳定风险,但无法确定影响程度和速度,适中的pH也不能得出该TNA稳定的结论。该项测定必须与其他方法联合应用、综合分析,才能得出比较有说服力的结果及结论。
2.2 Zeta电位测定Zeta电位是微粒表面所带电荷数量的表征,是衡量脂肪乳粒稳定性的重要参数。Zeta电位绝对值越高,其乳粒间的静电斥力也就越大,物理稳定性也就越好。对于水相中电解液含量低的O/W型乳剂来说,Zeta电位30 mV已经足够建立最大能量(能垒)来保证乳剂的稳定性[18]。目前测量Zeta电位的方法主要有电泳法、电渗法、流动电位法以及超声波法,其中以电泳法应用最广,包括显微电泳法和光散射电泳法。
2.2.1 显微电泳法该方法是在直流电场作用下,用显微镜直接观测单个胶粒在电泳池中的移动,直接求出胶体颗粒的电泳迁移率。只要脂肪颗粒的大小在显微镜可见的范围之内,都可以应用此法。该方法测定优点是:可直接观测到颗粒的形状和大小,并适用于离子强度较低的情况,且仪器造价较低;其缺点是:人为误差影响较大,试验的重现性较低,脂肪乳颗粒大小的适用性受显微镜观察倍数的限制,不适用于较浓脂肪乳的测量。
2.2.2 光散射电泳法该方法是通过测量散射激光的多普勒位移来测定电泳速率的技术。光散射电泳法将激光光散射与显微电泳相结合,可精确测定粒子在外电场下的动力学性质,具有测量速度快,分辨率高和适应范围广等优点[19]。该法准确度、可靠性及重现性明显高于显微电泳法,是目前测定乳剂Zeta电位的主要方法。关于TNA中乳剂的电动性质与它们受到其他因素影响时的不稳定性的研究已取得一些进展[20-21]。Washington等[22]尝试通过系统Zeta电位的测定,建立模型预测TNA中乳剂的稳定性。然而,该模型仅涉及葡萄糖浓度及离子强度对特定乳剂稳定性影响的预测,氨基酸及水相中其他物质并未考虑。而且,实测结果与预测存在一定偏差。目前,仍无法通过Zeta电位测定准确预测TNA中乳剂的稳定性,该项测定多用于乳剂不稳定的具体原因分析。
2.3 乳粒粒径大小和分布测定脂肪乳制备工艺决定其粒径无法完全均一,存在一定粒径分布范围。图 1显示了静注用脂肪乳粒径的一般分布状态。从图中可知,乳剂的粒径范围一般在0.05~10 μm,其中平均粒径为0.3 μm的脂滴占大多数,极端值(极小值与极大值)脂滴含量很少。优化处方或工艺可能只会让图中的“峰”向左移动或峰宽变窄,不会改变脂滴粒径分布在一定范围内的事实。在脂肪乳中,当脂滴合并成直径超过1 μm的大脂滴时,脂滴的合并便是不可逆的过程,脂滴会逐渐聚集,1 μm脂滴可“生长”成5 μm甚至更大的脂滴颗粒,直至自由脂滴从乳剂中析出,成为不稳定脂肪乳。Driscoll等[23]实验证明,当直径大于5 μm的脂滴占脂肪乳油相体积的百分比(percentage of fat globules greater than five micrometers,PFAT5) 超过0.4%时,肉眼明显观察到相分离,此时乳剂极不稳定,也就是说,脂肪乳PFAT5的值与脂肪乳的稳定性密切相关,它直接影响脂肪乳的安全[24]。保证微小粒径乳粒在水相中的稳定分布,防止乳粒合并生成大脂滴是确保脂肪乳稳定性的关键。因此,通过测定TNA中乳粒粒径大小和分布,对TNA中脂肪乳的稳定性进行评价是最为真实、准确的评价方法。
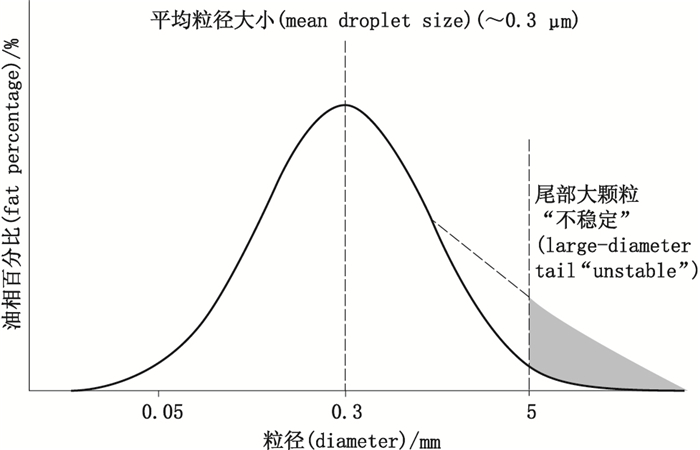
|
阴影区域指示的是脂肪乳中已成为尾部大颗粒的脂滴(shaded area indicating fat globule growth in the large-diameter tail) 图 1 静注用脂肪乳粒径分布的一般状态图[23] Figure 1 Normal probability curve and relevant droplet/globule populations for lipid injectable emulsions[23] |
该方法粒度基准是“个数”,其原理是利用显微镜放大视野或视野成像照片目测计数视野中微粒大小及个数。该方法使用的仪器有光学显微镜及扫描电镜。光学显微镜测定方法为直接取待测样品至显微镜下观察,其优点是直观可辨,但缺点是人为因素影响较大,操作烦琐,测定得到的数据仅代表所观察的局部范围[25]。王秀荣等[26]用扫描电子显微镜测定脂肪乳颗粒的直径,而扫描电镜测定前还需要将样品进行固定、干燥及导电处理,费用高,耗时长。
2.3.2 库尔特计数法库尔特计数法又称电感应法,通过测量电流变化测定电解质中粒子的大小和个数[27]。根据库尔特原理,悬浮在电解液中的微粒随电解液通过小孔管时,会产生1个电压脉冲。在一定范围内脉冲的峰值正比于微粒的体积,脉冲的个数正比于微粒的数量,所以库尔特威力计数仪能对单个流过孔口的微粒进行测量,精确统计出所测微粒的个数,实现真正意义上的计数统计,而不像光散射法那样是通过测量相关的物理参数来换算成微粒的粒度分布。其测量结果除粒度分布外,还能同时得到所测微粒的总数[28]。耿志旺等[29]应用库尔特计数法测定丙泊酚脂肪乳注射液的乳粒大小和分布。库尔特计数法是一种对粒子逐个检测的方法,曾被英国药典收录用于注射液微粒限度的检测[30],由于当脂肪乳体系中粒子浓度大时,会出现2个或多个粒子同时流过孔口及重合现象[31],此时,测得的粒度偏大。所以用库尔特法测定时,粒子浓度需较低。但对于脂肪乳这个特殊的体系,稀释时可能带来新的问题。脂肪乳剂属于热力学不稳定体系,其中乳化剂和助乳化剂在水相、油相以及油水界面的分配,在维持体系动力学稳定中发挥重要作用[32]。当体系被稀释时,水相中乳化剂和助乳化剂浓度降低,它们从油水界面以及油相中进入到水相以达到新的平衡。当稀释至一定程度时,乳化剂和助乳化剂在油水界面分布不足,乳粒就会不稳定而团聚,此时,测定的粒径偏大。同时,需要强调的是,该方法测定时样品需要与电解质溶液混合,而加入的电解质本身就会影响乳粒稳定性[33],其结果容易造成假象。
2.3.3 激光散射法激光散射法包括动态光散射法(dynamic light scattering,DLS)和基于Mie氏光散射原理的经典光散射法,如激光衍射法(laser diffraction,LD)。在脂肪乳的稳定性评价研究中动态光散射法应用较多[34]。DLS原理是将粒子悬浮在某一溶剂中,一定波长的激光光线照射到粒子上,发生雷利散射,由于粒子在溶剂中做布朗运动,一定角度下的散射光强度将相对于某一平均值随机涨落。粒径越小,涨落越快,DLS技术就是通过这种涨落变化的快慢,测得乳粒的扩散系数,根据斯拓克斯-爱因斯坦公式,通过扩散系数计算粒子直径大小[35]。该方法快速简便,而且样品在一定的稀释度下粒径分布不受其组成及浓度的影响[36],是目前美国药典推荐的测定乳粒平均粒径的方法。然而,激光散射法技术并非完全适合于脂肪乳粒径分布评价。该方法对小粒径颗粒测定较为敏感,对直径>1 μm的粒子散射光强度的信号净变化值小,响应灵敏度低,使用现有的数学转换技术均不能提供可靠的结果。因此,该法不能对极端值(如脂肪乳大颗粒)作出明确的判断,这与检测原理有关[37-38]。
2.3.4 光阻法光阻法又称光障碍法或光遮法,其原理是利用光学系统将小功率的半导体激光进行准直聚焦,照射在一微小的探测区中,末端有光敏器件接收光强,当微粒随着透明液体进入探测区,经过光束时,会产生遮光效应,光敏器件接收的光强度发生变化,其变化量正比于微粒在光轴方向的投影面积,即光阻法检测的颗粒直径为等效投影面积相同的圆的直径[39]。光阻法具有操作简单、快速、灵敏,自动化及智能化程度高,取样体积准确等特点。但光阻法对于脂肪乳微粒的测定存在如下弊端:该法仅能检测到2~50 μm的微粒,而脂肪乳平均粒径在0.3 μm左右,不能测定乳粒平均粒径。由光阻法原理可知,其得到的是微粒的等效投影面积,当同一不规则的微粒多次经过探测区时,可能会被计为大小不同的微粒;当微粒重叠通过探测区时,导致高偏差,难以准确定量;并且,该法不适用于不透明液体溶液(如乳脂肪乳剂)微粒测定。如必须用该法对不透明液体进行测定,待测样品需要进行大比例稀释(1:1 000以上)[39],准确性无法保证。
2.3.5 光遮-单粒子光学传感技术光遮-单粒子光学传感技术(LO/SPOS技术)基于光遮法(光阻法),结合确保粒径在量程范围内的粒子逐个通过检测器(SPOS技术),对大粒径颗粒逐个进行检测并统计。其测定原理[40]232是液滴通过1个很小的光学传感区会阻挡部分入射光,造成消光检测器上光强度的瞬间降低,理论上信号强度降幅与液滴的横截面积成正比(假设液滴比感应区的厚度小),即与乳滴直径的平方成正比。该技术粒径测定范围为1.50~400 μm,而对乳剂中绝大部分的粒径小于0.5 μm脂滴没有响应。该技术的最大优势在于其测定微粒直接来自于对每一个脂滴的快速检测,对大乳粒的灵敏度高,能准确测量大乳粒的粒径与数目,能得到大乳粒真实的粒径分布。该技术需要将待测样品稀释到适当浓度以避免测量时乳粒在检测区重叠而产生误差和假象。该技术对PFAT5检测灵敏高,分辨率好,专属性强[41]。Koster[42]及Driscoll[37]分别通过对比LD技术和LO/SPOS技术评价市售脂肪乳制剂的稳定性及TNA中脂肪乳的稳定性。结果均证明LD法测定大粒径的灵敏度和准确性均不如LO/SPOS技术。但受仪器条件及脂肪乳研究技术难度的限制,国内目前仅有刘玉玲团队应用该技术对脂肪乳注射液大于5 μm的尾部大粒子进行控制[38, 41]。
3 TNA中维生素的稳定性评价技术维生素是TNA中最不稳定的一类化合物,其稳定性受所在环境的氧含量、pH、阳光、微量元素、温度等因素影响。所以在使用维生素配制输液时应进行光保护,或者在输液前再加入肠外复合维生素[43-44],避免维生素的损失量过多。目前,应用于TNA中维生素稳定性评价技术包括碘量法、分光光度法、色谱法及核磁共振法。
3.1 碘量法碘量法是一种氧化还原滴定的方法。Ribeiro等[45]用碘量滴定法测定TNA中维生素C的含量,并得出维生素C的稳定性易受光、环境温度及微量元素影响的结论。碘量法操作简单,但该法应用于TNA中维生素C的测定特异性不强,必须进行空白对照,因为TNA中除了维生素C,还有其他具有还原性的物质存在。例如葡萄糖分子含有醛基(—CHO)结构,具有还原性,同样可与碘发生氧化还原反应。而且,大量电解质存在的情况下,也会使该法灵敏度降低甚至失效。
3.2 分光光度法紫外分光光度法由于其专属性差,存在吸收峰常有重叠,不适于复杂体定性及定量测定,故限制了其在TNA中的应用。荧光分光光度法是利用物质吸收较短波长的光能后发射较长波长特征光谱的性质,对物质定性或定量分析的方法。该法灵敏度高(通常比紫外分光光度法高2~3个数量级),特异性好。Ribeiro等[45]用荧光分光光度法测定了TNA中维生素B2的含量(发射波长在400~700 nm范围内,激发波长为360 nm),黄德骧等[46]用荧光分光光度计测维生素A、维生素E浓度,用荧光法测定B1和B2浓度(发射波长分别为435 nm和510 nm,激发波长分别为365 nm和400 nm)。
3.3 色谱法与光谱法及质谱法的联合应用色谱法与光谱法及质谱法的联合应用形成了优势互补,将色谱对复杂样品的高分离能力,与光谱的特异性,质谱所具有高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点结合,在药物分析领域得到广泛的应用。在TNA稳定性研究中较多采用的是高效液相色谱(HPLC)联合紫外(UV)、荧光(SPF)及质谱(MS)等多种检测器来定量分析不同维生素的稳定性。Allwood、Ribeiro、Kearney等分别应用HPLC-UV评价TNA中维生素A、维生素E(检测波长分别为325nm和292nm)[43],维生素B1、维生素B6(检测波长分别为250 nm和295 nm)[45]和维生素C(检测波长为278 nm)的稳定性[8]。Dupertuis等[47]应用HPLC-SPF测维生素B1稳定性。Vazquez等[48]使用HPLC-UV-MS-MS法测定10种混合维生素,其中用UV测定维生素C和烟酰胺(检测波长为260 nm),维生素A、维生素B和维生素E(检测波长为292 nm),叶酸和维生素B2(检测波长为350 nm),用MS法测定硫胺素(维生素B1)、泛酸和生物素。
3.4 核磁共振波谱法核磁共振波谱法(nuclear magnetic resonance spectroscopy,NMR)用于定量分析的基础是各化学环境不同的粒子吸收峰的峰面积,它只与所包含的粒子数有关,因此其最大优点是不需要引进任何校正因子或绘制工作曲线,而且整个过程无需分离,操作简便,样品用量少。NMR可以用于多组分混合物分析、元素分析、有机物中活泼氢等的分析,通过平移扩散系数结合化学位移参数很好地反映结构变化,但NMR分析仪价格昂贵。Uccello-Barretta等[49]用NMR研究维生素尤其是水溶性维生素B1、B2、B6、烟酰胺在盐和微量元素存在时的稳定性。
4 TNA中氨基酸的稳定性及评价技术由于大多数氨基酸缺乏发色团,也不能产生荧光,直接的高效液相色谱法难以测定,故需对氨基酸进行衍生,为其连接上发色团或荧光基团,以提高氨基酸检测的灵敏度。目前应用于氨基酸含量测定的方法包括柱前衍生化法和柱后衍生化法。常见的衍生试剂有硫氢酸苯酯(PITC)、丹磺酰氯(DANSYL)、2,4-二硝基氟苯(DNFB)、茚三酮及邻苯二甲醛(OPA)。其中OPA由于本身不具有荧光,不干扰分离和检测,灵敏度高[50]被广泛应用于柱前和柱后衍生化。
柱前衍生化法由于受缓冲盐、衍生化时间及人工操作的影响,稳定性及重现性不佳[51]。目前,仅见Wade等[52]采用柱前衍生化后用反相高效液相色谱法紫外检测对TNA中的氨基酸进行分析。柱后衍生化法是依靠离子交换色谱柱分离游离氨基酸,然后进行柱后茚三酮衍生及紫外分光光度法测定的离子交换色谱法[40]399。该方法比较稳定,可分析大部分的氨基酸,市售氨基酸分析仪均采用此法。黄德骧等[46]用氨基酸自动分析仪测定TNA中17种氨基酸的浓度,并确定TNA中的氨基酸是稳定的。王棘等[51]分别用柱前衍生化法和氨基酸分析仪测定TNA中18种氨基酸的含量。实验结果表明TNA中氨基酸的测定首选氨基酸分析仪,该方法更适合氨基酸总量的测定。
5 TNA中水相沉淀评价技术沉淀是化学反应发生时生成了不溶于反应物所在溶液的物质,从液相中产生一个可分离的固相的过程。人体外周毛细血管直径一般为6~8 μm,如果输液中10 μm以上的沉淀过多,容易造成血管堵塞,有发生血栓性静脉炎的危险,严重的可能发生临床危害甚至死亡[6, 53]。根据测量原理不同,水相沉淀的测量方法分为光阻法及显微镜计数法[40]254。目前最适宜测量水相沉淀的方法为光阻法。
5.1 光阻法光阻法用于测量水相沉淀粒径和数量具有很高的灵敏度和分辨率。粒径范围可达1~250 μm,适用于中国药典及美国药典不溶性微粒的检测的范围。其测定原理见脂肪乳的光阻法技术。该技术是目前注射液中不溶性微粒检测较为先进的技术[40]254。由于光阻法原理是微粒阻挡减弱入射光传出信号,不澄明的液体会影响入射光传出信号,适用范围有一定局限性,光阻法不适用于不澄明的液体[55]。所以光阻法只能直接检测不加脂肪乳的TNA中的水相沉淀,加入脂肪乳的TNA中的水相沉淀的检测前必须用微粒检测用水进行稀释[56],但最终测定结果无法确定是沉淀还是脂肪大颗粒。美国药典(34版)和2015年版中国药典明确规定,在采用光阻法测定结果不符合规定或供试品不适用于光阻法测定时,应用显微镜进行复验,最终结果应以显微镜计数法的测定结果为准。
5.2 显微镜计数法显微镜计数法是用滤膜过滤后以显微镜和测微尺进行微粒大小的测量并计数的方法,可以反映单独的水相沉淀及其特征剖面图。美国药典(34版)指出当制剂不够澄清或是粘度过高时,比如乳胶剂、胶体剂、脂质体制剂应当采用显微镜计数法[40]254。MacKay等[57]把试样通过0.45 μm的硝酸纤维素滤膜过滤,用100倍显微镜观察水相沉淀。该法只抽取部分供试品进行检测,不能代表全部样本,所以不具有统计学意义。显微镜计数法操作烦琐,精密度不高,耗时长,以肉眼观察计数的误差极大,相比较光阻法,在样本大小和计数效率方面明显更优[58]。
6 包材与TNA相容性评价技术TNA的特殊性在于将多种药物混合在同一营养袋中,因此该营养袋的材质与TNA中各成分的相容性同样是确保TPN治疗安全的重要因素。目前已有多项研究证明以PVC为材质的营养袋与TNA存在诸多不相容:邻苯二甲酸二乙基乙酯(DEHP)是PVC输液袋中的增塑剂,其对人体有致癌、致畸及免疫抑制性,尤其是对人体生殖功能存在影响[59]。TNA中脂肪乳剂将增加DEHP的溶出[60],并且PVC包材会吸附TNA中蛋白制剂胰岛素、维生素A[61-62]。其中,DEHP的溶出及维生素A的吸附采用HPLC-UV方法,胰岛素的吸附采用电化学发光免疫分析法进行研究。包材与TNA相容性研究所采用的分析技术与研究TNA中各物质稳定性所采用的分析技术基本相同,即通过定量分析技术来确定目标物质的含量变化。但其实验设计更需强调对照组的设立与设计。如果未设立阴性对照,其结论并不能说明是由于药物与包装材料的相互作用导致药物含量降低,还是药物本身不稳定或在特定溶剂中不稳定造成。由于玻璃瓶的性质稳定,吸附性极小,故在同等条件下推荐以玻璃材质为对照,可判别药物含量下降是化学降解还是吸附损伤。如果以自身0 h作为其研究吸附性的参考点,即假设药物刚放入输液瓶混匀时并无吸附,可能存在过低评估包装材料对药物吸附率的风险。因为包装材料对药物有吸附,从一开始接触包装材料时就已开始,且开始时的吸附率可能更高。
7 非营养类药物与TNA混合相容性评价技术复杂疾病治疗实践中常有多种药物输入人体进行多方面治疗的需求。但由于人体可建立的通道有限,临床通常采用Y型管方式,利用同一通道将不同药物输注人体或是将药物混合后输注的方法进行治疗。为此,Bouchoud等[13]研究了25种常用治疗药物与商业TNA的物理相容性。结果显示20%血清白蛋白和托烷司琼与脂肪乳剂不相容,埃索美拉唑和泮托拉唑加入后混合液变色,高浓度的5-氟尿嘧啶降解析出沉淀。冯文周等[63]发现头孢唑啉、庆大霉素加入TNA后混合液pH变化较大,影响TNA中脂肪乳剂的稳定性,肉眼或镜下可见沉淀和不溶颗粒。
开展非营养类药物与TNA混合相容性评价研究,其结论的确定不仅要考虑该药物的稳定性,同时还需考虑该药物的加入对TNA中主要成分稳定性的影响。因此开展该类研究,首先需通过定量分析技术(如色谱、质谱、NMR等)来评价该药物加入TNA后,其含量经时变化。选择何种分析方法,视目标药物性质而定。如果结论为该药物混合后含量变化明显,此时可得出该药物不能与TNA混合的结论。但如果含量变化不明显,即该药物与TNA混合后较稳定,此时必须研究该药物加入后TNA中主要成分(脂肪乳、氨基酸、维生素等)稳定性经时变化,评价方法如上所述。否则结论存在假阴性风险。然而,由于实验室条件限制,目前该类研究均存在考察项目不全的缺陷。例如:Bouchoud等[13]采用目视检查、显微镜法、动态光散射法和光阻法观察25种治疗药物与TNA混合后1~4 h内的脂肪乳剂稳定性变化,判定TNA与药物物理相容性。在未开展各治疗药物加入TNA后自身稳定性变化的前提下,就得出20种药物与PN兼容稳定的结论。王晓东等[64]通过配伍液的外观性状、pH并采用高效液相色谱法测定头孢吡肟含量的经时变化,来考察盐酸头孢吡肟与全静脉营养液的配伍稳定性。该项研究在未对加入头孢吡肟后脂肪乳主要成分稳定性变化情况进研究的情况下,得出结论:头孢吡肟能够稳定地存在于全静脉营养液中,不会和全静脉营养液中的营养物质发生化学反应。
8 TNA稳定性及相容性评价现状及展望目前,国内外关于TNA稳定性及相容性研究仅停留在定性阶段。即研究报道仅能给出PN组方中各成分间是否存在稳定性相互影响,但影响程度及量效关系无法确定。虽有研究试图阐明该类科学问题,但其研究仅处于单一因素分析阶段,研究方法及考察项目均无法反映混合液整体情况,且研究对象均为特定组方条件,不具通用性及实用性[65-67],最终也仅能作为定性参考。尤其国内部分研究还存在仪器、方法选择不当等问题,有的研究使用注射液不溶性微粒的判别标准来评价脂肪乳的稳定性[68],也有报道仅凭肉眼观察外观变化来评价TNA的稳定性[69]。有的文献仅使用激光粒度分析仪(动态光散射法)检测脂肪乳粒径和分布情况,而得出脂肪乳稳定的结论[70]。然而,该方法对直径>1μm的粒子散射光强度的信号响应灵敏度低,使用现有的数学转换技术均不能提供可靠的结果,容易造成假阴性结论。TNA稳定性及相容性研究是保证PN疗法真正达到安全、有效、质量可控的基础,为确保PN治疗患者的用药安全合理,该项研究应当持续深入地开展。
| [1] |
DUDRICK SJ. History of parenteral nutrition[J]. J Am Coll Nutr, 2009, 28(3): 243. DOI:10.1080/07315724.2009.10719778 |
| [2] |
CHEUNG NW, NAPIER B, ZACCARIA C, et al. Hyperglycemia is associated with adverse outcomes in patients receiving total parenteral nutrition[J]. Diabetes Care, 2005, 28(10): 2367. DOI:10.2337/diacare.28.10.2367 |
| [3] |
OLVEIRA G, TAPIA MJ, OCÓN J, et al. Hypoglycemia in noncritically ill patients receiving total parenteral nutrition: A multicenter study[J]. Nutrition, 2015, 31: 58. DOI:10.1016/j.nut.2014.04.023 |
| [4] |
KLEIN CJ, STANEK GS, WILES CE 3RD. Overfeeding macronutrients to critically ill adults:metabolic complications[J]. J Am Diet Assoc, 1998, 98(7): 795. DOI:10.1016/S0002-8223(98)00179-5 |
| [5] |
IKEMA S, HORIKAWA R, NAKANO M, et al. Growth and metabolic disturbances in a patient with total parenteral nutrition: a case of hypercalciuric hypercalcemia[J]. Endocr J, 2000, 47(Suppl): S137. |
| [6] |
DRISCOLL DF. Stability and compatibility assessment techniques for total parenteral nutrition admixtures: setting the bar according to pharmacopeial standards[J]. Curr Opin Clin Nutr Metab Care, 2005, 8(8): 297. |
| [7] |
戴海韵. 药品稳定性在药品质量控制中的应用探析[J]. 科技创新导报, 2015, 14: 229. DAI HY. Drug stability analysis in the application of drug quality control[J]. Sci Technol Innov Her, 2015, 14: 229. DOI:10.3969/j.issn.1674-098X.2015.21.117 |
| [8] |
KEARNEY MC, ALLWOOD MC, MARTIN H, et al. The influence of amino acid source on the stability of ascorbic acid in TPN mixtures[J]. Nutrition, 1998, 14(2): 173. DOI:10.1016/S0899-9007(97)00430-9 |
| [9] |
马涛. 全合一混合液的稳定性[J]. 中国药房, 2000, 11(2): 88. MA T. Stability of all in one admixture[J]. China Pharm, 2000, 11(2): 88. |
| [10] |
黄义昆, 梁建成, 彭年秀, 等. 电解质对全合一中脂肪乳稳定性的影响[J]. 中国药房, 2002, 13(11): 696. HUANG YK, LIANG JC, PENG NX, et al. Effect of electrolytes on the stability of fat emulsion in all in one[J]. China Pharm, 2002, 13(11): 696. DOI:10.3969/j.issn.1001-0408.2002.11.029 |
| [11] |
JOY J, SILVESTRI AP, FRANKE R, et al. Calcium and phosphate compatibility in low-osmolarity parenteral nutrition admixtures intended for peripheral vein administration[J]. JPEN J Parenter Enteral Nutr, 2010, 34(1): 46. DOI:10.1177/0148607109338216 |
| [12] |
TÉLESSY IG, BALOGH J, TURMEZEI J, et al. Stability assessment of o/w parenteral nutrition emulsions in the presence of high glucose and calcium concentrations[J]. J Pharm Biomed Anal, 2011, 56(2): 159. DOI:10.1016/j.jpba.2011.05.002 |
| [13] |
BOUCHOUD L, FONZO-CHRISTE C, KLINGMÜLLER M, et al. Compatibility of intravenous medications with parenteral nutrition:in vitro evaluation[J]. JPEN, 2013, 37(3): 416. DOI:10.1177/0148607112464239 |
| [14] |
徐小薇, 杜小莉, 李大魁, 等. 3种不同材质输液容器对15种药物的吸着性实验[J]. 中国药学杂志, 2004, 39(3): 205. XU XW, DU XL, LI DK, et al. Study on sorption of fifteen injectable drugs in three different kinds of intravenous solution containers[J]. Chin Pharm J, 2004, 39(3): 205. |
| [15] |
韩华中, 杨俊. 含不同类型脂肪乳剂肠外营养液的稳定性及影响因素[J]. 肠外与肠内营养, 2013, 20(4): 246. HAN HZ, YANG J. The stability and influence factors of the total nutrient admixture containing different types of lipid emulsion[J]. J Parenter Enteral Nutr, 2013, 20(4): 246. |
| [16] |
van DEYK K, HEMPEL V, MÜNCH F, et al. Influence of parenteral fat administration on the pulmonary vascular system in man[J]. Intensive Care Med, 1983, 9(2): 73. DOI:10.1007/BF01699260 |
| [17] |
刘韬, 林子超, 陈倩超, 等. 混合糖电解质在全肠外营养液中的稳定性评价[J]. 中国医院药学杂志, 2010, 30(21): 1828. LIU T, LIN ZC, CHEN QC, et al. Evaluation on the stability of carbohydrate-electrolyte in the total parenteral nutrient solutions[J]. Chin Hosp Pharm J, 2010, 30(21): 1828. |
| [18] |
陈立亚, 于宝珠, 赵慧芳. Zeta电位及其在药学分散体系研究中的应用[J]. 药物分析杂志, 2006, 26(2): 281. CHEN LY, YU BZ, ZHAO HF. Zeta potential and its application in the study of pharmaceutical dispersion systems[J]. Chin J Pharm Anal, 2006, 26(2): 281. |
| [19] |
陈允发, 陆敏, 张兵. 依托咪酯脂肪乳注射液稳定性的研究[J]. 中国医药工业杂志, 2005, 36(5): 276. CHEN YF, LU M, ZHANG B. Stability of etomidate fat emulsion injection[J]. Chin J Pharm, 2005, 36(5): 276. |
| [20] |
WASHINGTON C, ATHERSUCH A, KYNOCH DJ. The electrokinetic properties of phospholipid stabilized fat emulsions. Ⅳ. The effect of glucose and of pH[J]. Int J Pharm, 1990, 64(2): 217. |
| [21] |
WASHINGTON C, CONNOUY MA, MANNING R, et al. The electrokinetic properties of phospholipid stabilized fat emulsions. Ⅴ. The effect of amino acids on emulsion stability[J]. Int J Pharm, 1991, 77(1): 57. DOI:10.1016/0378-5173(91)90301-4 |
| [22] |
WASHINGTON C, FERGUSON JA, IRWIN SE. Computation al prediction of the stability of lipid emulsions in total nutrient admixtures[J]. J Pharm Sci, 1993, 82(8): 808. DOI:10.1002/jps.2600820811 |
| [23] |
DRISCOLL DF. Lipid injectable emulsions: pharmacopeial and safty issues[J]. Pharm Res, 2006, 23(9): 1959. DOI:10.1007/s11095-006-9092-4 |
| [24] |
DRISCOLL DF, PEI-RA L, BRUCE RB. Pathological consequences to reticuloendothelial system organ following infusion of unstable allin-one mixture in rats[J]. Clin Nutr, 2006, 25(5): 842. DOI:10.1016/j.clnu.2006.02.009 |
| [25] |
郑越. 全肠外营养液临床配制稳定性的评价[J]. 中国药业, 2011, 24(20): 60. ZHENG Y. Evaluation of stability of clinical preparation of total parenteral nutrition solution[J]. China Pharm, 2011, 24(20): 60. DOI:10.3969/j.issn.1006-4931.2011.20.035 |
| [26] |
王秀荣, 蒋朱明, 张建明, 等. 应用扫描电镜研究脂肪乳剂在全营养混合液中的稳定性[J]. 中国临床营养杂志, 2003, 11(4): 271. WANG XR, JIANG ZM, ZHANG JM, et al. The stability of fat emulsion in total nutrient admixture(TNA)by electron scanning microscopy measurement[J]. Chin J Clin Nutr, 2003, 11(4): 271. |
| [27] |
GEORGE AJ, BRUCE E L, ALICE L A, et al. Combining particle size spectra from a mesocosm experiment measured using photographic and aperture impedance(Coulter and Elzone) techniques[J]. Deep-Sea Res Ⅱ Topic Stud Oceanogr, 1995, 42(1): 139. DOI:10.1016/0967-0645(95)00009-F |
| [28] |
谭立新, 余志明, 蔡一湘. 激光粒度法测试结果与库尔特法、沉降法的对比[J]. 中国粉体技术, 2009, 15(3): 61. TAN LX, YU ZM, CAI YX. Measurement results comparison between laser analyzer, coulter counter and pipette methods[J]. China Powder Sci Technol, 2009, 15(3): 61. |
| [29] |
耿志旺, 何兰, 张启明, 等. 丙泊酚脂肪乳注射液的乳粒检测方法[J]. 中国药学杂志, 2014, 49(4): 339. GENG ZW, HE L, ZHANG QM, et al. Determination of droplet size of propofol fat emulsion injection[J]. Chin Pharm J, 2014, 49(4): 339. |
| [30] |
BP 1993. Vol Ⅰ[S]. 1993: Appendix ⅩⅢ A163
|
| [31] |
蔡小舒, 苏明旭, 沈建琪. 颗粒粒度测量技术及应用[M]. 北京: 化学工业出版社, 2010, 166. CAI XS, SU MX, SHEN JQ. Technologies and Applications of Particles Detections[M]. Beijing: Chemical Industry Press, 2010, 166. |
| [32] |
THOMAS H. Phase structures of microemulsions[J]. Curr Opin Solid State Mater Sci, 2002, 7(1-2): 50. |
| [33] |
GONYON T, PATEL P, OWEN H, et al. Physicochemical stability of lipid injectable emulsions: correlating changes in large globule distributions with phase separation behavior[J]. Int J Pharm, 2007, 343(1-2): 208. DOI:10.1016/j.ijpharm.2007.05.038 |
| [34] |
付茂琦, 余祥彬, 王龙坤, 等. TC-1静脉脂肪乳剂的制备[J]. 中国现代应用药学, 2013, 30(12): 1271. FU MQ, YU XB, WANG LK, et al. Preparation of TC-1 intravenous fat emulsion[J]. Chin J Mod Appl Pharm, 2013, 30(12): 1271. |
| [35] |
潘伟祥, 刘洁, 何军, 等. 前列地尔注射液配伍试验中乳粒稳定性的探讨[J]. 中国新药杂志, 2013, 22(18): 2204. PAN WX, LIU J, HE J, et al. Stability measurement of alprostadil injection' s globule in a compatible experiment[J]. Chin J New Drugs, 2013, 22(18): 2204. |
| [36] |
王思玲, 孙长山, 王仁胜, 等. 激光散射法分析异丙酚纳米乳剂的粒径大小与分布[J]. 沈阳药科大学学报, 2003, 20(5): 336. WANG SL, SUN CS, WANG RS, et al. Analysis of the particle size and distribution of propofol nanoemulsion by the laser diffraction method[J]. J Shenyang Pharm Univ, 2003, 20(5): 336. |
| [37] |
DRISCOLL DF, ETZLER F, BARBER TA, et al. Physicochemical assessments of parenteral lipid emulsions-light obscuration versus laser diffraction[J]. Int J Pharm, 2001, 219(1-2): 21. DOI:10.1016/S0378-5173(01)00626-3 |
| [38] |
彭洁, 董武军, 李琳, 等. 静脉注射用脂肪乳尾部大颗粒测定的研究进展[J]. 药学学报, 2014, 49(7): 956. PENG J, DONG WJ, LI L, et al. Research progress of detecting large-diameter tail in lipid injectable emulsions[J]. Acta Pharm Sin, 2014, 49(7): 956. |
| [39] |
陈如柳, 曲丹丹, 付斌. 光阻法对注射液不溶性微粒检测的准确性影响因素探讨[J]. 天津药学, 2014, 26(5): 76. CHEN RL, QU DD, FU B. Factors affecting accuracy of lightblockage detection of insoluble particles in injections[J]. Tianjin Pharm, 2014, 26(5): 76. |
| [40] |
USP 34-NF 29[S]. 2013: 232, 254, 399
|
| [41] |
董武军, 李琳, 彭洁, 等. 基于单粒子光学传感技术的光阻法用于脂肪乳注射液大于5μm的尾部大粒子控制[J]. 药物分析杂志, 2014, 34(12): 2226. DONG WJ, LI L, PENG J, et al. Measurement of large globule ( > 5μm)content of lipid injectable emulsions by LE/SPOS method[J]. Chin J Pharm Anal, 2014, 34(12): 2226. |
| [42] |
KOSTER VS, KUKS PFM, LANGE R, et al. Particle size in parenteral fat emulsions, what are the true limitations[J]. Int J Pharm, 1996, 134(1-2): 234. |
| [43] |
ALLWOOD MC, MARTIN HJ. The photodegradation of vitamins A and E in parenteral nutrition mixtures during infusion[J]. Clin Nutr, 2000, 19(5): 339. DOI:10.1054/clnu.2000.0109 |
| [44] |
MIRTALLO J, CANADA T, JOHNSON D, et al. Safe practices for parenteral nutrition[J]. JPEN, 2004, 28(6): S39. DOI:10.1177/0148607104028006S39 |
| [45] |
RIBEIRO DO, PINTO DC, LIMA LMTR, et al. Chemical stability study of vitamins thiamine, riboflavin, pyridoxine and ascorbic acid in parenteral nutrition for neonatal use[J]. Nutr J, 2011, 10(1): 47. DOI:10.1186/1475-2891-10-47 |
| [46] |
黄德骧, 吴海福, 吴肇汉, 等. 全营养混合液中氨基酸和维生素的稳定性[J]. 中华外科杂志, 1995, 33(5): 269. HUANG DX, WU HF, WU ZH, et al. Stability of amino acids and vitamins in total nutrient admixture[J]. Chin J Surg, 1995, 33(5): 269. |
| [47] |
DUPERTUIS YM, MORCH A, FATHI M, et al. Physical characteristics of total parenteral nutrition bags significantly affect the stability of vitamins C and B1: A controlled prospective study[J]. JPEN, 2002, 26(5): 310. DOI:10.1177/0148607102026005310 |
| [48] |
VAZQUEZ R, ROTIVAL R, CALVEZ S, et al. Stability indicating assay method on vitamins: application to their stability study in parenteral nutrition admixtures[J]. Chromatographia, 2009, 69(7/8): 629. |
| [49] |
UCCELLO-BARRETTA G, BALZANO F, AIELLO F, et al. Stability of hydrophilic vitamins mixtures in the presence of electrolytes and trace elements for parenteral nutrition: a nuclear magnetic resonance spectroscopy investigation[J]. J Pharm Biomed Anal, 2015, 107: 7. DOI:10.1016/j.jpba.2014.12.008 |
| [50] |
张丽, 叶翠飞, 沈芊, 等. 高效液相荧光法测定大鼠脑内氨基酸类神经递质方法的改良[J]. 中国实验动物学报, 2015, 19(5): 377. ZHANG L, YE CF, SHEN Q, et al. Improvement of highperformance liquid chromatography with fluorescence detection to measure amino acid neurotransmitters in the rat brain[J]. Acta Lab Anim Sci Sin, 2015, 19(5): 377. |
| [51] |
王棘, 潘雪妍, 杨宏伟. HPLC法和氨基酸分析仪(AAA)法测定肠外营养注射液(25) 中18种氨基酸的含量的比较[J]. 药物分析杂志, 2012, 32(6): 1085. WANG J, PAN XY, YANG HW. Comparison of HPLC and amino acid analyzer methods in analyzing 18 different amino acids in total parenteral nutrition injection(25)[J]. Chin J Pharm Anal, 2012, 32(6): 1085. |
| [52] |
WADE CS, LAMPASONA V, MULLINS RE, et al. Stability of ceftazidine and animo acids in parenteral nutrient solutions[J]. Am J Hosp Pharm, 1991, 48(7): 1515. |
| [53] |
MCKINNON BT. FDA Safety alert: hazards of precipitation associated with parenteral nutrition[J]. Nutr Clin Pract, 1996, 11(2): 59. DOI:10.1177/011542659601100259 |
| [54] |
吕长淮, 吴玮, 胡丹. 光阻法检查注射液中不溶性微粒影响因素分析[J]. 中国医药导报, 2010, 7(26): 14. LÜ CH, WU W, HU D. Analysis of influencing factors in light blockage inspection of insoluble particles in injections[J]. China Med Her, 2010, 7(26): 14. DOI:10.3969/j.issn.1673-7210.2010.26.007 |
| [55] |
中国药典2015年版. 四部[S]. 2015: 114 ChP 2015. Vol Ⅳ[S]. 2015:114 |
| [56] |
杨晓军, 钟智, 陈赛红, 等. 葡萄糖和电解质对全肠外营养液中PH和微粒稳定性影响的观察[J]. 广东医学院学报, 2006, 24(2): 127. YANG XJ, ZHONG Z, CHEN SH, et al. Effects of glucose and electrolytes on the stability of pH value and micro-particles in the total parenteral nutrient solution[J]. Acad J Guangdong Coll Pharm, 2006, 24(2): 127. |
| [57] |
MACKAY M, ANDERSON C. Physical compatibility of sodium glycerophosphate and calcium gluconate in pediatric parenteral nutrition solutions[J]. JPEN, 2015, 39(6): 725. DOI:10.1177/0148607114528982 |
| [58] |
DRISCOLL DF. The significance of particle-sizing measurements in the safe use of intravenous fat emulsions[J]. J Disp Sci Technol, 2002, 23: 679. DOI:10.1081/DIS-120015371 |
| [59] |
曹国洲, 肖道清, 朱晓艳. 食品接触制品中邻苯二甲酸酯类增塑剂的风险评估[J]. 食品科学, 2010, 31(5): 325. CAO GZ, XIAO DQ, ZHU XY. Risk assessment of phthalate plasticizers in food contact products[J]. J Food Sci, 2010, 31(5): 325. |
| [60] |
KAMBIA K, DINE T, GRESSIER B, et al. High-performance liquid chromatographic method for the determination of di(2-ethylhexyl) phthalate in total parenteral nutrition and in plasma[J]. J Chromatogr B Biomed Sci Appl, 2001, 755(1-2): 297. DOI:10.1016/S0378-4347(01)00125-6 |
| [61] |
SEIFI A, MOWLA A, VAZIRI MM, et al. Insulin adsorbance to polyvinylchloride(pvc)surfaces of fluid container and infusion-set[J]. Middle East J Anaesthesiol, 2004, 17(5): 975. |
| [62] |
HAAS C, GENZEL-BOROVICZENY O, KOLETZKO B. Losses of vitamins A and E in parenteral nutrition suitable for premature infants[J]. Eur J Clin Nutr, 2002, 56(9): 906. DOI:10.1038/sj.ejcn.1601417 |
| [63] |
冯文周, 陈亚娜. 全肠外营养液中药物配伍禁忌的研究[J]. 广东药学, 2003, 13(4): 49. FENG WZ, CHEN YN. The combinational stability of different drugs in total nutrient admixture[J]. Guangdong Pharm J, 2003, 13(4): 49. |
| [64] |
王晓东, 张文军. 盐酸头孢吡肟与全静脉营养液的配伍稳定性考察[J]. 中国药房, 2010, 21(26): 2460. WANG XD, ZHANG WJ. Study on compatible stability of cefepime dihydrochloride mixed with total parenteral nutrient[J]. China Pharm, 2010, 21(26): 2460. |
| [65] |
BOUCHOUD L, FONZO-CHRISTE C, SADEGHIPOUR F, et al. Maximizing calcium and phosphate content in neonatal parenteral nutrition solutions using organic calcium and phosphate salts[J]. JPEN, 2010, 34(5): 542. DOI:10.1177/0148607110374615 |
| [66] |
WATROBSKA-SWIETLIKOWSKA D, SZLAGATYS-SIDORKIEWICZ A, LUSZKIEWICZ K. Evaluation of physical stability of all in one parenteral admixtures for pediatric home care with high electrolytes concentrations[J]. Nutr Hosp, 2014, 31(1): 236. |
| [67] |
FOX LM, WILDER AG, FOUSHEE JA. Physical compatibility of various drugs with neonatal total parenteral nutrient solution during simulated Y-site administration[J]. Am J Health Syst Pharm, 2013, 70(6): 520. DOI:10.2146/ajhp110715 |
| [68] |
汤晟凌, 梁晓美, 谢雅清. 全胃肠外营养液的稳定性考察[J]. 中国药师, 2014, 17(7): 1149. TANG SL, LIANG XM, XIE YQ. Stability of total parenteral nutrition solutions[J]. China Pharm, 2014, 17(7): 1149. |
| [69] |
高哲, 赵青威, 杨志海, 等. 一份全肠外营养液的稳定性影响考察[J]. 药品评价, 2014, 11(12): 28. GAO Z, ZHAO QW, YANG ZH, et al. Stability assay of a total parenteral nutrition preparation[J]. Drug Eval, 2014, 11(12): 28. DOI:10.3969/j.issn.1672-2809.2014.12.005 |
| [70] |
邓树荣, 梁焕笑, 张柳红, 等. 新生儿肠外营养液稳定性及质量控制研究[J]. 中国医院药学杂志, 2015, 35(10): 957. DENG SR, LIANG HX, ZHANG LH, et al. Study on stability and quality control of neonatal parenteral nutrition[J]. Chin J Hosp Pharm, 2015, 35(10): 957. |
 2017, Vol. 37
2017, Vol. 37 
