理想的药物传递系统能够使药物从给药部位到达靶部位前维持足时、足量的药物浓度。在这些传递系统中,生物相容性好且可降解的微粒类载体如微球、微乳、纳米粒和脂肪乳得到了广泛的研究与应用,其在增加靶向性、减少其他部位副作用方面表现出一定的优越性[1-4]。眼部疾病治疗中,药物通过滴入方式给药常需通过角膜、结膜或房水等屏障才能进入眼内发挥药效。传统制剂在用药后流失较为严重,生物利用度不足5%。而以脂肪油为基质,磷脂膜包封的载药微粒体分散系在给药后可增加泪液膜铺展系数,延长药物与角膜的接触时间使眼内生物利用度得以改善[5-7]。脂肪乳可依靠静电吸附作用,促进药物在角膜、巩膜及结膜途径的渗透,协助药物以内吞方式进入眼内[8-9]。包封率和相分布等载药性能指标将直接影响到药物在眼球内不同组织的分布差异,是影响产业化生产的关键因素,也是作为脂肪乳滴眼剂产品质量评价中常用的重要指标。现仅有环丙沙星、环孢素A和二氟泼尼脂等眼用脂肪乳获美国FDA上市批准。
文献资料表明,载体基质、制备方法和药物性质对分散体系的载药性能均有影响[10-14]。本研究采用低温超高速离心法考察了以脂肪乳为载体的地塞米松滴眼液中水相、油相和油/水界面的药物分布情况,并在此基础上建立凝胶微柱离心法测定滴眼液中地塞米松药物的包封率,为眼用脂肪乳制剂质量检测标准建立提供依据。
1 仪器与试药NS 1001L高压均质机(G.E.A.Niro Soavi公司);Delsa Nano纳米粒度/ζ电位分析仪(贝克曼库尔特公司);Waters e2695高效液相色谱仪(Waters公司);Waters Sun Fire C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷;Waters公司);LXJ-IIB型飞鸽离心机(上海安亭科学仪器厂);Beckman Optima L-100XP超高速离心机(贝克曼库尔特公司);
大豆磷脂E200(批号139017,上海艾维特医药科技有限公司);注射用大豆油(批号20140801,江西益普生药业有限公司);普朗尼克F68(巴斯夫公司);地塞米松对照品(批号:100055-201103,中国食品药品检定研究院);地塞米松(NED 140507,天津天药药业股份有限公司);其他试剂为分析纯;SephadexG-50 Medium葡聚糖凝胶(Pharmacia公司);MD34MM透析袋(截留分子量3 000,上海金瑞生物科技有限公司)。地塞米松滴眼液为自制。
2 方法与结果 2.1 地塞米松滴眼液的制备将处方量的地塞米松、大豆磷脂,加入大豆油中混合均匀形成油相;将适量注射用水、甘油、F68混合均匀形成水相,(35±5)℃下将油相注入水相,8 000 r·min-1高速搅拌分散10 min,调节pH至6.5~8即得初乳,调节高压均质二级阀压力至20~30 MPa,一级阀50~60 MPa,高压处理10个循环,过0.22 μm微孔滤膜,通氮、密封,灌装于滴眼瓶,灭菌,即制成地塞米松滴眼液(含地塞米松约为1 mg·mL-1)。空白滴眼液的制备,除油相不加入药物外,其余同上。得到载药滴眼液与空白滴眼液,经Delsa Nano纳米粒度仪测定,粒径分布范围分别为(153.45±1.63)nm和(118.7±42.4)nm。
2.2 滴眼液中地塞米松的含量测定 2.2.1 色谱条件采用Waters Sun Fire C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-水(28:72)为流动相,流速为1.0 mL·min-1,检测波长240 nm,进样量20 μL。
2.2.2 系列对照品溶液精密称定地塞米松对照品10 mg于50 mL量瓶中,以甲醇溶解并定容至刻度,即得200 μg·mL-1的地塞米松储备液;分别精密移取储备液适量,以流动相配成质量浓度为5、10、30、50、100和200 μg·mL-1的系列溶液,即得。
2.2.3 供试品溶液的制备精密移取滴眼液0.5 mL置于10 mL量瓶中,以10倍量甲醇破乳并用流动相定容至刻度,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.4 空白对照溶液取空白滴眼液,按“2.2.3”项下方法操作,即得。
2.3 方法学考察 2.3.1 色谱行为分别取地塞米松对照品溶液、供试品溶液和空白对照溶液,按“2.2.1”方法进样,记录色谱图(见图 1)。该色谱条件下,地塞米松的保留时间约为27.89 min,辅料对主药的测定无干扰。
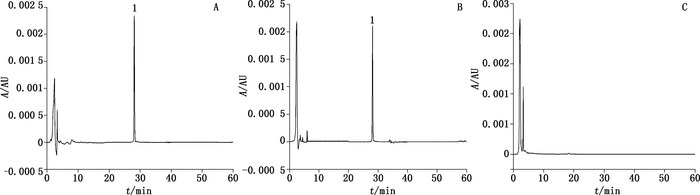
|
1.地塞米松(dexamethasone) 图 1 对照品(A)、滴眼液样品(B)和空白滴眼液(C)的色谱图 Figure 1 HPLC chromatograms of reference substance(A), eye drop sample(B)and blank control(C) |
精密量取质量浓度为5、10、30、50、100和200 μg·mL-1的系列对照品溶液进样,以质量浓度(C)对峰面积(A)作线性回归,得标准曲线方程:
| $A{\rm{ = 44 528}}C - {\rm{5 971}}{\rm{.5}}\quad r{\rm{ = 0}}{\rm{.999 9}}$ |
结果表明地塞米松质量浓度在5~200 μg·mL-1范围内,与峰面积呈良好线性关系。
2.3.3 仪器精密度试验取质量浓度为5、30、100 μg·mL-1的对照品溶液,分别于0、4、8、12、24 h进样测定,计算日内精密度;连续5 d每天进样1次,计算日间精密度。低、中、高浓度的日内精密度和日间精密度(RSD)均小于2%,符合测定要求。
2.3.4 回收率试验分别精密移取质量浓度为80、100、120 μg·mL-1的对照品溶液5 mL置于10 mL量瓶中,加入空白滴眼液0.5 mL,破乳并用流动相定容至刻度,摇匀,滤过,取续滤液按“2.2.1”项下色谱条件进样测定加样回收率。低、中、高3个浓度的加样回收率(n=3)分别为96.9%、102.0%和103.9%,RSD分别为1.1%、0.57%和1.1%。
2.3.5 重复性试验精密称取同一批地塞米松滴眼液样品(2015031473),平行制备供试品溶液6份,测得样品中地塞米松平均含量为(0.98±0.14)mg·mL-1,RSD为1.4%。
2.4 滴眼液中地塞米松在各相的分布取滴眼液20 mL,采用低温超高速离心法离心1 h(温度8 ℃、转速30 000 r·min-1),吸取离心管下层水溶液同条件继续离心3 h,取下层澄清液,流动相定容,经HPLC测定即为水相游离药物量;合并2次上层乳状液,同条件继续离心2 h后,取离心液上层油状物,按“2.2.3”项下方法制备供试品溶液,采用HPLC测定即为油相中分布的量,其中油水界面层的药物按油水界面层药物量=
采用凝胶微柱(0.8 cm×3 cm)离心法[14](2 500 r·min-1)测定50、100、300 μg·mL-1的对照品溶液的洗脱回收率,分别精密移取0.2 mL上柱,分别以水、50%乙醇在离心力2 500 r·min-1下洗脱2 min,收集洗脱液,共接取15管,每管0.2 mL,经HPLC测定4~14管为游离药物,收集游离药物部分以流动相稀释至20 mL,按“2.2.1”项下色谱条件进样测定地塞米松的量,求得低、中、高3个浓度的平均回收率(n=3)分别为96.3%、97.8%、101.4%,RSD分别为1.5%、1.1%和1.8%。
2.5.2 滴眼液洗脱回收试验取上述3种浓度的地塞米松对照品溶液,分别加入等体积的空白滴眼液,混合均匀后精密移取0.2 mL上柱,相同条件进行柱分离,收集4~14管的游离药物,测定地塞米松的量,求得平均加样回收率(n=3)分别为95.8%、98.2%、103.5%,RSD分别为0.9%、1.3%、1.8%。
2.5.3 包封率的测定采用凝胶微柱(0.8 cm×3 cm)离心法(2 500 r·min-1)分离地塞米松滴眼液,高效液相色谱法测定游离药物的含量。精密量取地塞米松滴眼液0.2 mL,2 500 r·min-1离心2 min,收集滤液;加入0.2 mL蒸馏水于凝胶柱顶端,同法连续洗脱3管,收集合并洗脱液;第4管起使用50%乙醇洗脱,连续洗脱10次,收集合并洗脱液。前3管洗脱液转移至5 mL量瓶中,以甲醇定容,HPLC法测得药物量为W1;将第4~14管洗脱液转移至5 mL量瓶中,以流动相定容,HPLC法测得药物量为W2。按洗脱曲线进行游离药物分离[12],将游离药物流份合并,按“2.2.1”项下色谱条件进样测定地塞米松游离药物的量,按E=
|
|
表 1 地塞米松滴眼液包封率测定结果 Table 1 The entrapment efficiency of dexamethasone eye drop |
已有文献资料表明[15-16],制备脂肪乳时,采用不同的乳化剂、不同的制备方法都会对药物的包封率产生影响。脂肪乳体系中存在水相、油相及磷脂界面层,根据药物理化性质的不同,可同时分布在上述的1种或几种结构中,而药物在脂肪乳中的相分布可间接说明包封率方法的准确性。试验前期[14](见表 2)曾采用透析法对地塞米松滴眼液中的药物包封率进行评价,参照相分布的结果分析,可知使用该法不能准确地分离出基质中由于磷脂过量形成胶束结构的药物量,实际测得的包封率为脂肪乳和胶束的总包封率,所得的结果值偏高。而采用常规葡聚糖凝胶柱色谱法[15]时,测定的包封率结果偏低,其原因可能是体系中地塞米松与磷脂之间的亲和力较弱有关,在制备过程中,药物虽被包载于乳滴之中,但当乳滴与大量水相接触时,由于磷脂与水的亲和力强,药物很快即从乳滴中释放出来,难以准确地分离未包封的游离药物,造成实测结果偏低。由上述相分布结果可知体系中各相存在密度差异,在离心力作用下依靠沉降速度能将游离药物有效分离,所建立的载药量测定方法既能避免凝胶柱法在分离过程中对脂肪乳破坏造成药物泄漏的发生,又能减少透析袋法导致的药物向水相扩散或分配,为脂肪乳滴眼液包封率的测定提供客观、可行的方法。
|
|
表 2 地塞米松滴眼液包封率测定结果(X±SD,n=3) Table 2 The entrapment efficiency of dexamethasone eye drop |
药物在体系中的分布及包封率直接影响滴眼后眼内组织器官的动力学过程。基于以上研究,本文建立了相分布和包封率测定方法,对眼用脂肪乳体系中地塞米松在各相分布的药物量进行测定,对以脂肪乳为载体的滴眼液载药性能的评价提供可靠、客观和准确的方法。同时,实验结果提示在处方优化研究中,可通过将药物先分散于脂质材料中再加入水相的方法减少药物在水中的溶解度,或油相中加入乳化剂改变药物在其中的溶解度来改变地塞米松向水相的扩散速度等制剂手段提高载药性能。
此外,对于磷脂膜包封的载药微粒体分散系,含量测定时需选择合适的破乳方法并将药物有效地提取出来。本文参考文献建立了脂肪乳滴眼液中药物的含量方法并进行验证,为脂肪乳给药系统的质量研究提供了科学、合理的依据。
| [1] |
DARIA N, SARHA C, CARLO G, et al. Nanotechnology approaches for antibacterial drug delivery:preparation and microbiological evaluation of fusogenic liposomes carrying fusidic acid[J]. Int J Antimicrob Agents, 2015, 45(6): 622. DOI:10.1016/j.ijantimicag.2015.01.016 |
| [2] |
AGARWAL R, IEZHITSA I, AGARWAL P, et al. Liposomes in topical ophthalmic drug delivery:an update[J]. Drug Deliv, 2016, 23(4): 1075. |
| [3] |
PAWAR VK, SINGH Y, MEHER JG, et al. Engineered nanocrystal technology:in-vivo fate, targeting and applications in drug delivery[J]. J Controlled Release, 2014, 183: 51. DOI:10.1016/j.jconrel.2014.03.030 |
| [4] |
杜有云, 班俊峰, 张彦, 等. 曲安奈德纳米滴眼液体外转运特性初评[J]. 中国医院药学杂志, 2016, 36(12): 968. DU YY, BAN JF, ZHANG Y, et al. Preliminary evaluation of in vitro transportation characteristics of triamcinolone acetonide eyedrops[J]. Chin Hosp Pharm J, 2016, 36(12): 968. |
| [5] |
LI J, WU L, WU W, et al. A potential carrier based on liquid crystal nanoparticles for ophthalmic delivery of pilocarpine nitrate[J]. Int J Pharm, 2013, 455(1-2): 75. DOI:10.1016/j.ijpharm.2013.07.057 |
| [6] |
MOLOKHIA SA, THOMAS SC, GARFF KJ, et al. Anterior eye segment drug delivery systems:current treatments and future challenges[J]. J Ocul Pharmacol Ther, 2013, 29(2): 92. DOI:10.1089/jop.2012.0241 |
| [7] |
HSU KH, FENTZKE RC, CHAUHAN A. Feasibility of corneal drug delivery of cysteamine using vitamin E modified silicone hydrogel contact lenses[J]. Eur J Pharm Biopharm, 2013, 85(3 Pt A): 531. |
| [8] |
RODRIGUEZ-ALLER M, KAUFMNN B, GUILLAME D, et al. In vivo characterisation of a novel water-soluble cyclosporine A prodrug for the treatment of dry eye disease[J]. Eur J Pharm Biopharm, 2012, 80(3): 544. DOI:10.1016/j.ejpb.2011.11.017 |
| [9] |
JABLIN MS, DUBEY M, ZHEMENKOV M, et al. Influence of lipid membrane rigidity on properties of supporting polymer[J]. Biophys J, 2011, 101(1): 128. DOI:10.1016/j.bpj.2011.05.054 |
| [10] |
邓广汉, 班俊峰, 张彦, 等. 香豆素-6纳米荧光探针的制备及其眼部给药适应性评价[J]. 中国医药工业杂志, 2016, 47(3): 305. DENG GH, BAN JF, ZHANG Y, et al. Preparation and suitability evaluation of coumarin-6 nanoprobes for ophthalmic use[J]. Chin J Pharm, 2016, 47(3): 305. |
| [11] |
赵暖暖, 仵文英, 张抗怀, 等. HPLC法测定5_氟尿嘧啶纳米粒的药物包封率[J]. 药物分析杂志, 2014, 34(5): 939. ZHAO NN, WU WY, ZHANG KH, et al. HPLC determination of entrapment efficiency of 5-fluorouracil nanoparticles[J]. Chin J Pharm Anal, 2014, 34(5): 939. |
| [12] |
梁立, 苟小军, 郭晓强, 等. 橄榄苦苷脂质体包封率测定方法探讨[J]. 中国医院药学杂志, 2015, 35(14): 1286. LIANG L, GOU XJ, GUO XQ, et al. Investigation on encapsulation efficiency for oleuropean liposome[J]. Chin Hosp Pharm J, 2015, 35(14): 1286. |
| [13] |
陈颖翀, 李翔, 张婧, 等. 硫酸长春新碱脂质体含量测定及3种包封率测定方法的比较[J]. 中国药房, 2014, 25(37): 3504. CHEN YC, CHEN YC, ZHANG Q, et al. Content determination of vincristine sulphate liposomes and comparison of 3 methods for entrapment efficiency[J]. China Pharm, 2014, 25(37): 3504. DOI:10.6039/j.issn.1001-0408.2014.37.16 |
| [14] |
邓广汉. 壳聚糖修饰地塞米松脂肪乳滴眼液研究[D]. 广州: 广东药科大学, 2016 DENG GH. The Ocular Drug Delivery of Chitosan-coated Dexamethasone Lipid Emulsion[D]. Guangzhou:Guangdong Pharmaceutical University, 2016 |
| [15] |
YANG X, TRINH HM, AGRAHARI V, et al. Nanoparticlebased topical ophthalmic gel formulation for sustained release of hydrocortisone butyrate[J]. AAPS Pharm Sci Tech, 2016, 17(2): 294. DOI:10.1208/s12249-015-0354-5 |
| [16] |
HEMRAJ RAMEKE K, BALAJI JADHAV V, KULKAMI NS, et al. Preparation, evaluation and optimization of multiparticulate system of mebendazole for colon targeted drug delivery by using natural polysaccharides[J]. Adv Pharm Bull, 2015, 5(3): 361. DOI:10.15171/apb.2015.050 |
 2017, Vol. 37
2017, Vol. 37 
