2. 浙江省食品药品检验研究院, 杭州 310052
2. Zhejiang Institute for Food and Drug Control, Hangzhou 310052, China
克拉霉素缓释片为一类口服的大环内酯类抗生素,主要应用于上、下呼吸道感染,皮肤及软组织的轻中度感染,急性加重的慢性支气管炎[1-5]。其普通片剂收载于中国药典2015年版二部[6],规格为0.25 g,缓释片规格为0.5 g,质量标准收载于国家药监局标准[7-8]。国外药典如USP 39、EP 8.0和BP 2015均未收载该品种。克拉霉素缓释片为骨架型缓释片,其主要骨架材料为羟丙甲纤维素(hydroxypropyl methyl cellulose,简称HPMC)。HPMC在药物中具有延缓药物释放,延长药物作用时间,提高了生物利用度、有利于药物吸收等作用[9-11]。作为关键性辅料,HPMC在制剂中含量对该药品的释放度以及体内的释药过程起着十分重要的影响[12-15],故本文建立克拉霉素缓释片中HPMC的测定方法,并对不同企业的样品中每片HPMC含量与释放度进行可能的关联分析,以提示该辅料在工艺过程中关注点。
1 仪器与试药安捷伦公司Agilent 1260高效液相色谱仪,配置G1362A RID检测器。TOSOH公司TSK-Gel 3000色谱柱(300 mm×7.5 mm,10 μm;填料:以球型硅胶键合亲水化合物);Distek公司4100 & 7100全自动溶出仪。梅特勒公司电子AE-163天平。
克拉霉素缓释片,规格为0.5 g,分别由A、B 2个企业生产,A企业批号分别为150522和141158,B企业批号分别为1503201和1504151。HPMC对照品由A企业提供,批号为4085457,纯度以100%计。
氯化钠为分析纯,试验用水为超纯水。
2 方法与结果 2.1 溶液的制备取HPMC对照品适量,精密称定,加50 mmol·L-1氯化钠溶液适量,在80 ℃水浴溶解后,放冷,定容,过滤后取续滤液作为对照品溶液(质量浓度约1 mg·mL-1)。取A企业样品1片置200 mL量瓶中,取B企业样品1片置50 mL量瓶中,分别加50 mmol·L-1氯化钠溶液适量,在80 ℃水浴溶解后,放冷,定容,过滤后取续滤液作为供试品溶液(质量浓度约1 mg·mL-1)。取50 mmol·L-1氯化钠溶液适量,在80 ℃水浴放置适时,放冷,定容,过滤后取续滤液作为空白溶液。
2.2 色谱条件采用TSK-Gel 3000色谱柱(300 mm×7.5 mm,10 μm),以50 mmol·L-1氯化钠溶液为流动相进行洗脱,流速0.7 mL·min-1,柱温30 ℃,检测温度30 ℃,进样量5 μL。在上述色谱条件下,色谱图见图 1。
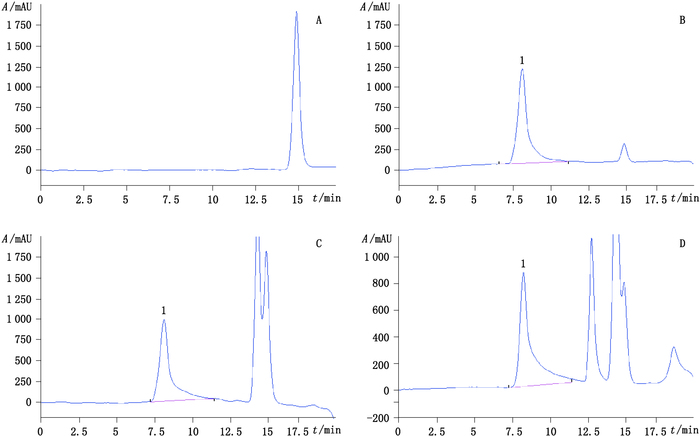
|
1. HPMC A.空白溶液(blank solution)B.对照品溶液(reference substance solution)C. A企业供试品溶液(sample solution of company A)D. B企业供试品溶液(sample solution of company B) 图 1 HPLC-RID典型色谱图 Figure 1 HPLC-RID chromatograms |
取HPMCHP MC对照品适量,精密称定,用50 mmol·L-1氯化钠溶液溶解并定量稀释成0.5、0.8、1.2、1.6、2.0 mg·mL-1的溶液,作为对照品线性溶液,以峰面积Y对其浓度X进行线性关系考察,回归方程:
| $Y = 13\;590X - 6.2612\quad {R^2} = 0.999\;9$ |
结果表明HPMC质量浓度在0.5~2.0 mg·mL-1范围内线性关系良好。
2.4 精密度试验取同一对照品溶液,在上述色谱条件下,连续进样6次,HPMC峰面积的RSD为1.1%,表明仪器精密度良好。
2.5 稳定性试验精密吸取同一对照品溶液、A企业和B企业的供试品溶液,分别于0、2、4、8、16和24 h,在上述色谱条件下进样分析,测得HPMC峰面积的RSD分别为0.8%、1.2%和0.9%,表明对照品和供试品溶液至少在24 h内稳定。
2.6 重复性试验由于每片中HPMC含量不一致,不宜采用测定每片含量作为重复性试验。故取基质较为复杂的A企业样品(批号150522)20片研细,取约1片重的细粉,精密称定,按“2.1”项下方法制成供试品溶液,在上述色谱条件下测定,样品中HPMC含量平均值为99.8%,RSD为1.3%,表明本法重复性良好。
2.7 加样回收率试验取基质较为复杂的A企业样品细粉约半片量(批号150522)共9份,精密称定,分别置200 mL量瓶中,精密加入HPMC对照品液50.0、100.0、150.0 mL,用50 mmol·L-1氯化钠溶液定容至刻度,混匀,制成低、中、高浓度的供试溶液各3份,在上述色谱条件下测定,计算加样回收率。结果HPMC见表 1。
|
|
表 1 加样回收率试验结果 Table 1 Results of recovery tests |
取对照品溶液1.0 mL,用50 mmol·L-1氯化钠溶液稀释至100 mL,测得检测限(S/N=3)为0.01 mg·mL-1;取对照品溶液4.0 mL,用50 mmol·L-1氯化钠溶液稀释至100 mL,测得定量限(S/N=11)为0.04 mg·mL-1。
2.9 样品测定取4批样品的供试品溶液,按上述方法进行测定10片药品中每片HPMC含量。A企业处方标示量为165 mg·片-1,B企业处方标示量为50 mg·片-1,样品测定结果均以每片处方标示量的百分比计,测定结果见表 2。
|
|
表 2 每片药品中HPMC含量(%) Table 2 Contents of HPMC in each tablet |
按法定质量标准[5-6]测定释放度,其中质量标准1采用桨法,0.1 mol·L-1醋酸盐缓冲液900 mL为释放介质,50 r·min-1,分别于2、8、20 h取样;质量标准2采用篮法,0.1 mol·L-1醋酸盐缓冲液900 mL为释放介质,100 r·min-1,分别于2、6、12 h取样。4批样品结果见表 3。
|
|
表 3 不同样品HPMC含量与释放度数据比较 Table 3 Comparison of contents and drug release data of HPMC in different samples |
由于释放度测定时间分别有3个时间点,第1个时间点溶出量较小,第3个时间点溶出量基本在溶出平台期,故选择最有代表性的第2个时间点的溶出量作为释放度批内稳定性的代表性指标进行比较。从2个厂家代表性数据可以看出,A企业10片样品中HPMC含量的RSD为2.8%时,释放度的RSD为2.5%;当HPMC含量的RSD扩大至6.2%时,其释放度的RSD也相应地升高至7.2%。
同时考虑对主成分和每片重量对释放度的影响,对上述4批样品的主成分含量和片重进行考察,其RSD均在2%以内(n=10),故推测释放度的不均一性可能来源于HPMC的不均匀。同样的情况也发生在B企业。故可以推测同一企业同一批次样品每片药品释放度的不均一性很可能来源于骨架材料HPMC在每片之间分布的不均匀所引起。由于缓释制剂体外释放的主要影响因素为骨架材料,而其他因素,如片剂硬度等亦可能会产生因素。
3 讨论药品质量控制主要项目为有关物质、溶出度(释放度)和含量测定等项目,而在药品制剂中对辅料,特别是关键性辅料的控制则较为缺乏。本文通过测定缓释片中的骨架材料含量分析其体外释放的差异,初步分析不同企业、不同批次间释放度差异的原因。本文亦曾经尝试采用近红外分光光度法(NIR)等无损定量方法测定每片HPMC的含量,然后对此片进行释放度研究。但由于HPMC在片剂处方量中所占比重较低,其他辅料和克拉霉素干扰较大,NIR方法定量准确性有待于完善等原因,未能建立较合适的无损定量方法。
释放度是药品质量一致性评价的主要内容,而如何保证批内释放度的均一性则是保证药品质量均一的关键,也是药品制剂过程中应重点解决的问题之一。对于缓释制剂关键辅料的研究往往在处方筛选优化阶段[16-17],通过不同比例的HPMC制成的药片和释放度进行研究。而对于上市产品中每片药物微量的HPMC差异对释放度的影响的研究则相对较少。本文通过对上市产品中HPMC含量的测定,重点提示了在制剂过程中应重点关注HPMC投料过程保证物料的充分混匀,其HPMC微量的差异也可能引起释放度的明显变化。
| [1] |
GUAY DR, GUSTAVSON LE, DEVCICH KJ, et al. Pharmacokinetics and tolerability of extended-release clarithromycin[J]. Clin Ther, 2001, 23(4): 566. DOI:10.1016/S0149-2918(01)80060-6 |
| [2] |
SOKOL WN, SULLIVAN JG, ACAMPORA MD, et al. A prospective, double-blind, multicenter study comparing clarithromycin extended-release with trovafloxacin in patients with community-acquired pneumonia[J]. Clin Ther, 2002, 24(4): 605. DOI:10.1016/S0149-2918(02)85136-0 |
| [3] |
GOTFRIED M, BUSMAN TA, NORRIS S, et al. Role for 5-day, once-daily extended-release clarithromycin in acute bacterial exacerbation of chronic bronchitis[J]. Curr Med Res Opin, 2007, 23(2): 459. DOI:10.1185/030079906X162827 |
| [4] |
KARDAS P. Comparison of patient compliance with once-daily and twice-daily antibiotic regimens in respiratory tract infections:results of a randomized tria[J]. J Antimicrob Chemother, 2007, 59(3): 531. DOI:10.1093/jac/dkl528 |
| [5] |
GOTFRIED MH, DATTANI D, RIFFER E, et al. A controlled, double-blind, multicenter study comparing clarithromycin extended-release tablets with levofloxacin tablets in the treatment of community-acquired pneumonia[J]. Clin Ther, 2002, 24(5): 737. |
| [6] |
中国药典2015年版. 二部[S]. 2015: 913 ChP 2015. Vol Ⅱ[S]. 2015:913 |
| [7] |
YBH17582005国家食品药品监督管理局标准[S]. 2005 YBH17582005 China Food and Drug Administration Drug Standards[S].2005 |
| [8] |
YBH25772005国家食品药品监督管理局标准[S]. 2005 YBH25772005 China Food and Drug Administration Drug Standards[S]. 2005 |
| [9] |
肖秋生, 蒋永培. 羟丙甲基纤维素控释、缓释骨架片研究进展[J]. 西北药学杂志, 2000, 15(3): 133. XIAO QS, JIANG YP. Progress on the controlled-release and sustained release matrix tablets of controlled hydroxypropyl methyl cellulose[J]. Northwest Pharm J, 2000, 15(3): 133. |
| [10] |
董志超, 蒋雪涛. 羟丙甲基纤维素在凝胶骨架中的含量与水溶性药物释放机制的关系[J]. 药学学报, 1996, 31(1): 43. DONG ZC, JIANG XT. Mechanism of soluble drug release from hydrophilic matrices, the effect of hydroxypropylmethylcellulose content[J]. Acta Pharm Sin, 1996, 31(1): 43. |
| [11] |
李洪奎, 李常春, 李蜀巍. 双氯芬酸钠缓释片人体体内外相关性研究[J]. 中国药房, 1997, 8(5): 203. LI HK, LI CC, LI SW. Study on the correlation between in vivo and in vitro of diclofenac sodium sustained-release tablet[J]. China Pharm, 1997, 8(5): 203. |
| [12] |
SIEPMANN J, PEPPAS NA. Modeling of drug release from delivery systems based on hydroxypropyl methylcellulose (HPMC)[J]. Adv Drug Deliver Rev, 2001, 48(2-3): 163. |
| [13] |
EBUBE NK, HIKAL AH, WYANDT CM, et al. Sustained release of acetaminophen from heterogeneous matrix tablets:influence of polymer ratio, polymer lodaing, and co-active on drug release[J]. Pharm Dev Technol, 1997, 2(2): 161. DOI:10.3109/10837459709022621 |
| [14] |
LIU CH, KAO YH, CHEN SC, et al. In-vitro and in-vivo studies of the diclofenac sodium controlled-release matrix tablets[J]. J Pharm Pharmacol, 1995, 47(5): 360. DOI:10.1111/jphp.1995.47.issue-5 |
| [15] |
QIU Y, HUI HW, CHESKIN H. Formulation development of sustained-release hydrophilic matrix tablets of zileuton[J]. Pharm Dev Technol, 1997, 2(3): 197. DOI:10.3109/10837459709031439 |
| [16] |
于素娟, 贺宝霞, 张文周, 等. 头孢克洛缓释片的制备与体外释放度考察[J]. 医药导报, 2016, 35(3): 296. YU SJ, HE BX, ZHANG WZ, et al. Cefaclor sustained release tablets's preparation and release rate in vitro[J]. Her Med, 2016, 35(3): 296. |
| [17] |
王艺晓, 邝文珍. 克拉霉素缓释片处方及制剂工艺研究[J]. 北方药学, 2015, 12(12): 90. WANG YX, KUANG WZ. Study on the prescription and preparation technology of clarithromycin sustained release tablets[J]. J North Pharm, 2015, 12(12): 90. |
 2017, Vol. 37
2017, Vol. 37 
