核磁共振技术最初主要用于有机化合物的结构确定,随着高强度磁场和傅里叶变换技术的应用,使得仪器的性能得到极大改善,从而为该技术应用于定量分析奠定了基础。目前,核磁共振定量法(quantitative nuclear magnetic resonance,qNMR)已经在药学及化学等领域得到了广泛的应用[1-2],中国、英国及美国等各国药典均已收载了qNMR。qNMR技术在药物分析中的应用可使药物质量控制及假冒伪劣产品的鉴别更为方便,在新药报批中的多个项目发挥着重要作用。
黄藤素(palmatine)又名巴马汀、掌叶防已碱,系从防已科植物黄藤Fibrurea recisa Pierre.根、茎提取的一种季铵型生物碱[3],结构见图 1。黄藤素质量标准收载于中国药典2015年版一部,其含量测定采用高效液相色谱法(HPLC法)。由于在提取黄藤素过程难免混杂有药根碱、小檗碱等多种成分[4],使用质量平衡法测定黄藤素含量时,需要HPLC法对杂质进行分离并测定样品纯度、水分含量、残留溶剂和炽灼残渣等等,不但消耗较多样品,且耗时费力。而qNMR法测定样品含量时不需对照品,不受样品中水分、残留溶剂等干扰,可大大缩短分析时间,定性检定和定量分析可同步完成,与HPLC法相比具有较大的优势[5]。本文采用内标法对黄藤素样品含量进行了测定,并进行了系统的方法学验证,以期为黄藤素原料药质量标准完善提供有价值的参考。
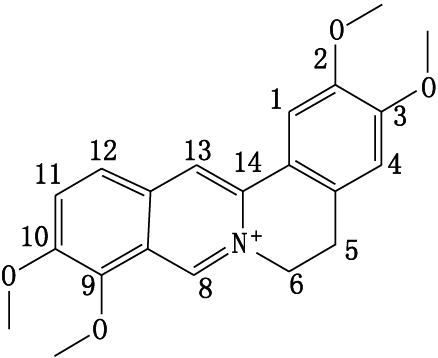
|
图 1 黄藤素结构式 Figure 1 The structure of palmatine |
Bruker-400型核磁共振仪(布鲁克公司);Topspin3.2试验控制及数据处理软件;Agilent 1260高效液相色谱仪(安捷伦公司);915KFTi-touch卡氏水分仪(万通公司);黄藤素(批号20160428,20160522,20160615,河南莱尔茵生物科技有限公司);分析天平(Sartorius公司);氘代二甲基亚砜(DMSO-d6,Sigma公司);马来酸对照品(批号190015-201302,中国食品药品检定研究院)。
2 方法与结果 2.1 溶液配制精密称取马来酸对照品22.71 mg,溶于10 mL DMSO-d6中,作为内标溶液;另称取黄藤素样品4.0 mg,精密称定,置于1.0 mL量瓶中,加入马来酸内标溶液溶解并稀释至刻度,混匀后,置于5 mm核磁管中,作为供试品溶液。
2.2 实验条件采用zg30脉冲序列,在恒温(300 K)下测试1H-NMR。实验参数设置:谱宽(SWH)8 012 Hz,中心频率(O1)2 471 Hz,点数(TD)64 K,采样时间(AT)4.0 s,脉冲宽度9.54 μs,弛豫延迟时间(D1)15 s,采样次数(NS)64次。
2.3 测定方法的建立 2.3.1 氘代溶剂的选择及黄藤素1H-NMR谱图的归属合适的氘代溶剂对样品溶解性能好,且谱峰不与待测峰发生重叠。氘代CDCl3易挥发,毒性较大。黄藤素及马来酸在DMSO-d6中均有较好的溶解性,且谱峰不与样品峰重叠,因而选用DMSO-d6作为溶剂。DMSO-d6空白实验的1H-NMR谱图,溶剂峰归属为:δ2.50(quintet,DMSO-d6峰),δ3.32(s,H2O)。黄藤素1H-NMR谱图及峰归属分别见图 2、表 1。
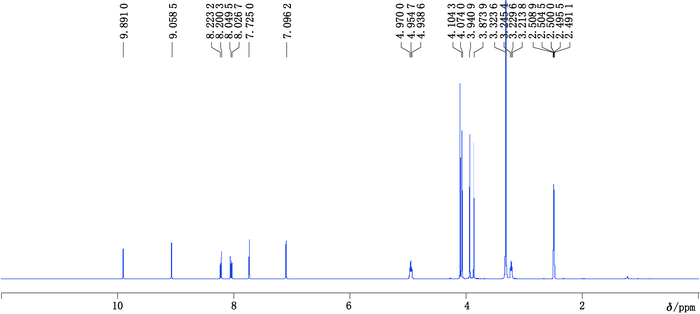
|
图 2 黄藤素的1H-NMR谱图 Figure 2 1H-NMR spectrum of palmatine |
|
|
表 1 黄藤素1H-NMR谱解析 Table 1 1H-NMR spectral data for palmatine and assignment |
内标物质最好具有易于识别的尖锐单峰,且不与样品峰发生重叠。本实验选用DMSO-d6作为溶剂,马来酸作为内标,马来酸与黄藤素混合物1H-NMR谱图见图 3。由图谱可知,马来酸溶剂峰归属为:δ6.26(s,DMSO-d6),不干扰黄藤素的谱峰,专属性较高。因此,选择马来酸作为内标。由于黄藤素δ7.10处是一独立尖锐的单峰,完全与其他信号分离,且与内标物的定量峰化学环境相近[6]。因此,选择黄藤素δ7.10处单峰信号作为定量峰。
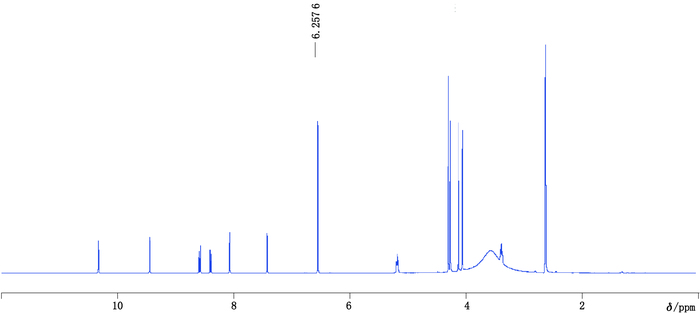
|
图 3 马来酸与黄藤素的1H-NMR谱图 Figure 3 1H-NMR spectrum of the mixture of maleic acid and palmatine |
精密称取黄藤素,采用内标溶液分别配制成质量浓度分别为0.94、1.43、2.83、4.32、7.39 mg·mL-1的系列溶液,混匀后,置于5 mm核磁管中。以黄藤素的δ7.10定量峰与马来酸δ6.26内标峰的峰面积比X(As /Ar)对黄藤素与马来酸质量比Y(ms /mr)作线性回归,得出回归方程:
| $Y = 3.782X + 0.072\quad r = 0.999\,9$ |
结果表明黄藤素质量浓度在0.94~7.39 mg·mL-1范围内线性关系良好。
2.3.4 仪器精密度试验取供试品溶液,按“2.2”项下条件连续测定6次,获取1H-NMR谱并积分,计算定量峰与内标峰峰面积的比值,结果其RSD=0.23%。
2.3.5 重复性试验按“2.1”项下方法平行制备供试品溶液6份,分别置于6支核磁管中。按照“2.2”项下条件进行测定,获取1H-NMR谱并积分,计算定量峰与内标峰的峰面积比值,结果其RSD=1.2%。
2.3.6 样品稳定性考察取供试品溶液,分别于0、2、4、8、12 h进行测定,获取1H-NMR谱并积分,并计算定量峰与内标峰的峰面积比值,结果其RSD为1.01%,表明供试品溶液在12 h内稳定。
2.3.7 qNMR测试结果及其与质量平衡法结果的比较精密称取3批黄藤素原料药,按“2.1”项下方法制备供试品溶液,按“2.2”项下条件测定,记录1H-NMR谱,以δ7.10处黄藤素峰信号和δ6.26处马来酸峰信号,按照如下公式计算黄藤素的含量:
| $含量 = \frac{{\left( {{A_{\rm{s}}}/{n_{\rm{s}}}} \right) \times {M_{\rm{s}}} \times {m_{\rm{r}}}}}{{\left( {{A_{\rm{r}}}/{n_{\rm{r}}}} \right) \times {M_{\rm{r}}} \times {m_{\rm{s}}}}} \times {W_{\rm{r}}} \times 100\% $ |
式中:As为黄藤素定量峰的积分面积;ns为黄藤素定量峰代表的氢个数;Ms为黄藤素分子量;Ar为马来酸定量峰的积分面积;nr为马来酸定量峰代表的氢个数;Mr为马来酸分子量;mr为马来酸质量;Wr为马来酸百分含量;ms为黄藤素质量。
经计算3批黄藤素含量分别为86.57%、86.94%和87.01%,RSD分别为0.49%、0.38%和0.36%。
采用HPLC面积归一化法测定黄藤素的含量为98.76%、98.83%和99.01%,干燥失重法测定样品含水量为11.93%、12.14%和11.85%,炽灼残渣结果为0.09%、0.09%和0.08%。根据质量平衡法计算[7],黄藤素含量=(100%-含水量-炽灼残渣量)×HPLC纯度,结果显示3批黄藤素含量分别为86.89%、86.74%和87.20%,基本与qNMR测试结果一致。
3 讨论 3.1 仪器参数的选择延迟时间(D1)是qNMR实验中非常重要的参数[7-10]。本实验分别考察了D1为1、5、10、15、20、30 s时对黄藤素定量峰的影响。研究结果表明,当D1>15 s时,As /Ar的比值趋于稳定,因此选择D1为15 s。扫描次数(NS)是qNMR另一个重要的参数。在D1设置为15 s前提下,分别对NS为16、32、48、64、80、128进行了考察。结果表明,当NS > 64时,As /Ar的比值趋于稳定。考虑到检测效率,NS设定为64。足够的采用时间(acquisition time,AT)可以使自由感应衰减(free induction decay,FID)信号能够衰减完全,从而得到基底没有震荡的1H-NMR谱图,提高分辨率[11-12]。在D1设置为15 s,NS设置为64的前提下,分别对AT进行了一系列考察。研究结果表明,当AT=4.0 s时可保证FID衰减完全。中心频率O1P应位于内标峰δ6.26及黄藤素δ7.10中间处,因此设置O1P为δ6.68,对应中心频率O1为2 672.9 Hz。
3.2 定量峰和内标峰的选择样品质子峰的偶合裂分对定量峰的积分会产生一定的影响。因此首选峰型简单且与其他峰完全分离,基线平坦的峰作为定量峰。由于弛豫机制的不同,导致不同类型的氢质子恢复Boltzmann平衡程度不尽相同,所以选择类型一致的氢质子可以保证积分结果的一致性和准确性[13]。马来酸内标峰属于烯键氢。由表 1可以看出,δ7.10、δ7.25、δ9.06和δ9.89处的质子峰峰型简单,且都是烯键氢,适合作为定量峰。定量峰与内标峰在近似的射频场内测定时可避免射频场差异导致的测量误差。因此,综合考虑,选择与内标峰δ6.26更接近的δ7.10质子峰作为定量峰,同时调整O1P位置,使之位于内标峰和样品定量峰中间位置。
3.3 1H-NMR图谱的积分处理对1H-NMR谱图进行积分处理时,首先对DMSO-d6的δ2.50的溶剂峰定标,然后仔细调整相位,以保证定量峰峰型左右对称,以减小积分误差,提高结果的准确性和重现性。
3.4 qNMR的优势采用qNMR技术测定黄藤素含量,与质量平衡法相比,无需对照品,测试过程简单,消耗的样品量很少,且结果可靠。可以作为质量平衡法的有效补充,也为黄藤素原料药、对照品及制剂含量测定提供有价值的参考。
| [1] |
HOLZGRABE U. Quantitative NMR spectroscopy in pharmaceutical applications[J]. Prog Nucl Magn Reson Spectrosc, 2010, 57(2): 229. DOI:10.1016/j.pnmrs.2010.05.001 |
| [2] |
PAULI GF, GODECKE T, DC JAKI BU, et al. Quantitative 1HNMR development and potential of an analytical method:an update[J]. J Nat Prod, 2012(75): 834. |
| [3] |
ZHOU X, LIN X, JIANG L, et al. Chondroprotective effects of palmatine on osteoarthritis in vivo and in vitro:a possible mechanism of inhibiting the Wnt/β-catenin and Hedgehog signaling pathways[J]. Int Immunopharmacol, 2016, 34(5): 129. |
| [4] |
ZHANG X, ZHANG S, YANG Q, et al. Simultaneous quantitative determination of 12 active components in Yuanhu Zhitong prescription by RP-HPLC coupled with photodiode array detection[J]. Pharmacogn Mag, 2015, 11(41): 61. DOI:10.4103/0973-1296.149705 |
| [5] |
HOLZGRABE U. Quantitative NMR spectroscopy in pharmaceutical applications[J]. Prog Nucl Magn Reson Spectrosc, 2010, 57(2): 229. DOI:10.1016/j.pnmrs.2010.05.001 |
| [6] |
PAULI GF, JAKI BU, LANKIN DC. A routine experimental protocol for qNMR illustrated with taxol[J]. J Nat Prod, 2007, 70(4): 589. DOI:10.1021/np060535r |
| [7] |
GONG H, HUANG T, YANG Y, et al. Purity determination and uncertainty evaluation of folic acid by mass balance method[J]. Talanta, 2012, 101(1): 96. |
| [8] |
ZOU PP, TU PF, JIANG Y. A simple and specific quantitative method for determination of dictamnine in Dictamni Cortex by 1H NMR spectroscopy[J]. Anal Methods, 2013, 5(4): 1062. DOI:10.1039/c2ay26226f |
| [9] |
MOURA S, CARVALHO FG, OLIVEIRA C, et al. qNMR:An applicable method for the determination of dimethyltryptamine in Ayahuasca, a psychoactive plant preparation[J]. Phytochem Lett, 2010, 3(2): 79. DOI:10.1016/j.phytol.2009.12.004 |
| [10] |
易进海, 刘云华, 陈燕, 等. 核磁共振波谱法测定藁本内酯对照品的含量[J]. 药物分析杂志, 2010, 30(4): 680. YI JH, LIU YH, CHEN Y, et al. Quantitative determination of ligustilide by 1H-nuclear magnetic resonance spectroscopy[J]. Chin J Pharm Anal, 2010, 30(4): 680. |
| [11] |
张琪, 李晓东, 杨化新. 核磁共振技术在药品标准领域中的应用进展[J]. 药物分析杂志, 2012, 32(3): 545. ZHANG Q, LI XD, YANG HX. Application of nuclear magnetic resonance in pharmaceutical standards[J]. Chin J Pharm Anal, 2012, 32: 545. |
| [12] |
LIU NQ, YOUNG HC, ROBERT V. Comparative quantitative analysis of artemisinin by chromatography and qNMR[J]. Phytochem Anal, 2010, 21(5): 451. DOI:10.1002/pca.1217 |
| [13] |
费昊, 崔峰, 唐飞, 等. 骨化三醇的核磁共振定量法测定[J]. 中国医药工业研究院, 2016, 47(6): 783. FEI H, CUI F, TANG F, et al. Determination of calcitriol by quantitative nuclear magnetic resonance[J]. Chin J Pharm, 2016, 47(6): 783. |
| [14] |
吴先富, 张琪, 马玲云, 等. 定量核磁共振法测定去水卫矛醇的含量[J]. 药物分析杂志, 2017, 37(1): 181. WU XF, ZHANG Q, MA LY, et al. Quantitative determination of dianhydrogalactitol by proton nuclear magnetic resonance[J]. Chin J Pharm Anal, 2017, 37: 181. |
| [15] |
LI CY, TSAI SI, DAMU AG, et al. A rapid and simple determination of protoberberine alkaloids in Rhizoma Coptidis by 1H NMR and its application for quality control of commercial prescriptions[J]. J Pharm Biomed Anal, 2009, 49(5): 1272. DOI:10.1016/j.jpba.2009.02.028 |
 2017, Vol. 37
2017, Vol. 37 
