蜈蚣为蜈蚣科动物少棘巨蜈蚣Scolopendra subspinipes mutilans L.Koch的干燥体,具有息风镇痉,通络止痛,攻毒散结之功效,用于肝风内动,痉挛抽搐,小儿惊风,中风口,半身不遂,破伤风,风湿顽痹,偏正头痛,疮疡,瘰疬,蛇虫咬伤[1];主产于浙江、湖北、江苏、安徽、河南等地[2]。蜈蚣主要含组织胺样物质及溶血性蛋白质,此外尚含氨基酸、脂肪酸、胆固醇及微量元素[3, 4]。现代药理研究表明,蜈蚣在抗肿瘤,抗凝血,抗炎镇痛,防治心血管系统疾病等方面具有较好的作用[5-9]。
中国药典2015年版一部中蜈蚣的质量控制中仅有性状、水分、总灰分、黄曲霉毒素、浸出物5项,缺乏专属性的薄层色谱鉴别和含量测定,蜈蚣药材的质量难以得到有效保证,其质量标准亟待提高与完善。目前国内外对蜈蚣药材的质量控制研究较少,仅有文献对蜈蚣中的氨基酸类[10]、组织胺类[11]、核苷及嘌呤类[12]成分进行测定,然上述诸类成分在多数动植物组织中广泛存在,用于质量控制其专属性不强。另有Moon、孙琳娜等[13-14]先后从蜈蚣中分离得到3,8-二羟基喹啉。本文作者亦从蜈蚣中分离得到多个喹啉类化合物,其中以3,8-二羟基喹啉含量较高,且体外活性试验表明,该化合物具有良好的抗肿瘤活性[13-14]以及优异的抗低密度脂蛋白(LDL)氧化活性、抑制酰基辅酶A-胆固醇酰基转移酶(ACAT)活性和抗炎活性[15]。3,8-二羟基喹啉与蜈蚣的现代药理作用基本相符,因此本研究以其作为蜈蚣的指标性成分,建立蜈蚣药材的薄层色谱定性鉴别与含量测定方法,并测定了多批市售及不同产地的蜈蚣药材样品,结果准确,方法专属,可为进一步完善蜈蚣药材的质量标准提供参考。
1 仪器与试药安捷伦1100液相色谱仪(包括四元泵、DAD检测器、自动进样器、ChemStation工作站),美国Agilent公司;KQ-250DB型超声波清洗器,昆山市超声仪器有限公司;硅胶GF254薄层预制板,青岛海洋化工厂;Kromasil C18(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶),天津特纳科学仪器有限公司。
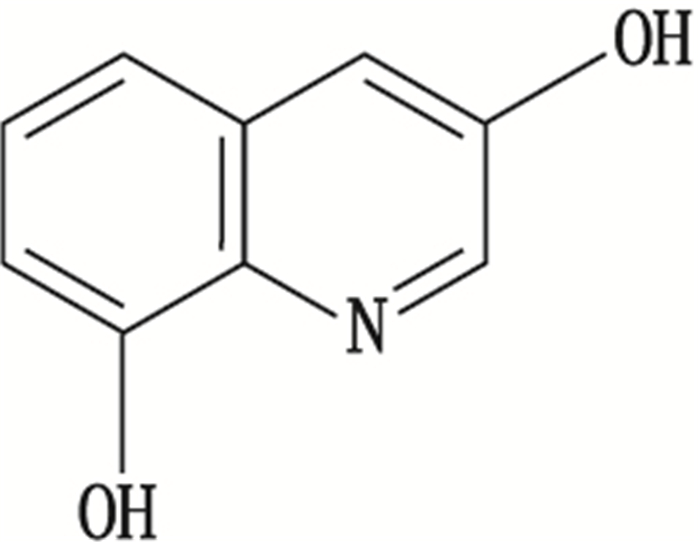
3,8-二羟基喹啉为实验室自制,经HPLC峰面积归一化法检查纯度为99.0%,可作为对照品使用,其结构式见图 1。乙腈、甲醇为色谱纯,磷酸二氢钾、乙酸乙酯为分析纯,水为双蒸水。蜈蚣药材共17批,分为市售11批(编号1~11)及产地采集6批(编号12~17),经鲁南制药集团闫光军高级工程师鉴定,均为蜈蚣科动物少棘巨蜈蚣Scolopendra subspinipes mutilans L. Koch的干燥体。
|
图 1 3,8-二羟基喹啉的结构式 Figure 1 Chemical structure of 3, 8-dihydroxy quinolone |
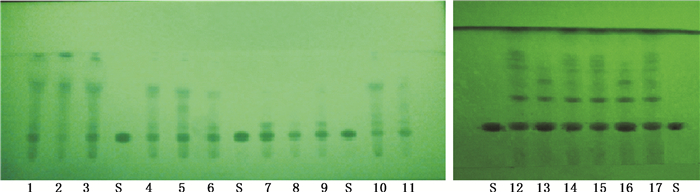
取蜈蚣粉末(过40目筛)1 g,置具塞锥形瓶中,加甲醇10 mL,超声(功率为250 W,频率为40 kHz)处理20 min,滤过,滤液蒸干,残渣加水10 mL使溶解,用乙酸乙酯10 mL振摇提取1次,分取乙酸乙酯液,蒸干,残渣加甲醇1 mL使溶解,即得供试品溶液;另取3,8-二羟基喹啉对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法试验,吸取上述2种溶液各5 μL,分别点于同一硅胶GF254薄层板上,以三氯甲烷-甲醇-甲酸(10:1:1)为展开剂展开,取出,晾干,置紫外光灯(254 nm)下检视。样品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。见图 2。
|
图 2 1~17号样品和3,8-二羟基喹啉对照品(S)的薄层色谱图 Figure 2 TLC chromatograms of samples No. 1-17 and reference substance of 3, 8-dihydroxyquinoline(S) |
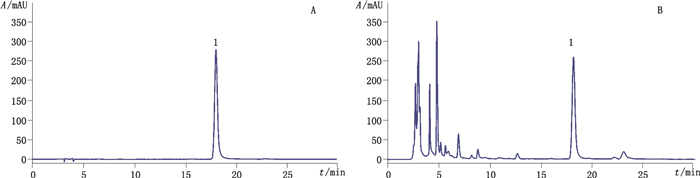
色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:甲醇-10 mmol·L-1的磷酸二氢钾溶液(32:68);流速:0.8 mL·min-1;检测波长:252 nm;柱温:40 ℃;进样量:5 μL。在上述色谱条件下,3,8-二羟基喹啉色谱峰达到基线分离,周围无干扰,对照品溶液和供试品溶液的色谱图见图 3。
|
1. 3,8-二羟基喹啉(3,8-dihydroxyquinoline) 图 3 对照品(A)和1号样品(B)HPLC色谱图 Figure 3 HPLC chromatograms of reference substance(A)and sample No. 1(B) |
取3,8-二羟基喹啉对照品适量,精密称定,加甲醇溶解制成质量浓度为36.2 μg·mL-1的溶液,即得。
2.2.3 供试品溶液的制备取本品粉末(过40目筛)1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称量,超声(功率250 W,频率40 kHz)处理30 min,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.2.4 线性关系考察精密吸取“2.2.2”项下对照品溶液1、2、4、6、8 µL,依上述色谱条件,分别进样分析,记录峰面积。以对照品进样量X(μg)为横坐标,峰面积Y为纵坐标,绘制标准曲线,求得标准曲线的回归方程:
| $ Y{\rm{ = 7774}}{\rm{.301}}X-{\rm{44}}{\rm{.053}}\;r{\rm{ = 0}}{\rm{.999}}\;{\rm{4}} $ |
结果表明,3,8-二羟基喹啉进样量在0.036 2~0.289 6 μg范围内线性关系良好。
2.2.5 精密度试验精密吸取“2.2.2”项下对照品溶液5 μL,连续进样6次,测定峰面积,计算峰面积的RSD为0.56%,表明仪器精密度良好。
2.2.6 稳定性试验精密吸取同一供试品溶液,在上述色谱条件下,分别于制备后0、2、4、6、8 h进样测定,结果3,8-二羟基喹啉峰面积的RSD为0.78%,表明供试品溶液在8 h内基本稳定。
2.2.7 重复性试验分别取同一样品(编号1)各6份,按“2.2.3”项下方法制备供试品溶液,进行测定。计算3,8-二羟基喹啉含量的平均值为0.625 mg·g-1,其RSD为0.54%,表明该方法重复性良好。
2.2.8 加样回收率试验精密称取同一批已知含量的样品(编号1)0.5 g,共6份,分别精密加入“2.2.2”项下对照品溶液10 mL,按“2.2.3”项下方法制备供试溶液,进样测定,计算加样回收率和RSD,结果见表 1。
|
|
表 1 加样回收率试验结果 Table 1 Results of recovery test |
取不同编号的蜈蚣样品,平行2份,按“2.2.3”项下方法制备供试品溶液,进样测定,以外标法计算各样品中3,8-二羟基喹啉的含量,结果见表 2。
|
|
表 2 药材来源及含量分析结果 Table 2 Origin and quantitative analytical results of the medical material |
本文所用对照品从蜈蚣的乙酸乙酯萃取物中分离得到,为黄绿色粉末。该化合物结构式的确定是根据其质谱、核磁共振波谱数据推证而来,其中高分辨质谱给出分子式为C9H7NO2,162.055[M+H]+;1H-NMR(CD3OD,600 MHz)给出数据为δ8.46,δ7.40,δ7.27,δ7.11;13C-NMR(CD3OD,600 MHz)给出数据为δ151.75,δ151.59,δ140.90,δ133.36,δ130.45,δ127.66,δ116.50,δ115.94,δ107.70;并经与文献[13]比较,确证该化合物为3,8-二羟基喹啉。
3.2 提取条件的选择与优化本研究使用甲醇、50%甲醇分别提取蜈蚣药材,提取效率基本一致,由于3,8-二羟基喹啉在甲醇中较为稳定,故薄层色谱鉴别与含量测定的提取溶剂选用甲醇。蜈蚣药材经甲醇提取后,浓缩,点样,展开,得到的薄层色谱不清晰,杂质斑点较多,干扰3,8-二羟基喹啉的分离。而将甲醇提取液蒸干后,水溶解,再用乙酸乙酯提取纯化,按照既定的色谱条件展开,得到的薄层色谱清晰,3,8-二羟基喹啉分离良好;另经考察,乙酸乙酯振摇提取1次,3,8-二羟基喹啉基本可提取完全。
3.3 色谱条件的选择 3.3.1 薄层色谱鉴别方法展开剂选择上,考察了三氯甲烷-甲醇、三氯甲烷-甲醇-甲酸、三氯甲烷-甲醇-三乙胺、正丙醇-冰醋酸、正丙醇-氨水等系统,结果以三氯甲烷-甲醇-甲酸系统展开效果最好。在不同温、湿度下,蜈蚣样品和对照品斑点清晰、无拖尾、颜色相同、Rf值适中,说明该方法结果理想、可靠,可作为蜈蚣药材的TLC鉴别方法。
3.3.2 含量测定方法流动相选择上,比较了乙腈-磷酸盐系统、甲醇-磷酸盐系统,结果在甲醇-磷酸盐系统中,3,8-二羟基喹啉峰形较好,且样品中3,8-二羟基喹啉峰均达到基线分离。检测波长选择上,对照品溶液在200~400 nm范围内经二极管阵列检测器扫描,结果3,8-二羟基喹啉在252 nm处有最大吸收,且该波长下色谱基线平稳,故选择252 nm作为检测波长。另外曾使用不同型号的色谱柱即Kromasil C18(250 mm×4.6 mm,5 μm;天津特纳科学仪器有限公司)、YMC-Pack ODS-AQ(250 mm×4.6 mm,5 μm;日本YMC公司)、Agilent Extend-C18(250 mm×4.6 mm,5 μm;美国Agilent公司)进行试验,结果基本一致,选择的Kromasil C18色谱柱能满足分离要求,3,8-二羟基喹啉的保留时间适中,峰形佳。
3.4 结果分析在17批蜈蚣样品中,仅有2号样品因贮存不当而发生霉变,测得其3,8-二羟基喹啉的含量亦较其他样品明显偏低,说明蜈蚣中的化学成分如3,8-二羟基喹啉,可能会因受到贮存环境的不良影响而发生明显变化;基于此,亦表明本研究所建立的高效液相含量测定方法可用于评价蜈蚣药材质量的优劣变化。同时,分析结果显示,产地采集的蜈蚣中3,8-二羟基喹啉含量稍高,而市场流通的蜈蚣成分含量稍低,推测蜈蚣药材的成分含量可能也与加工方法有关。
3.5 小结本文建立的蜈蚣药材薄层色谱定性鉴别方法和高效液相含量测定方法,方法专属,重复性良好,可用于蜈蚣药材的质量控制。作者曾发现市场流通的蜈蚣药材有掺伪现象,而中国药典现有的质量控制方法难以有效控制蜈蚣的质量,故本文作者经过大量的试验研究,建立了蜈蚣药材的定性定量方法,以弥补药典中蜈蚣质量控制方法的不足。
| [1] |
中国药典2015年版. 一部[S]. 2015: 357 ChP 2015. V ol Ⅰ[S]. 2015:357 |
| [2] |
陈武忠, 曹海燕. 中药蜈蚣的研究进展[J]. 中国现代中药, 2011, 13(7): 54. CHEN WZ, CAO HY. Research progress of traditional Chinese medicine centipede[J]. Mod Chin Med, 2011, 13(7): 54. |
| [3] |
苗明三. 现代实用中药质量控制技术[M]. 北京: 人民卫生出版社, 2000, 1055. MIAO MS. Modern Practical TCM Quality Control Technology[M]. Beijing: People's Medical Publishing House, 2000, 1055. |
| [4] |
王贤纯. 蜈蚣的药用研究进展[J]. 动物学杂志, 2002, 37(3): 88. WANG XC. A review on the medical application of centipede[J]. Chin J Zool, 2002, 37(3): 88. |
| [5] |
周永芹, 韩莉, 刘朝奇, 等. 蜈蚣提取物对小鼠宫颈肿瘤生长的影响及其作用机制的实验研究[J]. 中药材, 2011, 34(6): 859. ZHOU YQ, HAN L, LIU ZQ, et al. Effects of centipede extract on cervical tumor of mice and its mechanism[J]. J Chin Med Mater, 2011, 34(6): 859. |
| [6] |
姜建伟, 何福根, 章红燕. 中药蜈蚣抗肿瘤作用机制及临床应用研究进展[J]. 海峡药学, 2012, 24(9): 28. JIANG JW, HE FG, ZHANG HY. Research progress on the antitumor mechanism and clinical application of centipede[J]. Strait Pharm J, 2012, 24(9): 28. |
| [7] |
王丽娜, 何玲, 程卉, 等. 蜈蚣提取液对局灶性脑缺血再灌注大鼠血浆vWF和TPO的影响[J]. 中国实验方剂学杂志, 2012, 18(14): 192. WANG LN, HE L, CHENG H, et al. Effects of centipede extraction on vWF and TPO expression in blood plasm after focal cerebral ischemia-reperfusion injury in rats[J]. Chin J Exp Tradit Med Form, 2012, 18(14): 192. DOI:10.3969/j.issn.1005-9903.2012.14.055 |
| [8] |
刘瑞连, 廖建萍, 刘绍贵. 蜈蚣不同部位抗凝活性的研究[J]. 中医药导报, 2015, 21(2): 32. LIU RL, LIAO JP, LIU SG. Study on the anticoagulant of different extracts of centipede[J]. Guid J Tradit Chin Med Pharm, 2015, 21(2): 32. |
| [9] |
方秀桐, 莫可. 蜈蚣的药理研究进展[J]. 中国医药指南, 2015, 13(18): 32. FANG XT, MO K. Advances in the study on pharmacological effects of centipede[J]. Guide Chin Med, 2015, 13(18): 32. |
| [10] |
刘继红, 尚娟, 贾斌, 等. 蜈蚣、全蝎、地龙氨基酸含量测定[J]. 郑州大学学报(医学版), 2005, 40(3): 483. LIU JH, SHANG J, JIA B, et al. Detection of amino acid in centipede, whole scorpion, and earth worm[J]. J Zhengzhou Univ Med Sci, 2005, 40(3): 483. |
| [11] |
方红, 邓芳. 蜈蚣药材中毒性成分组织胺的含量测定[J]. 中草药, 1997, 28(8): 472. FANG H, DENG F. Determination of the contents of histamine in the toxic components of centipede[J]. Chin Tradit Herb Drugs, 1997, 28(8): 472. |
| [12] |
刘丽芳, 金蓉鸾, 徐国钧. HPLC法测定10种动物药中尿嘧啶、黄嘌呤、次黄嘌呤、脲苷的含量[J]. 中国中药杂志, 1999, 24(2): 73. LIU LF, JIN RL, XU GJ. HPLC determination of uracil, xanthine, hypoxanthine and uridine in ten species of animal drugs[J]. China J Chin Mater Med, 1999, 24(2): 73. |
| [13] |
MOON SS, CHO N, SHIN J, et al. Jineol, a cytotoxic alkaloid from the Centipede Scolopendra subspinipes[J]. J Nat Prod, 1996, 59(8): 777. |
| [14] |
孙琳娜. 蜈蚣中有效成分的研究[D]. 天津: 天津理工大学, 2015 SUN LN. Studies on the Effective Constituents of Scolopendra subspinipes[D]. Tianjin:Tianjin University of Technology, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10060-1015367174.htm |
| [15] |
朴镐用, 郑泰淑, 吴贤宇, 等. 预防和治疗心血管疾病的新型喹啉化合物, 以及含有蜈蚣提取物或从提取物中分离的化合物的组合物: 中国, 102670571 A[P]. 2012-09-19 PARK HY, JEONG TS, OH HW, et al. Quinoline Compound, and Composition Containing Centipede Extract or Compounds Isolated Therefrom for Prevention and Treatment of Cardiovascular Disease:China, 102670571 A[P]. 2012-09-19 |
 2017, Vol. 37
2017, Vol. 37 
