2. 广东天然药物研究与开发重点实验室, 湛江 524023;
3. 广东医学院附属医院药学部, 湛江 524023
2. Guangdong Key Laboratory for Research and Development of Natural Drugs, Guangdong Medical University, Zhanjiang 524023, China;
3. Dept. of Pharmacy, the First Affiliated Hospital of Guangdong Medical University, Zhanjiang 524023, China
洛伐他汀(lovastatin)作为羟甲基戊二酰单酰辅酶A(HMG-CoA)还原酶抑制剂,已普遍用于临床治疗高胆固醇血症。近年来的研究表明,他汀类药物除降血脂的作用外,还可抑制HMG-CoA向甲基二羟戊酸转变。甲基二羟戊酸在胞质内一系列酶催化下生成异戊烯焦磷酸、焦磷酸法尼酯、焦磷酸香叶酯等多种对细胞功能起重要作用的产物[1]。洛伐他汀可抑制肿瘤细胞焦磷酸法尼酯和焦磷酸香叶酯的合成,阻止关键信号传导蛋白Ras的法尼基化和Ras超家族小分子Rho GTPase的香叶酯化会影响它们作为信号传递分子在亚细胞的定位和功能,从而影响其细胞周期的进展[2-3]和细胞侵袭转移的相关能力[4-5]。项目组前期工作发现,洛伐他汀可有效抑制人高转移卵巢癌HO-8910PM细胞的侵袭、趋化运动和粘附能力,阻滞细胞于G0/G1期,使G2/M期、S期的细胞明显减少,从而有效抑制癌细胞的体外增殖,且呈剂量和时间依赖性,提示洛伐他汀可作为潜在的抗肿瘤转移药物[6-7]。为进一步阐明洛伐他汀的作用机制,本研究进一步探讨洛伐他汀对人高转移卵巢癌HO-8910PM细胞的抑制作用与Ras/NF-κB信号通路的关系。
1 材料与方法 1.1 主要实验材料与试剂HO-8910PM细胞株购自上海细胞生物所;洛伐他汀(Sigma公司;实验前用DMSO溶解,RPMI-1640培养液(Gibco公司)稀释,DMSO终体积浓度为0.1%(实验证明该体积浓度对细胞无影响),洛伐他汀浓度分别为4、8、16、32 µmol·L-1);小牛血清(杭州四季青工程有限公司);Plasma Membrane Protein Extraction Kit(Biovision公司);ECL试剂、ERK2兔IgG多抗、NF-κB小鼠IgG单抗、ⅠκB-α兔IgG多抗、VEGF兔IgG多抗(Santa Cruz公司);Ras小鼠IgG单抗(Oncogene公司);HIF-1α兔IgG多抗(博士德公司);辣根过氧化物酶标记山羊抗兔和抗小鼠IgG、辣根过氧化物酶标记兔抗山羊IgG(北京中杉公司);100 bp DNA marker(Takara公司);琼脂糖(Biowest公司);RT-PCR试剂盒(Qiagen公司);Trizol(上海生工生物工程技术公司);Propidium Iodide、RNase A、NP-40(上海华舜生物工程有限公司);[γ-32P]ATP(北京福瑞生物工程公司)。
1.2 细胞培养HO-8910PM细胞培养于含10%小牛血清,100 U·mL-1青霉素和100 μg·mL-1链霉素的RPMI-1640完全培养基中,37 ℃、5%CO2饱和湿度孵箱培养。收集对数生长期细胞,调整细胞浓度至2×105 ·mL-1,分装于60 mm培养皿中,每皿5 mL。待细胞贴壁后根据前期实验结果[6],加入相应浓度的洛伐他汀溶液50 µL,空白组加入等量的PBS,37 ℃、5%CO2饱和湿度培养箱培养48 h。
1.3 RT-PCRTrizol试剂盒提取细胞总RNA,之后逆转录合成cDNA。由上海生物工程有限公司设计并合成PCR扩增引物。VEGF:F 5’-CGAAACCATGAACTTTCTGCTGTC-3’,R 5’-TCACCTCCT-CGGGCTTGTCACAT-3’,扩增片段452 bp;K-Ras:F 5’-CAAATCACATTTATTTCCTAC-CAG-3’,R 5’-ACTGAATATAAACTTGTGGTA-GTTGG-3’,扩增片段356 bp;HIF1α:F 5’-AAACCACCTATGACCTGC-3’,R 5’-GTCGTGCTGAATAATACCACTC-3’,扩增片段408 bp;RhoA:F 5’-CTGGTGATTGTTGGTGA TGG-3’,R 5’-GCGATCATAATCTTCCTGCC -3’,扩增片段183 bp;NF-κB(P65):F 5’-TCAATGGCT ACACAGGACCA-3’,R 5’-CACTG-TCACCTGGAA GCAGA-3’,扩增片段307 bp;GAPDH:F 5’-ACCAC AGTCCATGCCAT-CAC-3’,R 5’-TCCACCACCCTG TTGCTGTA-3’,扩增片段452 BP;GAPDH:F 5’-ACG-GATTTGGTCGTATTGGG-3’,R 5’-TGATTTTG GAGGGATCTCGC-3’,扩增片段231 BP。反应条件:95 ℃,15 min;重复(94 ℃ 0.5 min、48~58 ℃ 1 min、72 ℃ 1 min)35个循环,72 ℃,延伸10 min。产物进行电泳分析,紫外透射仪观察结果并拍照。相片经扫描仪扫描后,用图像分析软件Bandscand进行光密度积分值分析,计算出VEGF、K-Ras、HIF-1α、RhoA、NF-κB(P65)分别与内参照GAPDH的光密度积分值之比作为它们的相对含量值。
1.4 Western Blot收集细胞,冰PBS洗2次,1×107个细胞加入100 µL预冷至0 ℃的NP-40细胞裂解液裂解,置于碎冰上间歇超声破碎(0.5 s/0.5 s,400 W,30 min),4 ℃、12 000×g离心15 min。将上清液,即细胞总蛋白。按Applygen公司的核-胞浆蛋白制备试剂盒说明书操作提取核蛋白和胞浆蛋白,按Biovision公司的Plasma membrane protein提取试剂盒提取膜蛋白。参照Bradford酶标板蛋白定量法[33]定量蛋白浓度。按试剂盒说明书及相关步骤,SDS-PAGE凝胶电泳分离蛋白,电转移至PVDF膜上,Western blot膜快速封闭液封闭20 min,电化学发光法(ECL法)显示结果,压片曝光,显影定影后扫描。图像经扫描仪扫描后,用图像分析软件Bandscan 4.5进行光密度积分值分析。以山羊多克隆抗体检测细胞骨架蛋白Actin,以保证上样的一致性。
1.5 统计学分析本实验数据资料用x±s表示,SAS 8.0评估版统计软件进行单因素方差分析。P < 0.05表示差异有显著意义,P < 0.01表示差异有非常显著意义。
2 结果 2.1 洛伐他汀对人高转移卵巢癌HO-8910PM细胞Ras、HIF-1α、NF-κB(p65)、RhoA、VEGF mRNA表达的影响不同浓度(4、8、16、32 µmol·L-1)的洛伐他汀溶液分别作用于HO-8910PM细胞48 h,用RT-PCR的方法检测Ras、NF-κB(p65)、VEGF、HIF-1α、RhoA mRNA表达水平的变化,图像经Bandscan软件进行光密度分析。结果表示:用4~32 µmol·L-1的洛伐他汀分别处理HO-8910PM细胞48 h,与内参照GAPDH比较,洛伐他汀可以使NF-κB(p65)、VEGF和RhoA mRNA的表达水平下降,其中以16 µmol·L-1和32 µmol·L-1组效果显著(P < 0.01),表明洛伐他汀可以抑制HO-8910PM细胞NF-κB(p65)、VEGF mRNA和RhoA的表达;而对K-Ras和HIF-1α mRNA的表达无明显影响(图 1)。
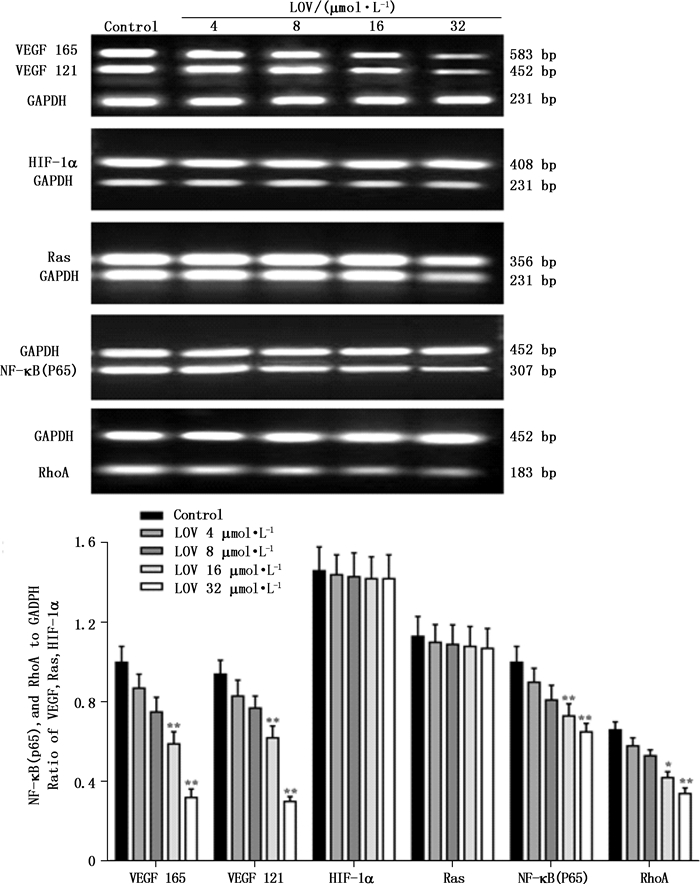
|
图 1 洛伐他汀处理HO-8910PM细胞48 h对Ras,HIF-1α,NF-κB(p65),RhoA and VEGF mRNA表达的影响(与对照组比较:*表示P < 0.05,**表示P < 0.01) Figure 1 Effects of lovastatin on the expression of Ras, HIF-1α, NF-κB(p65), RhoA and VEGF mRNA in HO-8910PM cells for 48 h(*P < 0.05, **P < 0.01 vs control group) |
如图 2所示,与对照组相比,洛伐他汀处理HO-8910PM细胞48 h后,Ras总蛋白的表达无明显变化;但Ras蛋白在胞浆和胞膜之间的分布却发生了明显改变,洛伐他汀16 µmol·L-1和32µmol·L-1组细胞胞浆中Ras蛋白水平明显高于对照组(P < 0.05,P < 0.01),而洛伐他汀16 µmol·L-1和32 µmol·L-1组细胞胞膜中Ras蛋白水平明显低于对照组(P < 0.01)。
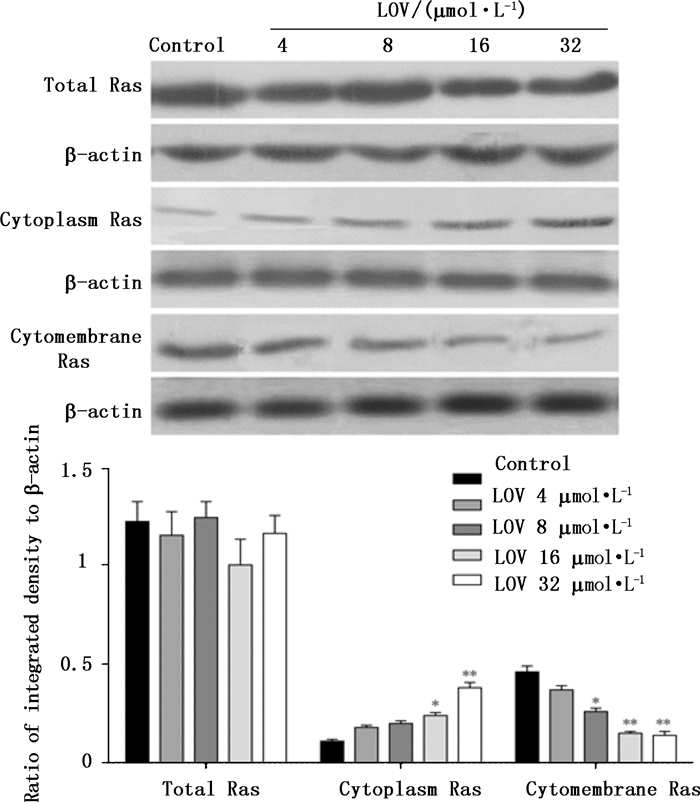
|
图 2 洛伐他汀处理细胞48 h对Ras蛋白水平的影响(与对照组比较:*表示P < 0.05,**表示P < 0.01) Figure 2 Effects of lovastatin on the expression of Ras proteins for 48 h(*P < 0.05, **P < 0.01 vs control group) |
不同浓度(4、8、16、32 µmol·L-1)的洛伐他汀溶液作用于HO-8910PM细胞48 h后,Western Blot检测发现,洛伐他汀可以使VEGF、HIF-1α和ERK2蛋白的表达减少,其中以16 µmol·L-1和32 µmol·L-1组效果显著(P < 0.01),表明洛伐他汀可以抑制HO-8910PM细胞内VEGF、HIF-1α和ERK2蛋白水平增高(图 3)。

|
图 3 洛伐他汀处理细胞48h对VEGF,HIF-1α和ERK2蛋白表达的影响(与对照组比较:*表示P < 0.05,**表示P < 0.01) Figure 3 Effects of lovastatin on the expression of VEGF, HIF-1α and ERK2 proteins for 48 h(*P < 0.05, **P < 0.01 vs control group) |
Blot检测胞浆及胞核内NF-κB(p65)和Ⅰ-κBα水平表明:HO-8910PM细胞p65亚基主要存在于胞核内,Ⅰ-κBα主要存在于胞浆中;16 µmol·L-1和32 µmol·L-1的洛伐他汀作用于HO-8910PM细胞48 h后,胞浆内p65蛋白明显高于对照组(P < 0.01),胞浆内Ⅰ-κBα水平明显低于对照组(P < 0.01),而胞核内p65蛋白明显低于对照组(P < 0.05,P < 0.01),胞核内Ⅰ-κBα水平明显高于对照组(P < 0.01)(图 4)。
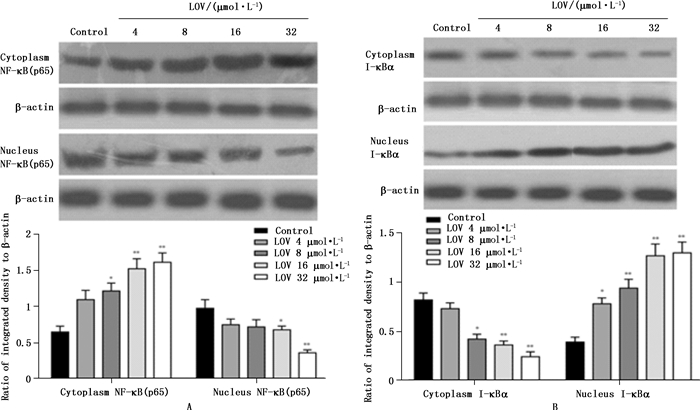
|
图 4 洛伐他汀处理细胞48 h对NF-κB(p65)(A)和Ⅰ-κBα(B)核转位的影响(与对照组比较:*表示P < 0.05,**表示P < 0.01) Figure 4 Effects of LOV on the nuclear translocation of NF-κB(p65)(A) and Ⅰ-κBα(B) in HO-8910PM cells(*P < 0.05, **P < 0.01 vs control group) |
卵巢癌是严重威胁女性生命健康的妇科恶性肿瘤之一,其致病机制是一个多因素参与的过程。虽然无法确定其确切病因,但目前的研究显示,K-Ras基因突变和慢性炎症过程是卵巢癌发生的早期事件之一[8-10]。突变Ras基因产生的Ras蛋白有极高的传导活性,而这种极高的传导活性在癌变的过程中起着关键作用,而抑制Ras及其下游信号可抑制细胞增殖和促进肿瘤细胞凋亡[11]。洛伐他汀已被发现具有阻断Ras蛋白的法尼基化和Ras超家族小分子Rho GTPase的香叶酯化,从而抑制肿瘤细胞侵袭转移的功能[1]。本研究进一步发现,洛伐他汀尽管对K-RAS的mRNA水平及总RAS蛋白的表达无影响,但其能显著可上调Ras蛋白在HO-8910PM细胞胞浆中的水平,而下调其在胞膜上的蛋白水平,即改变Ras在胞内的分布。同时也发现洛伐他汀下调了Ras信号通路的下游分子VEGF、ERK2、HIF-1α和RhoA等的蛋白表达。这提示了,洛伐他汀可能通过抑制Ras蛋白的法尼基化从而抑制Ras锚定于细胞膜上,使其不能发挥信号转导的生物功能,进而影响其下游分子的表达,抑制细胞增殖,诱导细胞凋亡。
NF-κB的激活及细胞凋亡、肿瘤细胞侵袭转移的关键因素,同时也是被Ras所激活的下游分子。有研究指出,当机体存在致癌性Ras时,炎症刺激可启动NF-κB信号通路参与的正反馈环路,最终导致Ras活性被放大,从而产生慢性炎症或演变成癌[12]。而NF-κB的激活也依赖于Ⅰ-κBα,NF-κB活化后迅速刺激大量Ⅰ-κBα重新合成。新合成的Ⅰ-κBα在核内与NF-κB结合使其自DNA上脱离,并通过Ⅰ-κBα末端富含亮氨酸的出核序列(nuclear export seqence,NES)与CRM1/ex2portinl蛋白(NES受体)识别,将NF-κB·Ⅰ-κBα复合物转运出核,由此构成一个精密的负反馈调控体系严格调控NF-κB活性[13-14]。本研究发现,洛伐他汀能明显阻断Ⅰ-κBα的出核过程,使Ⅰ-κBα在核内聚集,此过程随着洛伐他汀的浓度升高而逐渐增强。同时,洛伐他汀上调胞浆和下调核内的NF-κBp65蛋白表达,这种趋势同样呈现剂量依赖关系,这说明洛伐他汀同样能抑制NF-κB往核内转录的功能。因此,推测洛伐他汀能影响核膜脂质结构,损伤NES与CRM1/ex2portinl蛋白的功能活性,导致Ⅰ-κBα出核受抑,使核内NF-κB·Ⅰ-κBα复合物增多,从而抑制NF-κB诱导的靶基因转录,而起促凋亡的作用。这充分表明了洛伐他汀抑制人高转移卵巢癌HO-8910PM细胞增殖和诱导凋亡作用的分子机制与阻断Ras/NF-κB通路密切相关。
| [1] |
FENG C, HAN A, YE C, et al. The HMG-CoA reductase pathway, statins and angio-prevention[J]. Semin Ophthalmol, 2006, 21(1): 29. DOI:10.1080/08820530500509382 |
| [2] |
WANG IK, LIN-SHIAU SY, LIN JK. Suppression of invasion and MMP-9 expression in NIH 3T3 and v-H-Ras 3T3 fibroblasts by lovastatin through inhibition of ras isoprenylation[J]. Oncology, 2000, 59(3): 245. DOI:10.1159/000012168 |
| [3] |
van de DONK NW, LOKHORST HM, NIJHUIS EH, et al. Geranylgeranylated proteins are involved in the regulation of myeloma cell growth[J]. Clin Cancer Res, 2005, 11(2 Pt 1): 429. |
| [4] |
CAFFORIO P, DAMMACCO F, GERNONE A, et al. Statins activate the mitochondrial pathway of apoptosis in human lymphoblasts and myeloma cells[J]. Carcinogenesis, 2005, 26(5): 883. |
| [5] |
FARINA HG, BUBLIK DR, ALONSO DF, et al. Lovastatin alters cytoskeleton organization and inhibits experimental metastasis of mammary carcinoma cells[J]. Clin Exp Metastasis, 2002, 19(6): 551. DOI:10.1023/A:1020355621043 |
| [6] |
张建和, 符伟玉, 覃燕梅, 等. 洛伐他汀影响人高转移卵巢癌细胞系HO-8910PM转移相关能力的研究[J]. 广东医学院学报, 2008, 26(4): 373. ZHANG JH, FU WY, QIN YM, et al. Effect of lovastatin on metastasis-associated ability of highly metastatic ovarian carcinoma cell line HO-8910PM[J]. J Guangdong Med Coll, 2008, 26(4): 373. |
| [7] |
张建和, 符伟玉, 覃燕梅, 等. 洛伐他汀对高转移卵巢癌细胞HO-8910PM细胞周期和增殖的影响[J]. 实用癌症杂志, 2008, 23(3): 227. ZHANG JH, FU WY, QIN YM, et al. Effect of lovastatin on the cell cycle and proliferation of highly metastatic ovarian carcinoma HO-8910PM Cells[J]. Pract J Cancer, 2008, 23(3): 227. |
| [8] |
FAN HY, LIU ZL, LISA K, et al. Consequences of RAS and MAPK activation in the ovary:the good, the bad and the ugly[J]. Mol Cell Endocrinol, 2012, 356(1-2): 74. DOI:10.1016/j.mce.2011.12.005 |
| [9] |
CONIC I, DIMOV I, TASIC-DIMOV D, et al. Ovarian epithelial cancer stem cells[J]. Sci World J, 2011, 11: 1243. DOI:10.1100/tsw.2011.112 |
| [10] |
熊蕴珠, 黄建鸣, 张国楠. 卵巢癌相关细胞因子的过表达及其在肿瘤微环境中作用的研究进展[J]. 肿瘤预防与治疗, 2014, 27(1): 39. XIONG YZ, HUANG JM, ZHANG GN. Research progress in overexpression of ovarian cancer related cytokines and the change of tumor microenvironment[J]. J Cancer Control Treat, 2014, 27(1): 39. |
| [11] |
SHIMA F, MATSUMOTO S, YOSHIKAWA Y. Current status of the development of Ras inhibitors[J]. J Biochem, 2015, 158(2): 91. DOI:10.1093/jb/mvv060 |
| [12] |
DANILUK J, LIU Y, DENG D, et al. An NF-κB pathway-mediated positive feedback loop amplifies Ras activity to pathological levels in mice[J]. J Clin Invest, 2012, 122(4): 1519. DOI:10.1172/JCI59743 |
| [13] |
PISANTI S, PICARDI P, CIAGLIA E, et al. Novel prospects of statins as therapeutic agents in cancer[J]. Pharmacol Res, 2014, 88(2): 84. |
| [14] |
SHIBATA MA, KAVANAUGH C, SHIBATA E, et al. Comparative effects of lovastatin on mammary and prostate onco genesis in transgenic mouse models[J]. Carcinogenesis, 2003, 24(3): 453. DOI:10.1093/carcin/24.3.453 |
 2017, Vol. 37
2017, Vol. 37 
