舒肝丸由川楝子、白芍、延胡索、沉香等数味中药制成,具有舒肝和胃、理气止痛的功效,主要用于肝郁气滞、胸胁胀满、胃脘疼痛、嘈杂呕吐、嗳气泛酸等症的治疗[1];方中川楝子为君药,其中川楝素(toosendanin)是舒肝丸中药理活性较为明确的重要成分之一(结构式见图 1),中国药典2015年版记载其功能主治为疏肝泄热、行气止痛、杀虫。用于肝郁化火、胸胁、脘腹胀痛、疝气疼痛、虫积腹痛。据《本草纲目》记载该药性味苦寒,有小毒,并有酸味;入肝、胃、小肠经。药理作用研究显示川楝素药理作用广泛,驱蛔杀虫作用[2]、抗病毒作用尤为明显[3];同时,川楝素毒理研究表明川楝子单次灌服即可产生明显肝脏毒性,表现为血清酶学和肝脏组织病理形态学改变[4],川楝素对昆明小鼠具胚胎毒性[5],临床应用时应引起注意。
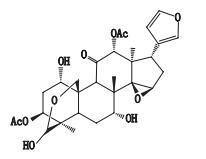
|
图 1 川楝素化学结构式 Figure 1 Chemical structure of toosendanin |
目前,关于川楝素的检测方法主要有高效液相色谱法[6-9],液相色谱质谱联用法等[10-12],中成药成分复杂,干扰多,采用高效液相色谱法或液相色谱一级质谱联用法难以准确测定其含量,由于超高效液相色谱-串联质谱法具有选择性高,专属性强,灵敏度高等特点,所以本文建立了超高效液相色谱-串联三重四极杆质谱测定舒肝丸中川楝素含量方法,为科学评价舒肝丸质量提供参考。
1 仪器与试药 1.1 仪器Waters公司ACQUITY UPLC®液相色谱仪;Waters公司XEVO TQ-S质谱仪,MasslynxV4.1分析软件;Waters公司Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm;填料:十八烷基硅烷键合硅胶);Millipore公司Milli-Q超纯水机;Mettler公司TOLEDO XS105电子分析天平。
1.2 试药甲醇、乙腈为色谱纯;川楝素对照品,中国食品药品检定研究院,批号111842-201102;舒肝丸,规格为大蜜丸,每丸重6 g,由生产单位提供。
2 方法与结果 2.1 色谱-质谱条件 2.1.1 色谱条件采用Waters Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),流动相为乙腈-0.01%甲酸水(36:64),流速0.35 mL·min-1,柱温35 ℃,进样量1 μL。
2.1.2 质谱条件电喷雾离子源(ESI)负离子模式,多反应监测(MRM);毛细管电压2.8 kV,使用高纯氮作为辅助喷雾电离与脱溶剂气体,脱溶剂气流速995 L·h-1,锥孔气体流速152 L·h-1,去溶剂气温度500 ℃;离子源温度150 ℃;碰撞气体氩气;采用多反应检测模式(MRM)定量模式,监测离子对分别为m/z(-)573.3→425.3;m/z(-)573.3→531.4;锥孔电压均为25 V,碰撞电压分别为25 V和20 V。川楝素质谱图见图 2,川楝素对照品及舒肝丸总离子流图见图 3-A、B,总离子流图见图 4。
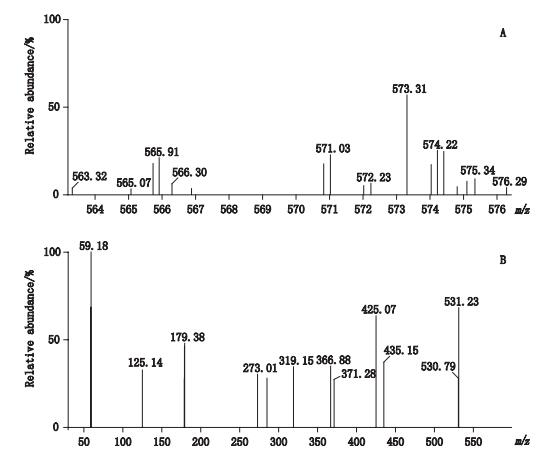
|
图 2 川楝素负离子模式扫描一级质谱(A)及二级质谱(B)图 Figure 2 MS spectrum(A)and MS/MS spectrum(B)of toosendanin at negative ion mode |
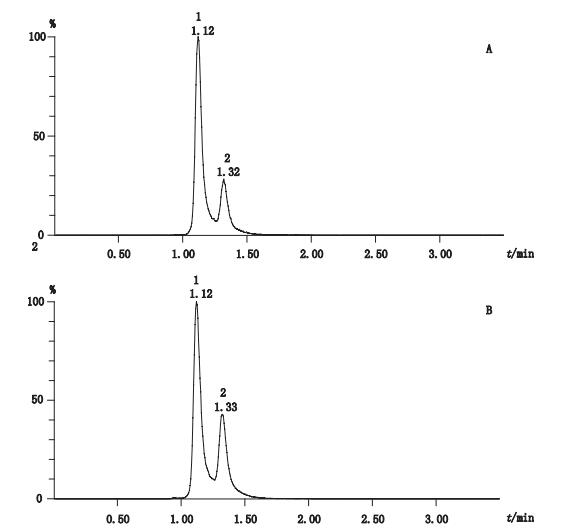
|
1、2.川楝素异构体(toosendanin isomers) 图 3 川楝素对照品(A)及舒肝丸(B)总离子流图 Figure 3 Total ion chromatograms of reference substance and Shugan pills(B) |
取川楝素对照品适量,精密称定,加甲醇溶解制成川楝素质量浓度分别为1.115、5.575、22.30、44.60、89.20、178.4和1 115 ng·mL-1的系列溶液,即得,备用。
2.2.2 供试品溶液取装量差异项下本品约1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称量,加热回流1 h,放冷,再称量,用甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.3 线性范围考察与定量限测定分别精密吸取系列对照品溶液(1.115、5.575、22.3、44.6、89.2、178.4、1 115 ng·mL-1)各1 μL,进样测定峰面积;川楝素结构中存在半缩醛结构,始终有2个互变异构体,以川楝素2个峰面积之和(Y)对质量浓度(X)进行线性回归,绘制标准曲线,得回归方程:
| $\begin{array}{*{20}{c}} {Y = 778.74X + 629.44}&{r = 0.999{\rm{ }}9} \end{array}$ |
结果表明,川楝素质量浓度在1.115~1 115 ng·mL-1范围内,线性关系良好。取对照品溶液逐级稀释,通过测定峰高(S)和基线噪音(N),按信噪比(S/N)3:1确定检出限为0.5 ng·mL-1,按信噪比(S/N)10:1确定最低定量限为1 ng·mL-1。
2.4 精密度考察取舒肝丸,按“2.2.2”项下方法制备供试品溶液,连续进样6次,计算峰面积的RSD为1.6%,表明仪器精密度良好。
2.5 重复性试验取同一批样品0.5、1.0、1.5 g各3份,精密称定,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下条件进行测定,得川楝素平均含量为10.2 mg·g-1,RSD为2.7%,结果表明该方法重复性良好。
2.6 回收率试验精密称取已知含量的同一批样品,每份约0.5 g,每3份为一组,分别加入用甲醇配制的低、中、高3个浓度的对照品溶液,按“2.2.2”项下方法制备供试溶液,进样测定,结果(表 1)表明样品处理方法提取效率稳定。
|
|
表 1 回收率试验结果 Table 1 Results of recovery test |
将质量浓度为84.29 ng·mL-1的对照品溶液分别放置0、1、3、5、12 h后进行测定,计算川楝素的2个峰面积之和的RSD为1.9%,表明川楝素对照品溶液在12 h内稳定。
2.8 含量测定取舒肝丸21批次,按照“2.2.2”项下方法制备供试品溶液,进样分析,以外标法计算得到川楝素含量,结果见表 2。
|
|
表 2 舒肝丸中川楝素含量测定结果(n=2) Table 2 Content of toosendanin in Shugan pills |
实验中分别考察了甲醇超声和甲醇回流2种提取方式,结果表明,当用甲醇超声提取时,结果发现第1个主峰前出现1个小峰,与主峰无法实现基线分离,干扰测定,用甲醇回流提取时,干扰峰消失,最终选择甲醇回流提取方式。
由于川楝素结构中存在半缩醛结构,始终有2个互变异构体[13],优化质谱条件时,确定母离子质量数,发现在负离子全扫描模式(MS Scan)得到m/z 573.3的[M-H]-准分子离子峰,以此为母离子,再进行子离子选择,通过子离子扫描(daughter scan)选择2个子离子碎片,优化碰撞能力,得到川楝素2个离子碎片m/z 531.4和m/z 425.3,其中m/z 531.4为川楝素在负离子条件下通过丢失乙酰基团形成的碎片离子[M-CH3CO]-,而m/z 425.3可能是川楝素丢失CH3CO、H2O、CO等多个基团后形成的碎片离子[M-2CH3CO-CO-2H2O]-;最终确定多反应检测模式(MRM),m/z 531.4为定量离子,m/z 425.3为定性离子,根据保留时间和定量离子计算含量,此方法优于选择离子监测(SIR)中用分子离子进行计算模式,含量测定结果更为准确。
本研究建立了舒肝丸中川楝素UPLC-MS/MS测定方法,在质量浓度范围内线性良好,分析时间大大缩短,准确度、精密度、回收率、稳定性等均满足定量分析要求,应用于21批舒肝丸中川楝素定量分析,样品中川楝素含量为2.40~40.0 μg·g-1。舒肝丸样品测定结果表明,舒肝丸中川楝素含量批次间差异较大,反应药品质量存在一定差异,建议制定舒肝丸中川楝素范围标准。
| [1] |
中国药典2015年版. 一部[S]. 2015: 1600 ChP 2015. Vol Ⅰ[S]. 2015:1600 |
| [2] |
李志敏, 左新, 王兆炜, 等. 川楝素驱猪蛔虫体外杀虫试验研究[J]. 中国兽药杂志, 2008, 42(3): 28. LI ZM, ZUO X, WANG ZW, et al. Studies on the effects of toosendanin on ascaris sum in vitro[J]. Chin J Vet Med, 2008, 42(3): 28. |
| [3] |
WATANABE T, SAKAMOTO N, NAKAGAWA M, et al. Inhibitory effect of a triterpenoid compound, with or without alpha interferon, on hepatitis C virus infection[J]. Antimicrob Agents Chemother, 2011, 55(6): 2537. DOI:10.1128/AAC.01780-10 |
| [4] |
齐双岩, 熊彦红, 金若敏. 川楝子致小鼠肝毒性时效、量效关系研究[J]. 时珍国医国药, 2008, 19(11): 2694. QI SY, XIONG YH, JIN RM. Time-dose-effect studies on hepatotoxicity of mice induced by Fructus Toosendan[J]. Lishizhen Med Mater Med Res, 2008, 19(11): 2694. DOI:10.3969/j.issn.1008-0805.2008.11.056 |
| [5] |
张先福, 王建华, 张树方, 等. 川楝素对昆明小鼠的胚胎毒性研究[J]. 畜牧兽医学报, 2005, 36(3): 301. ZHANG XF, WANG JH, ZHANG SF, et al. Research of embryotoxicity of toosendanin in Kunming mice[J]. Acta Vet Zootech Sin, 2005, 36(3): 301. |
| [6] |
周乐华, 李迎春, 窦志英. 川楝子及其炮制品中川楝素含量测定研究[J]. 天津药学, 2011, 23(1): 20. ZHOU LH, LI YC, DOU ZY. Determination of toosendanin in processed products of Toosendan Fructus[J]. Tianjin Pharm, 2011, 23(1): 20. |
| [7] |
陈强, 周浓, 王荣繁. HPLC测定川楝子不同采收期及不同部位中川楝素的含量[J]. 资源开发与市场, 2012, 28(9): 777. CHEN Q, ZHOU N, WANG RF. Determination of toosendanin in different parts of Melia toosendan in different seasons by HPLC[J]. Resour Dev Mark, 2012, 28(9): 777. |
| [8] |
李洁玉, 沈力, 周浓, 等. HPLC测定不同来源川楝子中川楝素[J]. 光谱实验室, 2013, 30(1): 294. LI JY, SHEN L, ZHOU N, et al. Determination of toosendanin in different sources of Melia toosendan by HPLC[J]. Chin J Spectrosc Lab, 2013, 30(1): 294. |
| [9] |
张烨, 周浓, 夏从龙. HPLC测定妇乐颗粒中川楝素含量[J]. 辽宁中医药大学学报, 2010, 12(4): 220. ZHANG Y, ZHOU N, XIA CL. Quantitative determination of toosendanin in Fule Keli by HPLC[J]. J Liaoning Univ TCM, 2010, 12(4): 220. |
| [10] |
罗文汇, 毕晓黎, 孙冬梅. LC-MS法测定川楝子中川楝素[J]. 中成药, 2014, 36(7): 1556. LUO WH, BI XL, SUN DM. Determination of toosendanin in Toosendan Fructus by LC-lus[J]. Chin Tradit Pat Med, 2014, 36(7): 1556. |
| [11] |
吴忠杰. 超高效液相色谱-质谱联用法测定川楝子中川楝素的含量[J]. 世界中西医结合杂志, 2015, 10(7): 940. WU ZJ. Determination of toosendanin content in Toosendan Fruit by UPLC/MS[J]. World J Integr Tradit West Med, 2015, 10(7): 940. |
| [12] |
吕桌, 张明, 王莉, 等. HPLC-MS/MS法测定川楝子中川楝素的研究[J]. 西北药学杂志, 2015, 30(5): 572. LÜ Z, ZHANG M, WANG L, et al. Determination of toosendanin in Toosendan Fructus by HPLC-MS/MS[J]. Northwest Pharm J, 2015, 30(5): 572. |
| [13] |
钟炽昌, 谢晶曦, 陈淑凤, 等. 川楝素的化学结构[J]. 化学学报, 1975, 33(1): 35. ZHONG ZC, XIE JX, CHEN SF, et al. The chemical structure of toosendanin[J]. Acta Chim Sin, 1975, 33(1): 35. |
 2017, Vol. 37
2017, Vol. 37 
