2. 广州市茗川生物科技有限公司, 广州 510006
2. Guangzhou Mingchuan Biological Technology Co., Ltd., Guangzhou 510006, China
紫杉醇(paclitaxel,PTX)[1]是从红豆杉树皮中提取分离的一种二萜生物碱类化合物,对许多类型的肿瘤细胞具有细胞毒作用[2]。脂质体作为抗肿瘤药物载体,因其制作简单,对机体无毒,能显著降低药物毒副作用及容易实现肿瘤靶向等优点而备受关注。近年来国内外对紫杉醇脂质体已进行了很多的研究[3-6],并且国内已有上市的注射用紫杉醇脂质体。包封率是评价脂质体制剂质量好坏的最重要的指标,也是脂质体能否发挥较普通制剂高效、低毒特点的关键[7]。因此,准确快速地测定紫杉醇脂质体的包封率具有重要的意义。中国药典2015年版二部[8]载有紫杉醇原料药的HPLC测定方法,以甲醇-水-乙腈(23:41:36)为流动相;注射用紫杉醇脂质体的质量标准采用国家食品药品监督管理局标准WS-718(X-529)-2002[9],以甲醇-水(3:1)为流动相进行含量和包封率的检测;其他一些研究者有的采用不同比例的乙腈-水或者甲醇-水为流动相[10-13],有的采用不同比例的甲醇-水-乙腈为流动相[14];这些方法在本实验研究中均出现主峰严重拖尾及保留时间过长的现象。为了克服该现象,曾对HPLC色谱条件进行了大量的尝试和探索,获得的HPLC条件能够很好地使主成分峰与辅料峰及溶剂峰完全分开,并且保留时间缩短,能够快速准确地测定紫杉醇脂质体的包封率。
1 仪器与试药SCL-10AVP型高效液相色谱仪(岛津公司);Platisil-ODS(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;迪马科技有限公司);BSA124S电子天平(北京赛多利斯科学仪器有限公司);JJ500型分析天平(常德双杰测试仪器有限公司);pHS-3C型精密pH计(上海仪电科学仪器股份有限公司);759紫外可见分光光度计(上海菁华科技有限公司)KQ5200B型超声波清洗器(昆山市超声仪器有限公司)。
紫杉醇原料药(海南紫杉园制药有限公司,批号141001,纯度 > 99.0%);紫杉醇对照品(中国食品药品检定研究院);卵磷脂(批号121001,上海金伴药业有限公司);胆固醇(批号100918,上海蓝季科技发展有限公司);Sephadex G-50(Pharmacia公司,100~300 μm);甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果 2.1 脂质体制备取10 mL磷酸盐缓冲液(pH 7.40),加热至50 ℃。精密称取紫杉醇原料药5 mg,大豆磷脂400 mg,胆固醇26.7 mg,α-生育酚12 mg,溶于少量(约1 mL)无水乙醇中,超声(功率40 W,频率200 kHz)8~10 min至完全溶解,磁力搅拌下注入上述磷酸盐缓冲液中,减压除去无水乙醇后,水浴超声5 min,取出,用0.45 μm的微孔滤膜挤出过滤,得到粒径均匀的紫杉醇脂质体,于4 ℃中保存备用。
空白脂质体的制备除不加紫杉醇原料药外,其余步骤同脂质体制备。
2.2 含量测定 2.2.1 色谱条件色谱柱:Platisil-ODS(250 mm×4.6 mm,5 μm);流动相:甲醇-水(含0.1%三乙胺和0.67%冰乙酸)(80:20);流速:1.0 mL·min-1;检测波长:227 nm;柱温:室温;进样量:20 μL。
2.2.2 溶液制备 2.2.2.1 对照品溶液精密称取紫杉醇对照品5 mg,置50 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,得对照品储备液(紫杉醇质量浓度为100 μg·mL-1);精密量取该储备液2 mL,置10 mL量瓶中,加流动相稀释至刻度,摇匀,即得对照品溶液(紫杉醇质量浓度为20 μg·mL-1)。
2.2.2.2 供试品溶液精密量取紫杉醇脂质体0.4 mL,置10 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,超声(功率40 W,频率200 kHz)约1 min使脂质体完全破解,由乳白色的变成无色,过滤,取续滤液过0.45 μm微孔滤膜,即得供试品溶液。
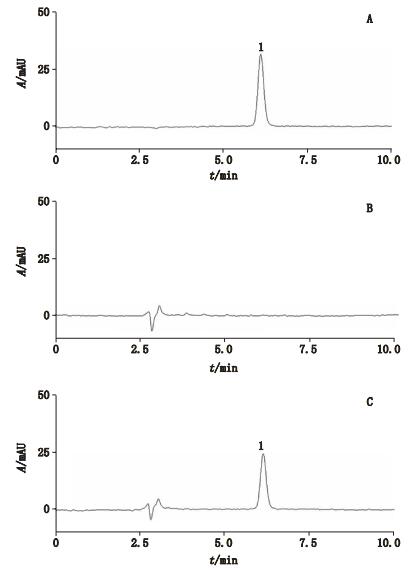
2.2.3 方法学考察 2.2.3.1 专属性试验取“2.2.2”项下的紫杉醇对照品溶液和供试品溶液,按上述色谱条件注入液相色谱仪;另取处方量辅料,置10 mL量瓶中,按拟订方法制备空白对照溶液,注入液相色谱仪,分别记录高效液相色谱图(见图 1),考察系统适用性。结果表明,在该色谱条件下,辅料对紫杉醇的测定无干扰。
|
1.紫杉醇(paclitaxel) A.对照品溶液(reference substance solution)B.空白对照溶液(blank control solution)C.供试品溶液(test sample solution) 图 1 高效液相色谱图 Figure 1 HPLC chromatograms |
精密移取“2.2.2.1”项下对照品储备液0.05、0.1、0.3、0.5、1、2、3、5 mL,分别置10 mL量瓶中,加流动相稀释并定容至刻度,摇匀,分别按上述色谱条件进样测定色谱峰面积;以峰面积(A)为纵坐标,质量浓度(C)为横坐标进行线性回归,得回归方程:
| $\begin{array}{*{20}{c}} {A = 18{\rm{ }}766C + 8{\rm{ }}883.2}&{r = 0.999{\rm{ }}3{\rm{ }}(n = 8)} \end{array}$ |
结果表明,紫杉醇质量浓度在0.5~50 μg·mL-1范围内与峰面积线性关系良好。
2.2.3.3 精密度试验精密移取“2.2.2.1”项下对照品储备液适量,分别配制质量浓度为3、15、30 μg·mL-1的溶液,分别按“2.2.1”项下色谱条件进行测定,记录色谱图。日内测定6次,并连续测定5 d,计算日内、日间精密度。结果见表 1。由结果可知,精密度均符合要求。
|
|
表 1 紫杉醇的方法精密度试验考察 Table 1 Precision of the method for determination of PTX |
分别取“2.2.2”项下对照品溶液和供试品溶液,分别于放置0、2、4、8、10 h时进样测定,记录峰面积;结果对照品溶液和供试品溶液峰面积的RSD分别为0.25%和1.41%,表明对照品溶液和供试品溶液均在10 h内稳定性良好,能满足测定需要。
2.2.3.5 加样回收率试验精密量取空白脂质体0.4 mL共9份,置10 mL量瓶中,分别加入质量浓度为100 μg·mL-1紫杉醇对照品储备液1.6、2.0、2.4 mL各3份,用流动相稀释并定容至刻度,摇匀,超声(功率40 W,频率200 kHz)约1 min,挤过0.45 μm微孔滤膜,即得供试溶液。分别取20 μL注入液相色谱,将峰面积代入标准曲线计算测定紫杉醇质量浓度,与实际紫杉醇质量浓度相比得到样品加样回收率,所得到的平均加样回收率在98%~102%内,RSD均小于2%,能够满足脂质体中紫杉醇含量测定要求。结果见表 2。
|
|
表 2 紫杉醇脂质体的回收率试验结果 Table 2 Results of recovery test of PTX liposomes |
精密称取葡聚糖凝胶G-50 3.0 g,用10倍煮沸的蒸馏水溶胀4~6 h,超声(功率40 W,频率200 kHz)脱气20 min,即得葡聚糖凝胶G-50悬浮液。装柱,柱内径1.0 cm,柱高20 cm,需缓慢、均匀、连续地加入已经脱气的葡聚糖凝胶G-50悬浮液,使其均匀的沉积,直至所需要的高度(约16~17 cm),以蒸馏水封柱保存备用。
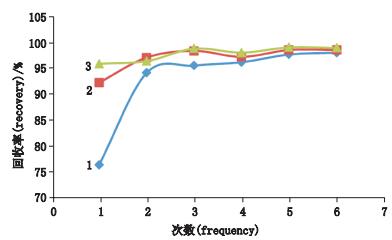
2.3.2 葡聚糖凝胶G-50对空白脂质体的吸附精密量取空白脂质体0.5、1.0、2.0 mL,分别直接加于葡聚糖凝胶G-50柱顶端,用pH 7.40的磷酸盐缓冲溶液约20 mL洗脱于10 mL量瓶中并定容,于450 nm处测吸光度;分别连续连续上样操作7次,第7次洗脱液测定数据与第6次一致,所以选择前6次的测定数据;另空白脂质体0.5、1.0、2.0 mL各取1份,直接置于10 mL量瓶中,用上述磷酸盐缓冲液稀释至刻度,于450 nm处测吸光度。计算前6次操作的回收率。结果见图 2。
|
1.0.5 mL 2.1.0 mL 3.2.0 mL 图 2 葡聚糖凝胶G-50对空白脂质体的吸附 Figure 2 Adsorption of Sep G-50 on blank liposomes |
由图 2可知,0.5 mL空白脂质体洗脱3次,1.0 mL和2.0 mL的空白脂质体分别洗脱2次凝胶柱可以达到吸附饱和,且2.0 mL空白脂质体第1次回收即可达到95%以上。本实验操作中,均用0.5 mL空白脂质体以饱和凝胶柱洗脱3次。
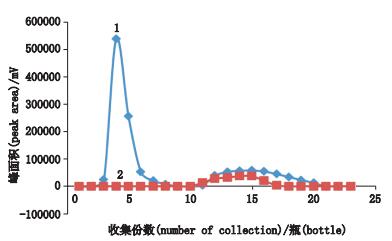
2.3.3 脂质体分离洗脱曲线取紫杉醇对照品1.8 mg,用无水乙醇溶解并定容至5 mL量瓶中作为游离药物储备液。精密移取空白脂质体0.5 mL,上葡聚糖凝胶柱,用pH 7.40的磷酸盐缓冲溶液约15 mL以0.5 mL·min-1的流速洗脱,连续洗脱3次,,对凝胶柱进行空白脂质体预饱和。然后分别精密移取紫杉醇脂质体0.2 mL和游离药物储备液0.1 mL上柱,以pH=7.40的磷酸盐缓冲液洗脱,收集流份,每管收集1 mL,测定紫杉醇峰面积;以峰面积为纵坐标,收集份数为横坐标,绘制紫杉醇脂质体、游离药物PBS缓冲液洗脱曲线,结果见图 3。
|
1.紫杉醇脂质体洗脱(paclitaxel liposome elution) 2.游离药物洗脱(free drug elution) 图 3 紫杉醇脂质体样品及游离药物洗脱曲线 Figure 3 The elution curves of paclitaxel liposome and free drug samples |
根据洗脱曲线可知,前10 mL洗脱液为脂质体包封药物,后10 mL洗脱液为游离药物,脂质体包封药物和游离药物通过葡聚糖凝胶柱G-50得到很好的分离。
2.3.4 脂质体包封率的测定精密量取0.2 mL的脂质体用pH 7.40磷酸盐缓冲溶液稀释于10 mL量瓶中,定容,混匀后,过0.45 μm的滤膜,按上述色谱条件进样,测峰面积,代入标准曲线,计算紫杉醇总量Cb;精密量取脂质体0.2 mL加于空白脂质体预饱和的凝胶柱顶端,用pH=7.40的磷酸盐缓冲溶液洗脱,收集第3~10 mL的洗脱液,用pH=7.40磷酸盐缓冲溶液稀释于10 mL量瓶中,定容,混匀后,过0.45 μm的滤膜,按上述色谱条件进样,测峰面积,代入标准曲线,计算包入脂质体中紫杉醇的量Ca,按Ca/Cb×100%计算包封率。结果见表 3。
|
|
表 3 紫杉醇脂质体包封率 Table 3 The entrapment efficiency of paclitaxel liposome |
在流动相的选择中,试用不同比例的乙腈-水、甲醇-水-乙腈、甲醇-水为流动相,发现保留时间比较长,峰形也不好,最后摸索出甲醇-水(含0.1%三乙胺和0.67%冰乙酸)(80:20)为流动相,紫杉醇的出峰时间为6.165 min,且辅料对紫杉醇的峰值无干扰。
3.2 紫杉醇脂质体的药物包封率测定方法的选择紫杉醇在波长227 nm处有最大吸收,而辅料大豆磷脂在此波长处也有紫外吸收。如直接用紫外分光光度法测定紫杉醇脂质体中紫杉醇的量,由于脂质体在溶液中是微粒体系,会吸收部分紫外光线,干扰药物的吸收,另外即使将含药的脂质体完成溶解于甲醇中成透明溶液,也会因为大豆磷脂的存在干扰药物的测定。因此,作者采用葡聚糖凝胶G-50/HPLC法测定紫杉醇脂质体的包封率,使测定结果更加准确。
3.3 含药脂质体与游离药物洗脱分界点的界定脂质体包封率测定的关键是:(1)减少葡聚糖凝胶G-50柱对含药脂质体的吸附;(2)含药脂质体与游离药物完全分开。为了解决这2个问题,采取空白脂质体预饱和的方法,减少凝胶柱对含药脂质体的吸附,而且该结果在葡聚糖凝胶G-50柱对空白脂质体的吸附试验中得到了验证;采用10 mL为分界点收集脂质体部分,游离药物与脂质体在葡聚糖凝胶G-50柱上的洗脱曲线显示,前10 mL是含药脂质体,后10 mL是游离药物,以10 mL为分界点,游离药物对含药脂质体无干扰。
| [1] |
史清文. 天然药物化学史话:紫杉醇[J]. 中草药, 2011, 42(10): 1878. SHI QW. Historical story on natural medicinal chemistry of taxol[J]. Chin Tradit Herb Drugs, 2011, 42(10): 1878. |
| [2] |
陈卫东, 刘晓东. 抗肿瘤药紫杉醇脂质体的研究进展[J]. 中国药物与临床, 2005, 5(10): 776. CHEN WD, LIU XD. Research progress of paclitaxel liposome with antitumor drug[J]. Chin Remed Clin, 2005, 5(10): 776. DOI:10.3969/j.issn.1671-2560.2005.10.016 |
| [3] |
ZHANG JA, ANYARAMBHATLA G, MA L. Development and characterization of a novel Cremophor EL free liposome-based paclitaxel(LEP-ETU)formulation[J]. Eur J Pharm Biopharm, 2005, 59(1): 177. DOI:10.1016/j.ejpb.2004.06.009 |
| [4] |
CROSASSO P, CERUT IM, BRUSA P, et al. Preparation, characterization and properties of sterically stabilized paclitaxel containing liposomes[J]. J Control Release, 2000, 63(1-2): 19. DOI:10.1016/S0168-3659(99)00166-2 |
| [5] |
阎家麒, 王悦, 王九一. 紫杉醇隐形脂质体的制备及在小鼠体内的组织分布[J]. 药学学报, 2000, 35(9): 706. YAN JQ, WANG Y, WANG JY. Preparation of paclitaxel stealth liposomes and its tissue distribution in mice[J]. Acta Pharm Sin, 2000, 35(9): 706. |
| [6] |
王薇, 许鑫, 胡戴, 等. 紫杉醇脂质体的制备及表征[J]. 中国药业, 2013, 22(22): 63. WANG W, XU X, HU D, et al. Preparation and characterization of paclitaxel liposome[J]. China Pharm, 2013, 22(22): 63. |
| [7] |
郑宁, 张立德. 脂质体质量控制方法的研究概况[J]. 中国新药杂志, 2004, 13(12): 1282. ZHENG N, ZHANG LD. A general situation in studies of quality control for liposomes[J]. Chin J New Drugs, 2004, 13(12): 1282. DOI:10.3321/j.issn:1003-3734.2004.12.067 |
| [8] |
中国药典2015年版. 二部[S]. 2015: 1368 ChP 2015. Vol Ⅱ[S]. 2015:1368 |
| [9] |
WS-718(X-529)-2002国家食品药品监督管理局标准[S]. 2002 WS-718(X-529)-2002 The State Food and Drug Administration Standards[S]. 2002 |
| [10] |
张一鸣, 刘靖新, 周颖琳, 等. 固相萃取-高效液相色谱法测定紫杉醇脂质体的包封率[J]. 分析科学学报, 2014, 30(5): 705. ZHANG YM, LIU JX, ZHOU YL, et al. Measurement of entrapment efficiency in liposome by solid phase extraction combined with high performance liquid chromatography[J]. J Anal Sci, 2014, 30(5): 705. |
| [11] |
康艳敏, 吴燕, 杨长青, 等. 紫杉醇脂质体的制备及质量考察[J]. 中国药房, 2008, 19(28): 2208. KANG YM, WU Y, YANG CQ, et al. Preparation and quality study of paclitaxel liposome[J]. China Pharm, 2008, 19(28): 2208. |
| [12] |
谭燕, 周建平, 仝新勇, 等. 紫杉醇脂质体大鼠体内药动学考察[J]. 江苏药学与临床研究, 2006, 14(2): 1. TAN Y, ZHOU JP, TONG XY, et al. Study on pharmacokinetics of paclitaxel liposome in rats[J]. Jiangsu Pharm Clin Res, 2006, 14(2): 1. |
| [13] |
周蔚, 周彩存, 孟淑燕, 等. 靶向肺癌的紫杉醇长循环脂质体抑瘤作用研究[J]. 肿瘤, 2011, 31(3): 203. ZHOU W, ZHOU CC, MENG SY, et al. The anti-tumor effects of lung cancer-targeting long-circulating paclitaxel-containing liposomes[J]. Tumor, 2011, 31(3): 203. |
| [14] |
周卫, 翁帼英, 陈文忠, 等. 紫杉醇脂质体在大鼠体内的组织分布[J]. 中国药学杂志, 2005, 40(18): 1402. ZHOU W, WENG GY, CHEN WZ, et al. Tissue distribution of paclitaxel liposome in rats[J]. Chin Pharm J, 2005, 40(18): 1402. DOI:10.3321/j.issn:1001-2494.2005.18.013 |
 2017, Vol. 37
2017, Vol. 37 
