2. 北京中医药大学中医药研究院, 北京 100029;
3. 北京中医药大学图书馆, 北京 100029
2. Beijing Research Institution of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Library of Beijing University of Chinese Medicine, Beijing 100029, China
苦碟子,为菊科苦荬菜属抱茎苦荬菜Ixeris sonchifolia(Bunge)Hance的全草[1],具有清热[2]、凉血活血[3]、消肿排脓[2]等功效。苦碟子中的化学成分种类繁多,主要含黄酮、倍半萜内酯、三萜皂苷和有机酸等化合物[4-6]。其中倍半萜内酯类化合物广泛存在于菊科、八角科及木兰科[7-9]等多植物中,是多种药用植物的重要活性成分。近年来国内外研究表明,倍半萜内酯类成分在强心[10]、抗肿瘤[11-12]、抗炎、抑菌[13]等方面均具有较好的生物活性。苦荬菜内酯Z(Ixerin Z)和11,13α-二氢苦荬菜内酯Z(11,13α-dihydroixerin Z)成分为苦碟子中2种重要的倍半萜内酯类成分。药物与血清蛋白结合率是药物代谢动力学的重要参数之一,影响药物在体内的作用规律[14-16]。本实验室采用高速逆流色谱分离技术[17]从苦碟子中首次分离得到苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z,并采用平衡透析法结合HPLC技术研究苦荬菜内酯Z,11,13α-二氢苦荬菜内酯Z与牛血清白蛋白(BSA)的结合率,为其药物动力学研究提供参数,对研究该类成分在体内的药理效应强度、作用时间有重要的参考意义。
1 仪器与试剂Agilent 1100型高效液相色谱仪(安捷伦科技有限公司),TARGIN VX-Ⅱ型多管涡旋振荡器(北京踏锦科技有限公司);Thermo Fresco 21微量离心机(赛默飞世尔科技有限公司);梅特勒MS205Dμ分析天平(上海梅特勒-托利多仪器有限公司);TTL-DCI型氮吹仪(北京同泰联科技发展有限公司)、Millipore Synergy UV型超纯水机(Millipore公司)。
苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的对照品由实验室自苦碟子药材中分离纯化制得,通过1H-和13C-NMR以及LC-MS等分析并与文献数据对照鉴定结构,采用HPLC面积归一化法测定其纯度均大于98%;透析袋(截留相对分子质量:12 000~14 000;规格:干燥时直径21 mm,每卷长5 m;北京拜尔迪生物技术有限公司);磷酸盐缓冲液(PBS,pH 7.4,0.01 mol·L-1;北京拜尔迪生物技术有限公司);BSA标准品(纯度≥98%;美国Sigma公司);甲醇为色谱纯,实验用水为超纯水,其他试剂均为分析纯。
2 方法与结果 2.1 溶液配制 2.1.1 对照品储备液分别精密称取苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z对照品适量,置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的对照品储备液,备用。
2.1.2 BSA溶液精密称定BSA适量,加PBS溶液制得1 mmol·L-1的BSA溶液,备用。
2.1.3 样品溶液精密量取苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的对照品储备液适量,用甲醇分别逐级稀释,配制成质量浓度分别为0.36、1.56、3.12 mg·mL-1和0.48、1.82、3.6 mg·mL-1的对照品溶液,分别精密量取上述2个化合物的3种不同浓度对照品溶液各100 μL,置1.5 mL离心管中混合,并加入PBS或BSA溶液1 mL,涡旋60 s,取上清即得2个化合物的低、中、高3个浓度混合溶液,即苦荬菜内酯Z(0.03、0.13、0.26 mg·mL-1)和11,13α-二氢苦荬菜内酯Z(0.04、0.16、0.30 mg·mL-1)的PBS样品溶液或BSA样品溶液(模拟经过透析平衡后的透析袋外或内样品溶液)。
2.1.4 供试溶液取PBS样品溶液或BSA样品溶液200 μL,加甲醇600 μL沉淀蛋白,涡旋混合30 s,以8 000 r·min-1离心5 min,取上清液500 μL置于离心管中,氮吹,残渣加200 μL甲醇复溶,涡旋混合30 s,以8 000 r·min-1离心5 min,取上清即得苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的PBS供试溶液或BSA供试溶液。
2.1.5 空白溶液取PBS 200 μL,其余操作同“2.1.4”项下供试溶液制备,即得。
2.2 色谱条件色谱柱:Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm);流动相:水(A)-甲醇(B),梯度洗脱(0~5 min,30%B→37%B;5~15 min,37%B→52%B;15~22 min,52%B→60%B);流速:1.0 mL·min-1;柱温:30℃;检测波长:272 nm。分别取苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z透析袋内外溶液、PBS供试溶液、BSA供试溶液及空白溶液均为10 μL进样。在上述色谱条件下,本试验中苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的PBS及BSA溶液的HPLC色谱图峰形良好,无杂质干扰测定,具有较高的特异性,分析条件可以满足测定。色谱图见图 1。
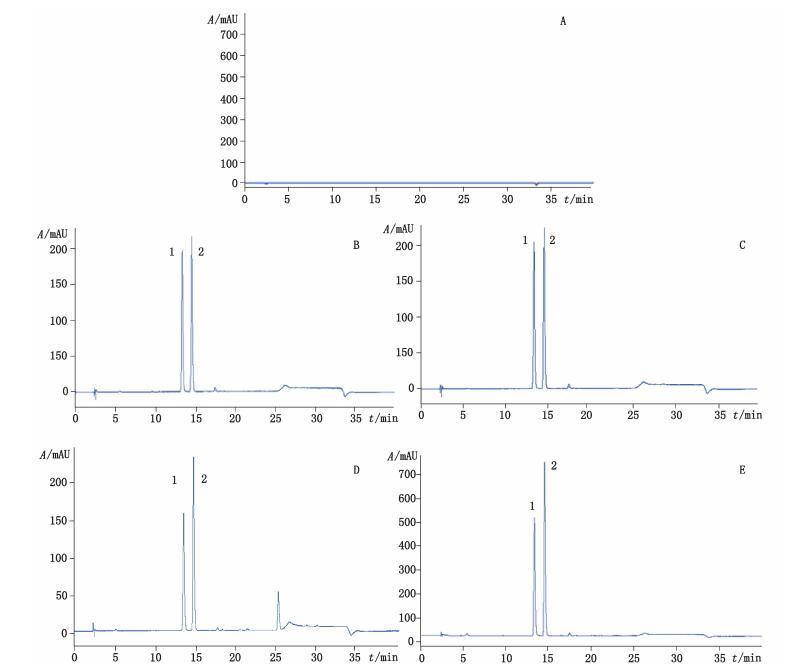
|
1.苦荬菜内酯Z(Ixerin Z)2.11,13α-二氢苦荬菜内酯Z(11,13α-dihydroixerin Z) 图 1 空白PBS溶液(A)、BSA供试溶液(B)、PBS供试溶液(C)、透析袋外样品溶液(D)、透析袋内样品溶液(E)的HPLC图 Figure 1 Chromatograms obtained from blank PBS(A), BSA test solution(B), PBS test solution(C), sample solution outside dialysis bag(D)and sample solution inside dialysis bag(E) |
在BSA溶液的标准曲线:取苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的对照品储备液适量,用甲醇依次稀释得系列对照品溶液,浓度分别为0.04、0.12、0.24、0.52、1.04、1.08mg·mL-1和0.08、0.16、0.32、0.60、1.20、2.40 mg·mL-1。各精密取上述2个化合物系列浓度溶液100 μL于1.5 mL离心管中;另取BSA溶液200 μL共12份,依次加入上述各离心管中,涡旋60 s,分别得到质量浓度分别为0.01、0.03、0.06、0.13、0.26、0.52 mg·mL-1的苦荬菜内酯Z溶液,0.02、0.04、0.08、0.15、0.30、0.60 mg·mL-1的11,13α-二氢苦荬菜内酯Z溶液。按“2.1.4”项下方法制备所需溶液,进样测定;以苦荬菜内酯Z或11,13α-二氢苦荬菜内酯Z浓度为横坐标,峰面积为纵坐标绘制标准曲线,分别得到苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的线性方程:
| $\begin{array}{l} \begin{array}{*{20}{c}} {Y = 2.021 \times {{10}^4}X{\rm{ }} + 268.10}&{{r^2} = 0.999{\rm{ }}0} \end{array}\\ \begin{array}{*{20}{c}} {Y = 2.260 \times {{10}^4}X{\rm{ }} + 150.07}&{{r^2} = 0.999{\rm{ }}7} \end{array} \end{array}$ |
在PBS溶液的标准曲线:取苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的对照品储备液适量,用甲醇依次稀释得系列对照品溶液,浓度分别为0.04、0.12、0.24、0.52、1.04、1.08 mg·mL-1和0.08、0.16、0.32、0.60、1.20、2.40 mg·mL-1。各精密取上述2化合物系列浓度溶液100 μL于1.5 mL离心管中;另取200 μL PBS溶液12份,依次加入上述各离心管中,涡旋60 s,得到质量浓度分别为0.01、0.03、0.06、0.13、0.26、0.52 mg·mL-1的苦荬菜内酯Z溶液,0.02、0.04、0.08、0.15、0.30、0.60 mg·mL-1的11,13α-二氢苦荬菜内酯Z溶液。按“2.1.4”项下方法处理制备所需溶液,以苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z浓度为横坐标,峰面积为纵坐标绘制标准曲线,分别得到苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的线性方程:
| $\begin{array}{l} \begin{array}{*{20}{c}} {Y = 2.177 \times {{10}^4}X - 29.96}&{{r^2} = 0.999{\rm{ }}7} \end{array}\\ \begin{array}{*{20}{c}} {Y = 2.260 \times {{10}^4}X - 29.47}&{{r^2} = 0.999{\rm{ }}1} \end{array} \end{array}$ |
结果表明,在BSA溶液和PBS溶液中,苦荬菜内酯Z质量浓度在0.01~0.52 mg·mL-1的线性范围内线性关系良好,方法的定量下限为0.01 mg·mL-1;11,13α-二氢苦荬菜内酯Z质量浓度在0.02~0.60 mg·mL-1的线性范围内线性关系良好,方法的定量下限为0.02 mg·mL-1。
2.3.2 准确度与精密度试验按“2.1.4”项下方法分别制备低、中、高3个浓度的PBS和BSA的供试溶液,每个浓度平行制备6份,进行HPLC分析,以当日随行标准曲线计算供试溶液中2个化合物的实测浓度,分别计算苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z在BSA和PBS溶液中的准确度(相对偏差,RE)。按“2.1.4”项下方法制备低、中、高3个浓度的PBS和BSA的供试溶液,每个浓度平行制备6份,在1 d内及连续3 d用同台仪器进行HPLC分析,根据峰面积计算日内和日间精密度(RSD),结果见表 1。
|
|
表 1 准确度和精密度(n=6) Table 1 Intra-and inter-day accuracy and precision |
按“2.1.4”项下方法制备低、中、高3个浓度的PBS和BSA的供试溶液,每个浓度平行制备6份,于室温下保存,分别于0、2、6、10 h进行HPLC分析。以当日随行标准曲线计算苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z在BSA和PBS供试溶液的浓度;结果在BSA溶液中,苦荬菜内酯Z低、中、高3个浓度的RSD分别为2.49%、5.45%、3.37%,11,13α-二氢苦荬菜内酯Z低、中、高3个浓度的RSD分别为2.50%、2.52%、2.69%;在PBS溶液中,苦荬菜内酯Z低、中、高3个浓度RSD分别为2.98%、4.24%、1.35%,11,13α-二氢苦荬菜内酯Z低、中、高3个浓度RSD分别为2.79%、2.40%、1.83%。结果表明,2个化合物在BSA和PBS溶液中室温下放置10 h基本稳定。
2.3.4 透析时间的确定采用平衡透析法原理,在透析袋内装入1 mL PBS溶液,结扎透析袋两端使不漏液,将透析袋置于盛有10 mL含苦荬菜内酯Z(0.03、0.13、0.26 mg·mL-1)和11,13α-二氢苦荬菜内酯Z(0.04、0.15、0.30 mg·mL-1)的PBS溶液的离心管中,使袋内外液面处于同一水平高度,每个浓度平行做3份。在37℃水浴中透析,在9、12、24 h于透析袋两侧分别取样,参照“2.1.4”项下方法处理并测定透析袋内、外的苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z质量浓度,以两者质量浓度比值确定两者从袋内外自由扩散达到平衡的时间,结果见表 2。结果表明两化合物24 h已透析完全。
|
|
表 2 透析时间的确定(n=3) Table 2 The determination of dialysis time |
参照“2.3.4”项下实验方法操作,在37℃水浴透析,24 h 2个化合物透析达到平衡后,于透析袋两侧分别取样,参照“2.1.4”项下方法处理,根据参考文献[18]并以标准曲线法,计算透析袋外2个化合物的浓度,求得吸附率,结果见表 3。结果表明,透析袋对2个化合物有微弱的吸附,该吸附量可忽略不计。
|
|
表 3 透析袋对苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的吸附率(n=3) Table 3 The adsorption rate of Ixerin Z and 11, 13α-dihydroixerin Z by dialysis membrane |
精密量取1 mL BSA溶液代替1 mL PBS溶液加入透析袋中,参照“2.3.4”项下实验方法操作,在37℃水浴透析至24 h平衡后,使用10%(v/v)高氯酸溶液检查透析袋外PBS溶液中有无蛋白漏出,若有浑浊出现说明此袋泄露,实验数据作废[19]。取透析袋外和透析袋内溶液各200 μL,按“2.1.4”项下方法处理,分别测定苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z袋内BSA溶液中的质量浓度(总浓度Dt)及袋外PBS溶液中苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的质量浓度(游离浓度Df),按血浆白蛋白结合率=(Dt-Df)/Dt×100%,计算2个化合物的BSA结合率,结果见表 4。
|
|
表 4 苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的BSA结合率的测定(n=3) Table 4 The binding rates of Ixerin Z and 11, 13α-dihydroixerin Z with bovine serum albumin |
平衡透析法具有原理简单,操作简便等特点,是目前进行化合物蛋白结合率测定的常用方法。本文首次采用平衡透析法对苦碟子中倍半萜内酯类成分苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的单体与BSA的结合率进行了测定。本实验采用透析温度为37℃,通过对透析时间的考察,最终确定了2个化合物透析平衡时间为24 h的条件,同时采用10%高氯酸溶液检查透析结束后透析袋外PBS溶液中无蛋白漏出,表明所建立的方法适用于苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z的BSA结合率的测定。
本实验结果表明,苦荬菜内酯Z和11,13α-二氢苦荬菜内酯Z与BSA具有中等强度的结合率,且在实验浓度内BSA结合率与PBS中药物浓度无关。稳定的血浆蛋白结合率,使发挥药效作用的游离型药物质量浓度保持相对稳定,同时血浆蛋白结合具有可逆性,当游离型药物因组织分布而质量浓度下降时,结合型药物与蛋白解离,补充到组织中,从而有利于药效的持续充分发挥。
| [1] |
南京中医药大学. 百科全书中药[M]. 上海: 上海科学技术出版社, 2006: 1783 Nanjing University of Chinese Medicine. Encyclopedia of Chinese Materia Medica[M]. Shanghai:Shanghai Science and Technology Publishers, 2006:1783 |
| [2] |
王晓芝. 苦碟子的药理作用及临床应用[J]. 中国实用医药, 2006, 1(5): 41. WANG XZ. The pharmacological action and clinical application of Ixeris sonchifolia Hance[J]. China Pract Med, 2006, 1(5): 41. |
| [3] |
聂霞. 苦碟子的药理作用及其临床应用[J]. 山西医药杂志, 2006, 35(7): 658. NIE X. The pharmacological action and clinical application of Ixeris sonchifolia Hance[J]. J Med Shanxi, 2006, 35(7): 658. |
| [4] |
李玲. 苦碟子化学成分的研究[D]. 长春: 吉林大学, 2008 LI L. Studies on Chemical Constituents of Ixeris sonchifolia(Bge.) Hance[D]. Changchun:Jilin University, 2008 |
| [5] |
刘颖, 卢建秋, 张加余. 苦碟子药材及其注射液中化学成分的HPLC-ESI-MSn分析[J]. 中国中药杂志, 2013, 16(38): 2675. LIU Y, LU JQ, ZHANG JY. Analysis of chemical composition on Ixeris sonchifolia(Bge.)Hance and the injection by HPLC ESI-MSn[J]. China J Chin Mater Med, 2013, 16(38): 2675. |
| [6] |
张囡, 吕阿丽, 王玎, 等. 苦碟子的化学成分[J]. 沈阳药科大学学报, 2007, 24(9): 549. ZHANG N, LÜ AL, WANG D, et al. Studies on chemical constituents of Ixeris sonchifolia(Bge.)Hance[J]. J Shenyang Pharm Univ, 2007, 24(9): 549. |
| [7] |
刘清华, 杨峻山, 索茂荣. 斑鸠菊属的倍半萜内酯类及甾体皂苷类化学成分及药理活性研究进展[J]. 中国中药杂志, 2007, 32(1): 10. LIU QH, YANG JS, SUO MR. Studies on chemical constituents and pharmacological activities of sesquiterpene lactones and steroidal saponins of Vernonia[J]. China J Chin Mater Med, 2007, 32(1): 10. |
| [8] |
胡岩, 段天璇, 曹枫, 等. 八角科植物果皮化学成分的LC-MS图谱特征及其在分类和药材鉴别上的意义[J]. 中国中药杂志, 2010, 35(14): 1836. HU Y, DUAN TX, CAO F, et al. LC-MS spectra characteristic chemical composition of Illiciaceae plants peel and its significance in the classification and identification of medicinal herbs[J]. China J Chin Mater Med, 2010, 35(14): 1836. |
| [9] |
杨茜. 金沸草含量测定以及倍半萜内酯类成分的药动学研究[D]. 上海: 第二军医大学, 2012 YANG Q. Studies on Content Determination and Pharmacokinetics of Sesquiterpenes from Inulae Herba[D]. Shanghai:The Second Military Medical Univiversity, 2012 |
| [10] |
BARSBY RW, SALAN U, KNLSHT DW, et al. Fevefewand vascular smooth muscle:Extracts from fresh and dried plants show opposing pharmacologieal profiles, dependent upon sesquiterpone lactone content[J]. Planta Med, 1993, 59(1): 20. DOI:10.1055/s-2006-959596 |
| [11] |
EVSTRATOVA RI, SHEICHENKO VI, RYBALLKO KS. Sesquiterpene lactones from Inula japonica[J]. Khim Prir Soedin, 1974, 9(6): 730. |
| [12] |
KISELEVA EY, SHEICHENKO VI, RYBALLKO KS, et a1. Sesquiterpene lactone of inuladin from Inula japonica[J]. Khim Prir Scodin, 1971, 7(3): 263. |
| [13] |
HUANG CC, LIN KJ, CHENG YW, et al. Hepatoprotective effect and mechanistic insights of deoxyelephantopin, a phyto-sesquiterpene lactone, against fulminant hepatitis[J]. J Nutr Biochem, 2013, 24(3): 516. DOI:10.1016/j.jnutbio.2012.01.013 |
| [14] |
陆国弟, 吴德康, 马宏跃, 等. 沙蟾毒精与牛血清蛋白的结合及分子对接研究[J]. 药物分析杂志, 2012, 32(3): 373. LU GD, WU DK, MA HY, et al. Study of binding and molecular docking between arenobufagin and bovine serum protein[J]. Chin J Pharm Anal, 2012, 32(3): 373. |
| [15] |
张海, 刘浩, 王本伟, 等. 五味子甲素4℃条件下血浆蛋白结合率的测定[J]. 药物分析杂志, 2013, 33(6): 941. ZHANG H, LIU H, WANG BW, et al. Determination of plasma protein binding rate of deoxyschisandrin at 4℃[J]. Chin J Pharm Anal, 2013, 33(6): 941. |
| [16] |
ERIKSSON MAL, GABRIELSSON J, NILSSON LB. Studies of drug binding to plasma proteins using a variant of equilibrium dialysis[J]. J Pharm Biomed Anal, 2005, 38(3): 381. DOI:10.1016/j.jpba.2005.01.015 |
| [17] |
CAI W, ZHANG JY, LI GL, et al. Isolation and purification of sesquiterpene lactones from Ixeris sonchifolia(Bunge)Hance by high-speed countercurrent chromatography and semi–preparative high performance liquid chromatography[J]. Trop J Pharm Res, 2014, 13(12): 2065. |
| [18] |
张弘, 张晖芬, 常会超, 等. 齐墩果酸在人血浆蛋白和血清白蛋白中结合率的测定[J]. 药学学报, 2011, 46(2): 243. ZHANG H, ZHANG HF, CHANG HC, et al. Determination of protein binding rate of oleanolic acid in human plasma and serum albumin[J]. Acta Pharm Sin, 2011, 46(2): 243. |
| [19] |
卢来春, 蒋学华, 杨俊毅, 等. 阿莫西林对格列美脲血浆蛋白结合率的影响[J]. 华西药学杂志, 2003, 18(4): 246. LU LC, JIANG XH, YANG JY, et al. The effects of amoxicillin on plasma protein-binding rate of glimepiride[J]. West China J Pharm Sci, 2003, 18(4): 246. |
 2017, Vol. 37
2017, Vol. 37 
