2. 安捷伦科(中国)有限公司, 上海 200085
2. Agilent Scientific China Company, Shanghai 200085, China
核糖核酸Ⅰ/Ⅱ/Ⅲ是分别从健康猪肝脏、牛胰脏以及猪脾脏中提取分离的核糖核酸(RNA),它的基本单位是核苷酸,是由几十个至几千个核苷酸聚合而成的长链,每一种RNA都有一定的核苷酸排列顺序和二、三级结构。生产企业均在核糖核酸生产工艺中使用了苯酚进行提取纯化[1],后续工艺如果没有有效地去除环节,可能带来安全隐患。因此注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量是需要检测并严格控制的指标,而目前注射用核糖核酸Ⅰ/Ⅱ/Ⅲ的国家标准[2-4]中均未对苯酚进行控制。苯酚的限度参照中国药典2015年版[5]下,按ICH第2类溶剂最严限度要求定为0.006%。
核糖核酸Ⅰ/Ⅱ/Ⅲ是从动物脏器中提取的多组分生化药,成分复杂,包含有小分子核苷、核苷酸以及大分子核糖核酸片段(几个至几百个核苷酸),分子量范围跨度从几百到几万。而苯酚与核苷、核苷酸、小分子核糖核酸短片段性质相似,分子量相差小,因此采用高效液相色谱法[6-7]和气相色谱法[8-9]测定注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中的苯酚残留量时,核苷、核苷酸、核糖核酸短片段对苯酚产生干扰,相互之间不能有效分离。本文采用二维液相色谱方法,通过一维凝胶色谱柱将苯酚与核糖核酸主成分按照分子量大小进行初步分离,并确定苯酚的出峰位置,然后通过中心切割方法将苯酚及其共流出的干扰物质切换到富集柱上进行捕集,再通过阀切换将捕集到的苯酚及共流出物从富集柱上洗脱至第二维反相色谱柱上进行分离,从而准确测定注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚的残留量。
1 仪器与试药Agilent公司二维液相色谱系统:第一维由Agilent 1100二元泵,自动进样器,柱温箱和二极管阵列检测器组成,第二维由Agilent 1260四元泵、柱温箱(内置2位-六通阀)和紫外检测器组成。Waters公司ACQUITY UPLC BEH 200 SEC(150 mm×4.6 mm,1.7 μm;填料:亚乙基桥杂化二醇包膜颗粒)色谱柱,Agilent公司ZORBAX SB-Aq保护柱(4.6 mm×20 mm,5 μm;填料:经二异丙基修饰的硅氧烷键合硅胶),岛津公司Inertsil ODS SP(4.6 mm×250 mm,5 μm;填料:高纯硅胶)色谱柱。色谱数据软件为OpenLabChemstation C0105。流路图如图 1所示。
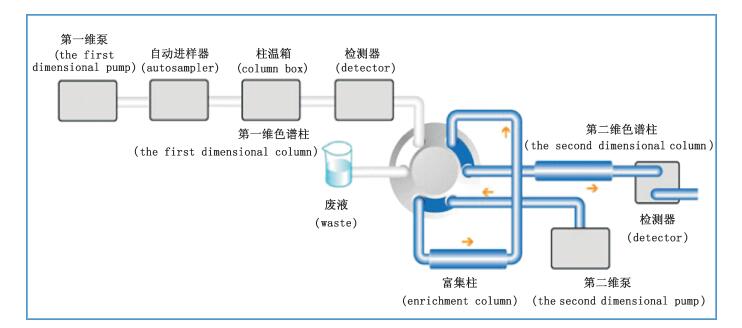
|
图 1 二维色谱流路连接图 Figure 1 Flow diagram of two-dimensional liquid chromatography |
苯酚对照品(批号100509-201203,含量100.0%,中国食品药品检定研究院);注射用核糖核酸Ⅰ2批(企业A:批号150401;企业B:批号1505011),注射用核糖核酸Ⅱ 1批(企业C:批号B140119),注射用核糖核酸Ⅲ1批(企业D:批号15042225);甲醇为色谱纯,磷酸二氢钠、氢氧化钠、磷酸等均为分析纯,水为去离子水。
2 方法与结果 2.1 溶液配制 2.1.1 对照品溶液取苯酚对照品适量,加水制成每1 mL中约含2.4 μg的溶液,作为对照品储备溶液;精密量取对照品储备溶液5 mL,置10 mL量瓶中,加水稀释至刻度,即得对照品溶液。
2.1.2 供试品溶液分别取注射用核糖核酸Ⅰ、Ⅱ、Ⅲ样品适量,加水溶解并稀释制成每1 mL中含20 mg的溶液,作为供试品溶液。
2.2 色谱条件一维色谱条件:采用ACQUITY UPLC BEH200 SEC(150 mm×4.6 mm,1.7 μm)色谱柱,以0.1 mol·L-1磷酸二氢钠溶液(pH 7.0)为流动相,流速0.2 mL·min-1,检测器为DAD,检测波长为267 nm,柱温30℃,进样量100 μL。二维色谱条件:采用Inertsil ODS SP(4.6 mm×250 mm,5 μm)色谱柱,以Agilent ZORBAX SB-Aq保护柱(4.6 mm×20 mm,5 μm)作为富集柱,以25%甲醇为流动相,流速1.0 mL·min-1,检测器为VWD,检测波长为267 nm,柱温30℃。阀切换时间为18~20.5 min。
按上述色谱条件测定,对照品溶液和供试品溶液的一维色谱图和二维色谱图见图 2。
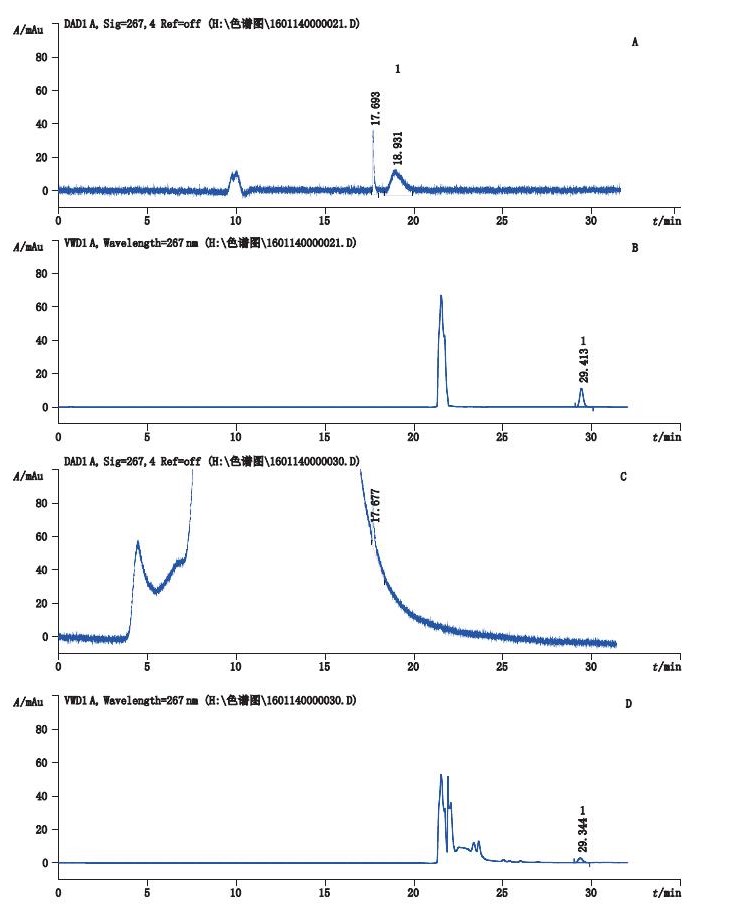
|
1.苯酚(phenol) A.对照品溶液一维色谱图(the first dimensional chromatogram of reference solution)B.对照品溶液二维色谱图(the second dimensional chromatogram of reference solution)C.注射用核糖核酸Ⅰ(批号1505011)供试品溶液一维色谱图[the first dimensional chromatogram of test solution of ribonucleic acid Ⅰfor injection(lot No.1505011)] D.注射用核糖核酸Ⅰ(批号1505011)供试品溶液二维色谱图[the second dimensional chromatogram of test solution of ribonucleic acid Ⅰfor injection(lot No.1505011)] 图 2 液相色谱图 Figure 2 Liquid chromatograms |
精密量取对照品储备溶液1、3、5、7和9 mL,分别置10 mL量瓶中,加水稀释至刻度,即得线性溶液L1~L5,照“2.2”项下色谱条件,分别注入液相色谱仪,记录色谱图,以苯酚的峰面积A为纵坐标,相应质量浓度C为横坐标,进行线性回归,得标准曲线方程:
| $\begin{array}{*{20}{c}} {A = 137.046C - 7.220}&{r = 0.999{\rm{ }}7} \end{array}$ |
结果表明,苯酚质量浓度在0.246 6~2.219 4 μg·mL-1范围内与峰面积呈良好线性。取线性溶液L1逐级稀释,进样测定,检测限(S/N=3.1)为12 ng·mL-1。
2.3.2 精密度、重复性试验取“2.1.1”项下对照品溶液,按上述色谱条件连续进样6次,结果苯酚峰面积的RSD为0.4%,表明仪器精密度良好;取注射用核糖核酸Ⅱ(批号B140119)6份,分别按“2.1.2”项下方法制备供试品溶液,进样测定,结果苯酚平均含量(n=6)为0.008%,RSD为0.8%。
2.3.3 回收率试验精密量取线性溶液L3、L4和L5各5 mL,分别置10 mL量瓶中,精密加入供试品溶液(样品批号1505011)5 mL,摇匀,制成低、中、高3个浓度的溶液,每个水平各3份,分别进样测定,回收率结果见表 1。
|
|
表 1 加样回收率试验结果 Table 1 The results of recovery test |
取供试品溶液按“2.2”项下色谱条件进样测定,以外标法计算苯酚含量,结果见表 2。
|
|
表 2 苯酚残留量测定结果 Table 2 The results of residual phenol contents |
采用反相高效液相色谱法[6-7]直接测定注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量的色谱图见图 3。一方面苯酚与核苷、核苷酸、小分子核糖核酸短片段性质相似,苯酚与周围干扰峰不能达到基线分离甚至其他峰在同一保留时间也有出峰,导致方法测定结果不准确,另一方面苯酚在核糖核酸主成分峰的拖尾处出峰,基线的影响导致苯酚的检测灵敏度低,方法的准确性差,测定其回收率低于80%,因此不能准确测定注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量。而气相色谱法[8-9]测定苯酚的检测限相对于液相色谱法要高几倍,不适于苯酚残留量的检测,且核苷、核苷酸、小分子核糖核酸短片段对苯酚测定也存在干扰。而二维液相色谱法的应用之一就是可以解决此类问题,在一维色谱中未分离开的组分可由接口转移到第二维色谱中继续进行分离,以达到完全分离准确测定的效果。因此本文探索了二维液相色谱法检测注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量,本法检测灵敏度高,可将苯酚从复杂组分中分离从而准确测定其残留。
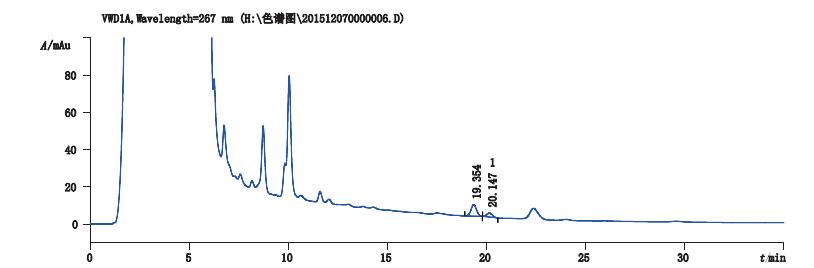
|
1.苯酚(phenol) 图 3 注射用核糖核酸Ⅰ(批号1505011)供试品溶液色谱图 Figure 3 HPLC chromatogram for the test solution of ribonucleic acid Ⅰfor injection(lot No.1505011) |
本文在原有液相色谱仪的基础上增加了另1个四元泵、1个检测器和1个内置了2位-六通阀的柱温箱,实现了在线二维液相色谱。而二维液相色谱方法的实现关键则在于找到适合样品分析的两维色谱柱,以及实现分子排阻色谱(SEC)和反相液相色谱(RPLC)这2种分离模式之间的转换。SEC和RPLC具有不同的分离能力,选择性差异大并且SEC与RPLC采用相互兼容的流动相,比较容易形成有效的二维分析方法。本文方法苯酚经第一维的SEC色谱柱分离后峰宽近2 min,洗脱体积近400 μL,如果使用样品环进行收集,会增加系统死体积同时容易造成第二维色谱柱过载,因此本文采用富集柱代替样品环对苯酚进行捕集,具体连接方式见图 1。第一维选择SEC柱将苯酚与核糖核酸主成分按照分子量大小进行初步分离,并确定苯酚的出峰位置的起始点和终止点,然后对苯酚和共流出的干扰物质进行中心切割,捕集完成后再通过阀切换将苯酚及共流出干扰物质冲洗至第二维反相柱进行分离检测。
3.3 富集柱的选择及阀切换时间采用富集柱方式的中心切割二维液相色谱方法,富集柱的选择至关重要,将直接影响到待测物的回收率以及分离效率。苯酚在富集柱上的保留不能太弱,否则在中心切割过程中苯酚直接被洗脱出去,造成回收率降低,必须保证苯酚在捕集柱上的保留时间大于苯酚在一维色谱上的峰宽。另一方面,苯酚在富集柱上的保留也不能太强,否则捕集后不易洗脱,峰形太宽。通过尝试多根色谱短柱后,最终选择了2 mm的ZORBAX SB-Aq保护柱。对于苯酚的保留大于3 min,阀切换时间为18~20.5 min,共2.5 min。从第一维液相切换到第二维液相的时候,由于两者的流动相不同等因素,会导致在阀切换刚开始的一段时间流出第一维流动相的色谱峰,例如图 2-B。而在图 2-D中除了上诉溶剂峰,还会存在所切片段中其他组分的色谱峰。
4 结论本文建立的二维液相色谱方法能用于注射用核糖核酸Ⅰ/Ⅱ/Ⅲ中苯酚残留量的检测,解决了共流出物和核糖核酸主成分峰拖尾对苯酚测定的干扰,提高了检测灵敏度,为复杂组分中检测低残留量的化学物质提供了一个新思路。
| [1] |
杨琳, 闫素志, 张金岩, 等. 注射用核糖核酸制备工艺的改进[J]. 中国生物制品学杂志, 2006, 19(4): 418. YANG L, YAN SZ, ZHANG JY, et al. Improvement of preparation technology of ribonucleic acid[J]. Chin J Biol, 2006, 19(4): 418. |
| [2] |
国家药品标准. 第十六册[S]. 2000: 97 The National Drug Standard. Vol 16[S]. 2000:97 |
| [3] |
国家药品标准. 第十六册[S]. 2002: 330 The National Drug Standard. Vol 16[S]. 2002:330 |
| [4] |
国家药品标准·第九册[S]. 2002: 126 The National Drug Standard. Vol 9[S]. 2002:126 |
| [5] |
中国药典2015年版. 四部[S]. 2015: 通则0861 ChP 2015. Vol Ⅳ[S]. 2015:General Chapter 0861 |
| [6] |
邱野, 李帅, 李婷婷, 等. 高效液相色谱法检测破伤风抗毒素注射液中苯酚残留量[J]. 中国生物制品学杂志, 2015, 28(11): 1198. QIU Y, LI S, LI TT, et al. Determination of residual phenol content in tetanus antitoxin injection by high performance liquid chromatography[J]. Chin J Biol, 2015, 28(11): 1198. |
| [7] |
廖海明, 吕海鸿, 徐康森. 骨肽注射液中苯酚含量的RP-HPLC法测定[J]. 药物分析杂志, 2005, 25(4): 397. LIAO HM, LÜ HH, XU KS. RP-HPLC determination of phenol in ossotide injection[J]. Chin J Pharm Anal, 2005, 25(4): 397. |
| [8] |
徐道华, 张红伟. 气相色谱法测定复方薄荷脑苯酚酊中薄荷脑和苯酚的含量[J]. 西北药学杂志, 2011, 26(6): 427. XU DH, ZHANG HW. Determination of the content of menthol and phenol in menthol phenol tincture by GC[J]. Northwest Pharm J, 2011, 26(6): 427. |
| [9] |
李英, 吴景武, 刘丽, 等. 顶空固相微萃取-气相色谱质谱法测定蜂蜜中的苯酚残留量[J]. 分析试验室, 2008, 27(2): 103. LI Y, WU JW, LIU L, et al. Determination of phenol residues in honey by headspace solid phase microextracion and gas chromatography-mass spectrometry[J]. Chin J Anal Lab, 2008, 27(2): 103. |
| [10] |
裘亚, 秦峰, 闻宏亮, 等. 在线二维液相色谱-四极杆飞行时间质谱法检测头孢噻吩钠的杂质谱[J]. 色谱, 2015, 33(12): 1314. QIU Y, QIN F, WEN HL, et al. Impurity profile study of cefalotin sodium by two-dimensional liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Chin J Chromatogr, 2015, 33(12): 1314. |
| [11] |
高辉, 温学森, 马小军, 等. 二维液相色谱技术在药物分析中的应用[J]. 药物分析杂志, 2007, 27(4): 616. GAO H, WEN XS, MA XJ, et al. The technique of two-dimensional liquid chromatography(2D-LC)and its applications in drug analysis[J]. Chin J Pharm Anal, 2007, 27(4): 616. |
| [12] |
戚绿叶, 颜琳琦, 张丽媛, 等. 二维液相色谱法测定保健食品中VA、VD3、VE的含量[J]. 中国卫生检验杂志, 2015, 25(3): 340. QI LY, YAN LQ, ZHANG LY, et al. Two-dimensional liquid chromatography method for the content determination of VA, VD3, VE in functional food[J]. Chin J Health Lab Technol, 2015, 25(3): 340. |
| [13] |
张智聪, 张庆合, 赵中一, 等. 二维液相色谱切换技术及其应用[J]. 分析化学, 2005, 33(5): 722. ZHANG ZC, ZHANG QH, ZHAO ZY, et al. The switching technique of two-dimensional liquid chromatography and its applications[J]. Chin J Anal Chem, 2005, 33(5): 722. |
| [14] |
王炼, 杨碧霞, 张新申, 等. 亲水交互作用-反相二维液相色谱-串联质谱同时测定乳制品中20中抗生素残留[J]. 分析化学, 2015, 43(5): 714. WANG L, YANG BX, ZHANG XS, et al. Simultaneous determination of twenty antibiotics residues in dairy using hydrophilic interaction chromatography-reversed phase two dimensional liquid chromatography-tandem mass spectrometry[J]. Chin J Anal Chem, 2015, 43(5): 714. DOI:10.11895/j.issn.0253-3820.140927 |
| [15] |
萧伟斌, 蹇阳, 李桦. 二维液相色谱在药物和毒物分析中的应用进展[J]. 分析化学, 2014, 42(12): 1851. XIAO WB, JIAN Y, LI H. Application of two-dimensional liquid chromatography analysis of drugs and toxicants[J]. Chin J Anal Chem, 2014, 42(12): 1851. |
 2017, Vol. 37
2017, Vol. 37 
