糖尿病是由于多种原因引起的胰岛素分泌不足和靶细胞对胰岛素敏感性降低而使人体代谢出现障碍的一种疾病,胰岛素是治疗糖尿病的主要药物。重组人/门冬胰岛素原料是利用基因工程手段把人胰岛素基因或人胰岛素类似物基因克隆到表达载体中利用基因工程菌进行发酵生产获得的产品。人胰岛素由51个氨基酸组成,有A和B两条链,A链含21个氨基酸残基,B链含30个氨基酸残基,2条链之间有2个二硫键相连,A链本身还有1个二硫键[1]。门冬胰岛素是将人胰岛素B链上的第28位脯氨酸改为天冬氨酸,由于其结构的改变,它比人胰岛素起效更早,达峰更快,半衰期更短,疗效上优于人胰岛素[2]。目前中国药典2015年版二部只收载了重组人胰岛素原料而未收载重组门冬胰岛素原料,重组人胰岛素原料各论里有外源性DNA残留量检查项[3]789。因宿主菌残留的DNA具有潜在的危害性,所以需要对重组人/门冬胰岛素原料中的残留DNA进行质量控制[4]。中国药典2015年版四部收载的宿主残留DNA检测方法有2种:第一法是DNA探针杂交法,第二法是荧光染色法[3]250。地高辛标记探针法不但操作烦琐,耗时较长而且无法进行定量分析,而荧光染色法也存在着特异性差灵敏度低的缺点[5-7]。现使用以SYBRGreen荧光染料为基础的荧光定量PCR法来检测重组人/门冬胰岛素原料中的宿主残留DNA量,该方法具有灵敏度高,准确性好,简便快速等优点,可用于酿酒酵母发酵生产的重组人/门冬胰岛素原料生产过程中的质量控制。
1 材料与方法 1.1 材料 1.1.1 供试品3批重组人胰岛素原料和3批重组门冬胰岛素原料均由本室留存。
标准基因组DNA:由重组人/门冬胰岛素宿主菌酿酒酵母菌经扩大培养后参考文献方法[8]进行提取,经微量紫外可见分光光度计测定浓度和纯度。
1.1.2 主要试剂及仪器宿主残留DNA提取试剂盒wako DNA Extractor kit购自Wako公司。2×PowerSYBR Green Master Mix购自ABI公司,微量紫外可见分光光度计NanoDrop购自Thermo公司,Stepone荧光定量PCR仪购自ABI公司。
1.2 方法 1.2.1 重组人/门冬胰岛素原料中宿主残留DNA的提取精密称取重组人/门冬胰岛素原料约4.5 mg,加入1×TE溶液约3 mL进行溶解制成1剂量·mL-1(1剂量=1.5 mg)的溶液,取不同批号的重组人/门冬胰岛素原料溶液按wako DNA extractor kit说明书提取样品中的残留DNA。
1.2.2 荧光定量PCR方法的建立及标准曲线的绘制利用酿酒酵母菌5sRNA的序列设计特异引物,上游引物序列为5′-TGCGGCCATATCTACC AGAAA-3′;下游引物序列为5′-GGCTCTTACCAGCTTAACTACAGTTGA-3′,引物序列委托Invitrogen公司合成。反应体系中各成分的加入量:上下游引物各10 μmol·L-1,各加入1 μL;2×PowerSYBRGreen Master Mix 10 μL,模板1 μL,超纯水7 μL,总体系20 μL。反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;72 ℃再次延伸5 min。取灭菌超纯水按10倍梯度稀释标准基因组DNA,质量浓度从0.137 8~137 800 ng·mL-1共7个浓度点,以各质量浓度的DNA为模板进行PCR扩增。以模板DNA质量浓度的对数值为横坐标(X),以Ct值为纵坐标(Y)绘制标准曲线,进行线性拟合,求出回归方程。每个浓度做3个复孔,每个样品亦做3个复孔。
1.3 方法学验证 1.3.1 引物特异性的验证按“1.2.2”项下方法进行PCR反应体系的扩增,扩增完毕之后做熔解曲线,如果没有杂峰则说明引物特异性较好同时退火温度比较合适。
1.3.2 准确性及精密性验证在批号为EMOH20401的重组人胰岛素和批号为DQ1AHP300的重组门冬胰岛素中分别加入13.78、1.378、0.689 ng的DNA标准品,采用DNA extractor kit提取总DNA后,进行荧光定量PCR检测,并按下述公式计算加标回收率(%),分析该方法的准确性。加标回收率=[(实际测定值-本底残留值)/加标值]×100%
1.4 方法应用用建立的荧光定量PCR方法对重组人/门冬胰岛素原料进行DNA残留量的检测,样品实际DNA残留量=样品测得值/平均回收率。
2 结果 2.1 DNA标准品的浓度及纯度经提取后测定,其质量浓度为137 800 ng·mL-1,纯度A260/A280为1.77。
2.2 荧光定量PCR线性回归方程线性回归方程:
| $\begin{array}{*{20}{c}} {Y = - 3.662{\rm{ }}4X + 45.902}&{r = 0.994} \end{array}$ |
表明Ct值与模板DNA浓度的对数值呈良好线性关系,线性范围0.137 8~137 800 ng·mL-1,定量限为0.137 8 ng·mL-1。
2.3 方法学验证 2.3.1 引物特异性的验证在荧光定量PCR扩增不同浓度的标准DNA做标准曲线时给荧光定量PCR仪设置熔解曲线步骤,实验结果证明除了主峰之外无杂峰,证明引物特异性良好,退火温度适当。熔解曲线见图 1。
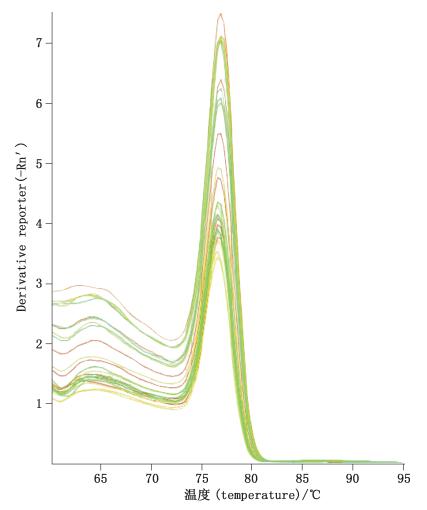
|
图 1 熔解曲线分析 Figure 1 Analysis of Melt Curve |
重组人/门冬胰岛素原料的加标回收率均在荧光定量PCR可接受的范围(50%~200%)内,不同浓度加标回收率的RSD均在20%以内,具体数据见表 1。
|
|
表 1 重组人/门冬胰岛素原料不同加标量样品的回收率(%) Table 1 The recovery of recombinant human/aspart insulin substances of different added amount of samples |
检测结果显示,重组人/门冬胰岛素原料的DNA残留量远低于10 ng·剂量-1,符合进口药品注册标准的相关要求,结果见表 2。
|
|
表 2 重组人/门冬胰岛素原料中DNA残留量的测定结果 Table 2 Determination of residual host cell DNA content in recombinant human/aspart insulin substances |
细胞基质作为主要原材料其质量的好坏直接影响生物制品的产量和质量。一般认为细胞基质存在的潜在危险因素主要有促生长蛋白及宿主残留蛋白、宿主残留DNA和潜在病毒。其中宿主残留DNA一直是人们关注的焦点。因为其可能有潜在的致瘤性、感染性以及参与人体的代谢[9]。
在酿酒酵母细胞中,5sRNA基因以100~200个串联重复序列排列在第12号染色体上。这些5sRNA基因序列非常保守,在长期进化过程中保持序列恒定[10]。基因的多拷贝数使其容易被检出,同时序列的保守性使设计的引物更有特异性,容易进行其种属鉴别。本研究利用酿酒酵母菌的5sRNA为序列设计特异性引物然后通过基于SYBRGreen染料的荧光定量PCR最终根据荧光信号的强度来确定重组人/门冬胰岛素原料中宿主DNA残留量。
目前中国药典2015年版四部收载的外源性DNA残留测定方法有2种,分别是DNA探针杂交法和荧光染色法,两者都存在灵敏度低,操作烦琐,耗时较长等缺点[11-12]。荧光定量PCR则具有灵敏度高、准确、快速等优点,是实现生物制品中残留DNA测定的最佳方法[13]。目前国内定量PCR方法尚无统一的验证接受标准,有参考文献[14]报道,因PCR产物的量呈2n增长,每增加1个循环产物量即在原有的基础上增加1倍,因此回收率的计算应按照理论值±2n倍进行评价,通常最大可接受回收率标准应设定在理论值±21倍,即±1个循环(50%~200%)[15]。而USP 39的general chapters中 < 1130 > 则明确规定一般条件下加样回收率应在80%~120%范围内,如果由于基质效应或样品前处理方法导致回收率不在上述范围内,则用回收率结果进行样品残留DNA数值的校正。通过实验发现,重组人/门冬胰岛素的回收率结果绝大部分不在80%~120%范围内,因此计算样品中DNA残留量时用回收率进行了校正。
宿主残留DNA属于微量杂质,测定时存在干扰因素多的困难。在实验过程中作者采用了未经任何前处理直接扩增,加蛋白酶K消化并灭活,磁珠提取试剂盒和wako DNA提取试剂盒共4种前处理方法。实验结果证明,未经任何前处理直接扩增则样品溶液抑制PCR的反应,因为其扩增曲线不是典型的扩增曲线,而蛋白酶K消化并灭活后发现加标样品均无扩增,证明蛋白酶K的加入即使高温灭活后依然严重抑制PCR反应。磁珠提取试剂盒虽然能够有效地从样品中提取微量的宿主残留DNA,而且其加标回收率也在50%~200%范围内,但它对操作者要求较高,尤其在清洗磁珠的时候需要极其小心,因为一不小心就容易吸走磁珠造成损失,导致结果不准确,而且磁珠提取方法不如wako DNA提取试剂盒方法更适用于大批量样品的检验。因此作者倾向于选择wako公司生产的DNA提取试剂盒。经实验,3批重组人胰岛素原料和3批重组门冬胰岛素原料中的残留DNA量均远远低于10 ng·剂量-1的标准,符合该品种进口药品注册标准的要求。综上所述,本文建立的检测方法可作为酿酒酵母产重组人/门冬胰岛素原料中宿主残留DNA测定的常规检测方法。
| [1] |
姜宁, 吕晔, 陈执中. 重组人胰岛素类似物的研究应用进展[J]. 食品与药品, 2012, 14(11): 445. JIANG N, LÜ Y, CHEN ZZ. Progress on study and application of recombinant human insulin analogues[J]. Food Drug, 2012, 14(11): 445. DOI:10.3969/j.issn.1672-979X.2012.11.029 |
| [2] |
赵红峰, 刘幼硕, 黄武, 等. 门冬胰岛素与人普通胰岛素在老年2型糖尿病胰岛素泵治疗中的疗效比较[J]. 中国老年学杂志, 2009, 16(29): 2010. ZHAO HF, LIU YS, HUANG W, et al. Comparison between the effects of insulin aspart and Novolin R via continuous subcutaneous insulin infusion pump on hyperglycemia in elderly patients with type 2 diabetes[J]. Chin J Gerontol, 2009, 16(29): 2010. |
| [3] |
中国药典2015年版. 四部[S]. 2015: 789, 250 ChP 2015. Vol Ⅳ[S]. 2015: 789, 250
|
| [4] |
WANG L, WANG JZ. Issue on quality control of residual DNA in biological products[J]. Chin J New Drugs, 2011, 20(8): 678. |
| [5] |
王兰, 高凯, 毕华, 等. 荧光法和DNA杂交法检测重组技术产品中残余DNA的比较[J]. 药物分析杂志, 2009, 29(7): 1063. WANG L, GAO K, BI H, et al. Comparison between fluorescence and DNA hybridization methods for determineng residual DNA in recombinant products[J]. Chin J Pharm Anal, 2009, 29(7): 1063. |
| [6] |
刘晓志, 高健, 赵伟, 等. Pichia酵母宿主细胞DNA残留量检测方法的建立[J]. 河北师范大学学报, 2012, 36(1): 80. LIU XZ, GAO J, ZHAO W, et al. Development of a method for determination of residual DNA in Pichia pastoris host cells[J]. J Hebei Norm Univ, 2012, 36(1): 80. |
| [7] |
黄相红, 胡立德, 梁文璐, 等. 地高辛标记探针检测重组人p43蛋白宿主DNA残留量的研究[J]. 药物分析杂志, 2011, 31(2): 356. HUANG XH, HU LD, LIANG WL, et al. Testing for residual DNA in recombinant human p43 protein using digoxin labled probe[J]. Chin J Pharm Anal, 2011, 31(2): 356. |
| [8] |
卢鑫, 张会彦, 亢春雨, 等. 马克思克鲁维酵母DNA提取方法的比较[J]. 食品科技, 2009, 34(4): 31. LU X, ZHANG HY, KANG CY, et al. Comparison of methods of DNA extraction from Kluyveromyces marxianus[J]. Food Sci Technol, 2009, 34(4): 31. |
| [9] |
王兰, 王军志. 关于生物制品残留DNA质量控制问题[J]. 中国新药杂志, 2011, 20(8): 678. WANG L, WANG JZ. Issue on quality control of residual DNA in biological products[J]. Chin J New Drugs, 2011, 20(8): 678. |
| [10] |
PIPER PW, LOCKHEART A, PATEL N. A minor class of 5 s rRNA genes in saccharomyces cerevisiae X2180-1B, one member of which lies adjacent to Ty transposable element[J]. Nucleic Acids Res, 1984, 12(10): 4083. DOI:10.1093/nar/12.10.4083 |
| [11] |
刘晶晶, 郭莹莹, 李艳琪, 等. 荧光定量PCR检测重组新蛭素中毕赤酵母基因组DNA的残留量[J]. 生物技术通讯, 2014, 25(3): 401. LIU JJ, GUO YY, LI YQ, et al. Determination of residual Pichia yeast genomic DNA in recombinant neorudin by real-time quatitative PCR[J]. Lett Biotechnol, 2014, 25(3): 401. |
| [12] |
曹晨华, 刘晓志, 段月娇, 等. 实时定量PCR法检测生物技术药物中宿主基因组DNA残留[J]. 生物技术进展, 2014, 4(2): 142. CAO CH, LIU XZ, DUAN YJ, et al. Detecting residual host genomic DNA in biotech drugs by real-time quantitative PCR[J]. Curr Biotechnol, 2014, 4(2): 142. |
| [13] |
MEHTA S, KEER JT. Performance characteristics of host-cell DNA quantification methods[J]. Bioprocess Tech, 2007, October: 44. |
| [14] |
GIJSBERS L, KOEL B, WEGGEMAN M, et al. Quantification of residual host cell DNA in adenoviral vectors produced on PER. C6 cells[J]. Hum Gene Ther, 2005, 6(3): 393. |
| [15] |
牛冬云, 连炜, 何静, 等. 康柏西普制品中CHO细胞DNA残留量的检测[J]. 中国生物制品学杂志, 2013, 26(7): 1023. NIU DY, LIAN W, HE J, et al. Determination of residual CHO cell DNA in conbercept[J]. Chin J Biol, 2013, 26(7): 1023. |
 2017, Vol. 37
2017, Vol. 37 
