2. 国家食品药品监督管理总局, 北京 100050
2. China Food and Drug Administration, Beijing 100050, China
黄曲霉毒素(aflatoxins)是二氢呋喃香豆素的一类衍生物质,主要在湿热的环境下,由黄曲霉和寄生曲霉产生,此外在一定条件下,曲霉属的黑曲霉、灰绿曲霉、赭曲霉等,青霉属的桔青霉、展青霉、指状青霉等,毛霉,镰孢霉,根霉,链霉菌等也能产生黄曲霉毒素。该类毒素[1-2]已鉴定出包括黄曲霉毒素B1、B2、G1、G2、M1、M2、P1、Q、H1、GM、B2a和毒醇等20余种物质,其中常关注的黄曲霉毒素主要有4种,即黄曲霉毒素B1、B2、G1、G2,其中黄曲霉毒素B1被认为是主要的有毒物质,1993年世界卫生组织已将该类物质划为1类致癌物,有证据显示可对人及动物肝脏组织产生破坏,严重可导致肝癌甚至死亡。黄曲霉毒素B1主要存在于粮油污染、大米、小麦、坚果、乳等农产品中,另外由于饲料的污染,也会移行到动物体内,摄入黄曲霉毒素B1后在体内经羟基化代谢的产物,一部分从尿和乳汁排出,一部分存在于动物的可食部分,如乳、肝、蛋类、肾、血和肌肉中,其中以乳最为常见。另外,研究发现黄曲霉毒素B1、B2等毒素经过代谢后还产生黄曲霉毒素M1和M2等代谢产物。黄曲霉毒素M1的毒性和致癌性与黄曲霉毒素B1的基本相似,由于乳及其制品是人类、特别是婴儿的主要食品,因此对相关毒素和代谢产物的检测和监测,可以为尽早发现风险提供预警数据[2]。常用测定黄曲霉毒素[3-6]的方法有薄层色谱法、高效液相色谱法、微柱法、酶联免疫吸附法、免疫亲和净化荧光分光光度法以及金标免疫层析等。其中高效液相色谱法主要通过提取、净化、衍生化、测定等步骤,在GB 5413.37-2010《食品安全国家标准乳和乳制品中黄曲霉毒素M1的测定》[7]主要利用免疫亲和柱进行净化,再利用荧光检测或者质谱检测,但是,由于操作步骤较为烦琐,因此对目标物的回收率影响较大,直接造成了测定结果的准确性,一般在微量或者痕量水平,其回收率为70%~80%,某些情况会在60%左右。其他文献显示[8-17],在检测过程中方法主要针对的都是游离状态的黄曲霉毒素。本文建立了简单地针对牛奶及乳粉中黄曲霉毒素M1的测定方法,并与国家标准方法[7]进行了比较,方法较为简单,回收率可实现90%以上,同时由于现有标准方法中没有考虑黄曲霉毒素M1结合物的状态,可能会存在漏检的情况,本研究对这一现象也进行了探讨。
1 实验材料Xevo TQ-S超高效液相色谱-三重四极杆质谱仪及Masslynx质谱软件(Waters公司);ACQUITY UPLC HSS T3(2.1 mm×50 mm,1.8 μm;填料:十八烷基硅烷键合硅胶;WATERS公司);KQ-700DE型超声波清洗器(昆山市超声仪器有限公司);CF16RXII离心机(HITACHI公司);Microsep Advance 20 mL,3 kDa超滤离心管(Pall公司);黄曲霉毒素M1(批号10141,Romer公司),免疫亲和柱(Romer公司);试剂甲酸为分析纯,乙腈为质谱级。实验所用水均为Milli-QIntegral 3纯水机制备的超纯水(电阻率18.2 MΩ·cm)。样品为市售鲜奶、全脂奶粉各3份,另牛奶质控样品1份[经多家实验室协作测试,均值为(3.03±0.70)μg·kg-1],乳粉阳性样品1份[检测均值为(1.00±0.25)μg·kg-1]。
2 实验部分 2.1 色谱-质谱条件色谱柱:WATERS ACQUITY UPLC HSS T3(2.1 mm× 50 mm,1.8 μm);流动相:0.1%(v/v)甲酸水溶液(A)-乙腈(B),梯度洗脱(0.0~5.0 min,100% A;5.1~7.0 min,90%B;7.1~8.5 min,100%A);流速:0.3 mL·min-1;柱温:室温;进样量:3 μL;分析时间:9 min。
离子化模式:电喷雾正离子模式(ESI+);扫描模式:MRM多离子反应监测;毛细管电压:3.2 kV;锥孔电压:40 V;离子源温度:150 ℃;偏转电压:70 V;锥孔气流量:150 L·h-1;脱溶剂气温度:500 ℃;脱溶剂气流量:1 000 L·h-1;定量离子对:m/z 329.0 > 273.5(碰撞能量20 V);定性离子对:m/z 329.0 > 259.5(碰撞能量25 V)。
2.2 样品前处理 2.2.1 方法1取黄曲霉毒素M1的样品(牛奶或乳粉),按GB 5413.37-2010《食品安全国家标准乳和乳制品中黄曲霉毒素M1的测定》的“6.1”及“6.2”项下方法提取净化处理后,备用。
2.2.2 方法2牛奶:称取5 g(精密称定至0.01 g)混匀的样品,置于50 mL具塞离心管中,加入甲酸3 mL,37 ℃水浴加热10 min,加入乙腈10 mL,放置10 min,8 000 r·min-1离心20 min后,取上清液于50 mL量瓶中,以乙腈-水(70:30)稀释定容至50 mL,备用。乳粉:称取5 g(精密称定至0.01 g)样品,置于250 mL烧杯中,加入温水20 mL,溶解混匀,加入甲酸10 mL,37 ℃水浴加热10 min,加入乙腈15 mL,放置10 min,定量转移至50 mL离心管中,8 000 r·min-1离心20 min后,转移上清液于100 mL量瓶中,以乙腈-水(70:30)稀释定容至100 mL,备用。
2.3 空白基质溶液的配制取黄曲霉毒素M1阴性的样品(牛奶或乳粉),按“2.2”项方法制备空白基质溶液。
2.4 系列对照品溶液的制备取黄曲霉毒素M1对照品适量,参考GB 5413.37-2010《食品安全国家标准乳和乳制品中黄曲霉毒素M1的测定》的系列浓度0.5、0.8、1.0、2.0、4.0、6.0、8.0 ng·mL-1,以甲醇及空白基质溶液分别配制溶剂对照品溶液和基质匹配对照品溶液。
2.5 空白试验不称取样品,按照“2.2”项下步骤操作,进行空白试验,未见干扰检测的物质出现。
3 方法学考察 3.1 标准曲线的比较研究比较了“2.2”项下处理方法1及方法2,通过2种方法分别制备空白基质溶液,配制基质匹配对照品溶液进行标准曲线的制作,同时配制以甲醇溶剂直接溶解获得的溶剂对照品溶液制作标准曲线,并比较两类标准曲线的差异。在线性范围内相关系数均在0.999以上,结果表明,以处理方法1及方法2制得的基质匹配对照品溶液所制作的标准曲线,在各自线性范围内的斜率值,采用方法2制得的基质匹配对照品溶液所制作的标准曲线较采用溶剂制备的溶剂对照品溶液制作的标准曲线的斜率值小大约30%,采用方法1制得的基质匹配对照品溶液所制作的标准曲线较采用溶剂制备的溶剂对照品溶液获制作的标准曲线的斜率值小大约20%左右,在整个线性范围内,按照各点的测定残差评价,实际曲线会产生弯曲,整个线性范围拟合的相关系数不能很好地判断出线性关系,在低浓度,当采用处理方法1和方法2制备基质匹配对照品溶液时均需要制订小范围的线性关系用于准确计算;其中采用方法1的范围为0.0~30 μg·kg-1,采用方法2范围为0.01~20 μg·kg-1,在上述范围内,拟合曲线获得结果较为准确。
3.2 线性关系按“2.2.1”和“2.2.2”的方法1及方法2分别制备的2套系列基质匹配对照品溶液,进样测定;分别以各分析物的峰面积(y)和对应的质量浓度(X,μg·kg-1)进行线性回归计算,得到的线性方程和相关系数(表 1)。采用方法1和方法2的牛奶及乳粉线性范围均为0.01~500 μg·kg-1。黄曲霉毒素M1在线性范围内按照常规判断均呈现良好的线性关系(r=0.999)。但是以上所述按照残差分析可以看到,二者均存在两段式线性关系。
|
|
表 1 黄曲霉毒素M1的线性方程、相关系数、线性范围 Table 1 Regression equations, correlation coefficients, linear ranges of aflatoxin M1 |
取以方法1及方法2分别制备的基质匹配对照品溶液适量,分别用空白基质溶液稀释后测定,以信噪比(S/N)为3时对应的溶液浓度为方法检出限,以信噪比(S/N)为5~10时对应的溶液浓度为方法定量限,以实际可鉴别信号(即目视法)为准。见表 2。
|
|
表 2 黄曲霉毒素M1的检出限和定量限(n=5) Table 2 LOD and LOQ for of aflatoxin M1 |
取阴性牛奶和乳粉,分别添加3个水平的对照品溶液之后,按照“2.2”中方法1及方法2的步骤进行提取制备,分成两组系列加标回收待测液,以供比较采用方法1和方法2的提取回收率。加标水平分别为0.05、0.5、1.5 μg·kg-1;每个加标水平平行制备6次进行测定,以便评价方法准确度。该方法的平均加标回收率和相对标准偏差(RSD)结果表明:采用方法1,牛奶中3个水平的回收率在75%~85%,RSD为10%~17%(n=6);乳粉中3个水平的回收率在70%~83%,RSD为10%~20%(n=6);采用方法2,牛奶中3个水平的回收率在90%~95%,RSD为8%~15%(n=6);乳粉中3个水平的回收率在91%~93%,RSD为8%~16%(n=6)。所得结果均可以满足日常样品分析要求,但是方法2由于步骤较少,明显回收率结果较好。
3.5 稳定性和日内、日间精密度进行样品稳定性和日间精密度的检查。采用回收率实验中配制的3个浓度水平,通过处理方法1和方法2制得供试溶液,分别于0、1、2、4、10、15、24、48和72 h进行测定,结果表明供试溶液均可以在72 h内保持稳定。方法1:0.05、0.5、1.5 μg·kg-13个浓度水平,日内精密度试验(1 d内2次)的峰面积的RSD在10%~20%(n=5)之间,日间精密度试验(连续2 d)的峰面积的RSD在10%~15%(n=5)之间。方法2:3个浓度水平,日内精密度试验(1 d内2次)的峰面积的RSD在8%~16%(n=5)之间,日间精密度试验(连续2 d)的峰面积的RSD在10%~15%(n=5)之间。
4 实际样品测定依法处理市售牛奶、乳粉及质控样品,进行测定,测定结果显示采集的市售牛奶和乳粉中均未检出黄曲霉毒素M1,牛奶质控样品(3.03±0.70)μg·kg-1,采用方法1得到的值为(2.91±0.12)μg·kg-1(n=5),采用方法2得到的值为(3.05±0.08)μg·kg-1(n=5);乳粉阳性样品如上所述,采用方法1得到的值为(0.92±0.05)μg·kg-1(n=5),采用方法2得到的值为(1.10±0.02)μg·kg-1(n=5)。从检测结果可以看到,牛奶质控样品虽然是通过添加方式制备的,但是基体中的蛋白还是可能会与黄曲霉毒素M1形成配合物或者结合物,如采用方法1可能会存在漏检的现象。
5 讨论 5.1 方法2中提取条件的选择和优化牛奶及乳粉中存在大分子蛋白质、脂肪、糖及其他分子物质,对于检测主要的干扰来自于上述物质,在进行条件选择时,考虑了相关物质的清除效率,同时也考察了相关物质共存的干扰,对于牛奶及乳制品,主要的干扰源来自于蛋白质的影响,而脂质成分在相关转移稀释中影响较小,其中包括可能吸附和配合物的形成在结果显示上均没有较大的影响。而在相关的国家标准中样品处理,即方法1,没有考虑蛋白质结合黄曲霉毒素的影响,某种程度上检测的是游离、弱结合状态或者未包埋情况下的黄曲霉毒素,研究发现,除加温外,加大基体酸的含量,可以有效地游离出处于结合或者配合状态的黄曲霉毒素,相关的检测可以发现,本次实验在方法2通过加酸量的比较,在对应制备情况下,可以有效地释放出黄曲霉毒素M1。在乳阳性样品的检测中,采用方法1得到(0.92±0.05)μg·kg-1(n=5),回收率75%;方法2得到(1.10±0.02)μg·kg-1(n=5),回收率93%;再比较多家均值结果(1.00±0.25)μg·kg-1(n=10),回收率在70%~85%之间,结果存在不同。由于该阳性结果均值的获得是基于方法1,因此说明在阳性样品检测时,可能的黄曲霉毒素M1的结合状态影响了物质的检出,同时,方法的回收率说明了现有国标方法存在物质损失。
5.2 空白基质溶液的日常处理为便于日常检测,对于空白基质溶液,考虑到可能存在黄曲霉毒素的污染,同样摸索了针对未知样品检测时的处理方法,即样品在上述处理过程中,同时加入少量的碳酸氢钠,以消除未知样品中可能存在的微量黄曲霉毒素。通过微量加标的方式进行了验证,表明在少量碳酸氢钠存在的情况下,可以消除微量黄曲霉毒素,另通过添加的方式进行了基质抑制率的评价,结果显示上述处理获得的空白样品抑制率为30%~35%,与实际检测样品的抑制率相似,说明处理方式不带来额外的离子抑制。在利用未知样品进行空白制备时,加入甲酸的量需要进行调整,以消除少量碳酸氢钠的影响。一般而言,在牛奶或乳粉中添加1 μg·kg-1水平的黄曲霉毒素M1,对应5 g样品中加入0.005 g碳酸氢钠固体,样品处理中增加0.5 mL甲酸进行中和。
5.3 方法间的差异方法比较了免疫亲和色谱净化富集和酸提取方法之间的差异,可以看到2种处理方法均满足测定要求,但是回收率水平上,方法2存在较好的优势,在重复性测定计算阳性样品的平均回收率,校准后,可以发现,实测水平下,以方法1及方法2进行样品处理的的结果存在一定的差异。为研究可能的毒素与蛋白配合关系,将阴性牛奶和奶粉进行已知量添加后,如法处理,分别测定,并进行回收率校准后,可以看到采用方法2较采用方法1在重复性接近一致的水平上(95%置信水平),由方法2处理样品的测定值高于由方法1处理样品的测定值,具有显著性差异,说明黄曲霉毒素M1存在与蛋白质之间的吸附或者配合作用,而方法1则不能完全地反映出基质和黄曲霉毒素M1之间兼容性的情况。根据不同添加水平的研究,可以看到这种现象在高浓度水平(1 μg·kg-1以上),结果反映较为明显。按照现有的结果,进行结合率的初步计算,可以看到表观的结合率在5%~10%范围波动,提示现有免疫亲和的方法需要考虑样品提取步骤的全面性。
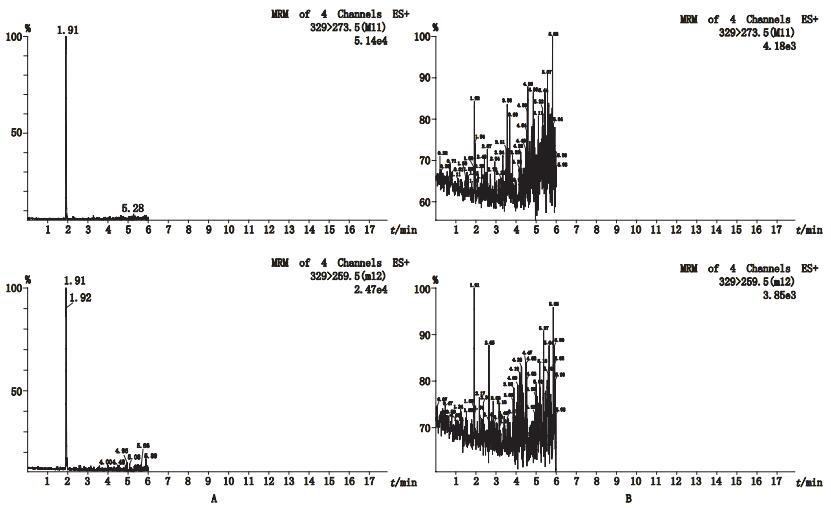
5.4 质谱条件的选择质谱条件的选择对于2个处理方法获得供试溶液基本一致,采用方法2的离子抑制率大于方法1的离子抑制率,这是由于净化效果上,方法2减少了步骤,存在较多共存物质的干扰,但是在响应强度上,2个方法得到的离子响应水平接近,采用基质空白的检测方式,可以较好地消除基质干扰的影响。图 1显示了牛奶按照方法2处理后,基质添加标准物质(0.5 μg·kg-1)及检出限(添加,0.01 μg·kg-1)分离情况和测定结果。
|
A.0.5μg·kg-1 B. 0.01μg·kg-1 tR=1.9 min 图 1 黄曲霉毒素M1对照品溶液(A)和检出限(B)MRM色谱图 Figure 1 Chromatograms of reference substance solution of aflatoxin M1 (A) and its detection limit(B) in MRM mode |
方法比较的结果显示,经过较高浓度酸进行提取的过程可以满足一般检测,但是考虑到样品所含宏观物质和微观物质的干扰,免疫亲和净化仍然是测定黄曲霉毒素的一个较好方法,如果对国标中提取步骤进行改进,使相关毒素可以有效释放,将提高检测的准确性,并可以有效地对相关产品中黄曲霉毒素的代谢产物进行测定。
| [1] |
AKIYAMA H, GODA Y, TANAKA T, et al. Determination of aflatoxins B1、B2、G1 and G2 in spices using a multifunctional column clean-up[J]. J Chromatogr A, 2001, 932(1-2): 153. DOI:10.1016/S0021-9673(01)01211-0 |
| [2] |
王君, 刘秀梅. 部分市售食品中总黄曲霉毒素污染的监测结果[J]. 中华预防医学杂志, 2006, 40(1): 33. WANG J, LIU XM. Surveillance on contamination of total aflatoxins in corn, rice, walnut and pine nut in several areas in China[J]. Chin J Prev Med, 2006, 40(1): 33. |
| [3] |
江湖, 熊勇华, 许杨. 黄曲霉毒素分析方法研究进展[J]. 卫生研究, 2005, 34(3): 252. JIANG H, XIONG YH, XU Y. Research progress in analysis methods of aflatoxins[J]. J Hyg Res, 2005, 34(3): 252. |
| [4] |
AYCICEK H, AKSOY A, SAYGI S. Determination of aflatoxin levels in some dairy and food products which are consumed in Ankara, Turkey[J]. Food Control, 2005, 16(3): 263. DOI:10.1016/j.foodcont.2004.03.004 |
| [5] |
ZHANG XH, LIU HL, CHEN JM. Immunoaffinity column cleanup with liquid chromatography using post-column bromination for aflatoains in medicinal herbs and plant extract[J]. J Chromatogr Sci, 2005, 43(1): 47. DOI:10.1093/chromsci/43.1.47 |
| [6] |
王晶, 王林, 黄晓蓉. 食品安全快速检测技术[M]. 北京: 化学工业出版社, 2002, 92. WANG J, WANG L, HUANG XR. Food Safety Rapid Detection Technology[M]. Beijing: Chemical Industry Press, 2002, 92. |
| [7] |
GB 5413. 37-2010乳和乳制品中黄曲霉毒素M1的测定[S]/食品安全国家标准. 2010 GB 5413. 37-2010 National food standard determination of aflatoxin M1 in milk and milk products[S]/National Food Safety Standards. 2010 |
| [8] |
LIANG J, SONG XY, ZHU JH, et al. Suitability analysis of tolerance limit for aflatoxin M1 in foods and Chinese population dietary exposure to aflatoxin M1 from milk[J]. Hyg Res, 2013, 42(5): 19. |
| [9] |
NICHOLAS WT, SCREENATH S, SERGEY AP. Analytical methods for determination of mycotoxin:a review[J]. Anal Chim Acta, 2009, 632(2): 168. DOI:10.1016/j.aca.2008.11.010 |
| [10] |
WAN S, ZHU X, LIANG LM, et al. The more common method for detection of aflatoxin M1 in milk[J]. Hubei Anim Husb Vet Med, 2013, 34(6): 78. |
| [11] |
DING J, LI PW, LI GM, et al. Determination of aflatoxin M1 in milk by high performance liquid chromatography using on-line solid phase extraction[J]. Food Sci, 2013, 4(10): 289. |
| [12] |
BEHFAR A, NAZARI KHORASGANI Z, ALEMZADEH Z, et al. Determination of aflatoxin M1 contamination levels in produced pasteurised milk manufactory in Ahvaz city by HPLC[J]. Toxicol Lett, 2010, 196(s17): 329. |
| [13] |
ZHU QH, XU CY, LIU Y, et al. Determination of aflatoxin M1 of milk and milk powder by fluorescence analysis -immunoaffinity column[J]. Inspect Quarant Sci, 2003, 13(2): 41. |
| [14] |
KAV K, COL R, KAAN TK. Detection of aflatoxin M1 levels by ELISA in white-brined Urfa cheese consumed in Turkey[J]. Food Control, 2011, 22(12): 1883. DOI:10.1016/j.foodcont.2011.04.030 |
| [15] |
PARKER CO, LANYON YH, MANNING M, et al. Electrochemic-alimmunochip sensor for aflatoxin M1 detection[J]. Anal Chem, 2009, 81(13): 5291. DOI:10.1021/ac900511e |
| [16] |
BOGNANNO M, FAUCI LL, RITIENI A, et al. Survey of theo ccurrence of aflatoxin M1 in ovine milk by HPLC and its confirmation by MS[J]. Mol Nutr Food Res, 2006, 50(3): 300. DOI:10.1002/(ISSN)1613-4133 |
| [17] |
YU XJ, WANG H, YANG HM, et al. Simultaneous determination of seven kinds of toxic and prohibited substances residues in infant milk powder by LC-MS/MS[J]. Food Res Dev, 2015, 36(4): 133. |
 2017, Vol. 37
2017, Vol. 37 
