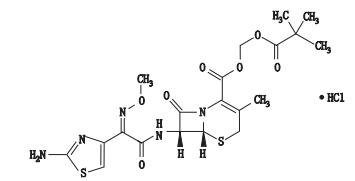
盐酸头孢他美酯(图 1)为第3代口服头孢菌素,对大多数革兰氏阳性和阴性菌均有较好的抗菌活性。该药为头孢他美酯化物,口服后经肠壁脂酶水解成有活性的头孢他美[1-2]。头孢他美对链球菌、淋球菌、黏膜布兰球菌、流感嗜血杆菌、大肠杆菌、肺炎杆菌及变形杆菌均有较好抗菌作用,对多种β-内酰胺酶稳定[3]。盐酸头孢他美酯及片剂、胶囊剂、干混悬剂均收载于中国药典2015年版(ChP 2015)[4],而盐酸头孢他美酯分散片现行标准为局颁标准(YBH05022010、YBH05552008)[5-6]。其标准中有关物质检查方法均采用HPLC法,但在流动相组成、检测波长等方面均有较大的差异。盐酸头孢他美酯为2013年国家评价性抽验品种,试验中发现,盐酸头孢他美酯分散片不合格样品的不合格项目为有关物质检查,因此本文在已有标准的基础上建立了新的HPLC法,检测出了10个有关物质,并通过质谱联用技术对有关物质进行结构鉴定,可为盐酸头孢他美酯分散片的生产工艺和质量控制提供参考依据。
|
图 1 盐酸头孢他美酯结构图 Figure 1 The structure of cefetamet pivoxil hydrochloride |
Waters 2695高效液相色谱仪,2998二极管阵列检测器;Waters XEVO G2 Q-TOF液相质谱联用仪;资生堂CAPCELL PAK C18(4.6 mm×250 mm,5 μm)色谱柱;菲罗门CAPCELL CORE C18(2.1 mm×100 mm,2.7 μm)色谱柱;XD205DU电子天平(梅特勒公司,0.1 mg)。
头孢他美酯对照品(中国食品药品检定研究院;批号:130512-201202;按头孢他美计含量为70.2%);头孢他美酸(自制:将AE活性酯与7-ADCA反应缩合而成;批号:130827;面积归一化法测定含量大于97.0%);盐酸头孢他美酯原料(浙江普洛康裕制药有限公司;批号:KY-CE-M20121105);盐酸头孢他美酯分散片(山东罗欣药业股份有限公司,样品① 批号6122022014、样品② 批号612122007、样品③ 批号613052022,规格以头孢他美计为90.65 mg·片-1;成都倍特药业有限公司,样品④ 批号150501、样品⑤ 批号150706、样品⑥ 批号150902,规格以头孢他美计为181.3 mg ·片-1)。甲醇、乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
2 实验方法 2.1 HPLC-UV测定采用资生堂CAPCELL PAK C18(4.6 mm×250 mm,5 μm)色谱柱,以0.005 mol·L-1四丁基氢氧化铵溶液(用磷酸调节pH至4.5) 为流动相A,乙腈为流动相B,梯度洗脱(0 min,70%A;10 min,70%A;40 min,35%A;50 min,35%A;51 min,70%A;60 min,70%A),流速1.0 mL·min-1,柱温30 ℃,检测波长232 nm,进样量10 μL。
2.2 LC-TOF/MS测定采用资生堂CAPCELL CORE C18(2.1 mm×100 mm,2.7 μm)色谱柱,以10 mmol·L-1醋酸铵溶液为流动相A,甲醇-乙腈(50:50) 为流动相B,梯度洗脱(0 min,80%A;3 min,80%A;22 min,30%A;45 min,30%A;46 min,80%A;60 min,80%A),流速0.2 mL·min-1,柱温30 ℃,进样量2 μL;质谱参数:采用ESI离子源,正离子全扫描方式,扫描范围m/z 100~1 200,扫描时间0.3 s,喷雾电压2.5 kV,锥孔电压25 V,去溶剂温度500 ℃,去溶剂气体(N2)流速800 L·h-1。
2.3 溶液的制备 2.3.1 有关物质供试品溶液取分散片10片,精密称定,研细,精密取细粉适量(约相当于头孢他美0.1 g),置100 mL量瓶中,加适量乙腈溶液(9→20) 溶解并稀释至刻度,摇匀,过滤,取续滤液,即得。
2.3.2 有关物质对照溶液精密量取有关物质供试品溶液1 mL,置50 mL量瓶中,加乙腈溶液(9→20) 定容,摇匀,即得。
2.3.3 影响因素溶液取盐酸头孢他美酯分散片分别在高温(60 ℃)、高湿(75%,25 ℃)和光照(4 500 lx)等条件下放置10 d后,按供试品溶液的配制方法配制相应的溶液即得。
2.3.4 强制降解溶液取盐酸头孢他美酯分散片粉末适量(约相当于头孢他美0.1 g)置100 mL量瓶中,分别进行强酸(0.1 mol·L-1盐酸1 mL,60 min)、强碱(0.1 mol·L-1氢氧化钠溶液1 mL,30 min)和强氧化(10%过氧化氢溶液1 mL,30 min)破坏,分别进行酸碱中和后再加乙腈溶液(9→20) 溶解并稀释至刻度,摇匀,即得。
2.3.5 系统适用性溶液取头孢他美酸和头孢他美酯的对照品适量,加乙腈溶液(9→20) 溶解并稀释制成每1 mL中约含头孢他美酸0.05 mg和含头孢他美1.0 mg的混合溶液,即得。
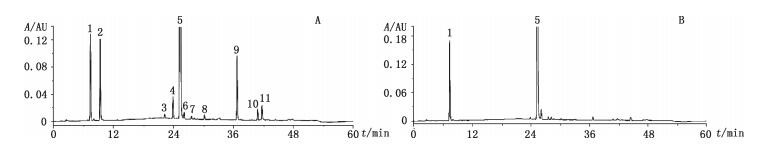
3 结果与讨论 3.1 HPLC测定结果取“2.3”项下的有关物质供试品溶液与系统适用性溶液按“2.1”项下的方法进行测定,得到盐酸头孢他美酯分散片的有关物质典型图谱,分别将各峰按时间顺序以峰1~11进行命名,见图 2-A。在系统适用性溶液色谱图(图 2-B)中,头孢他美酯与其相邻杂质峰的分离度分别为4.2、3.6,头孢他美酯与头孢他美酸的分离度为68.8。
|
1.头孢他美酸(cefetamet acid) 5.头孢他美酯(cefetamet pivoxil) 2~4、6~11.未知杂质(unknown impurities) 图 2 供试品溶液(A)与系统适用性溶液(B)HPLC色谱图 Figure 2 HPLC chromatograms of test solution and system suitability solution |
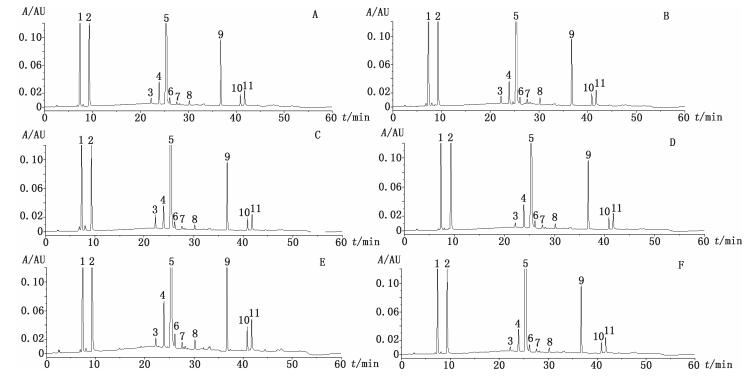
在笔者前期研究中发现,头孢他美酯杂质中不仅有工艺杂质,而且也存在有降解杂质[7]。再综合对比分散片在影响因素和强制降解条件下的HPLC图谱(图 3)可发现:在强酸及强碱的条件下,头孢他美酸(图 2-A中峰1) 含量明显增大;在光照条件下主要降解产物为峰2(图 2-A中峰2);在强氧化条件下,主要降解产物为峰3(图 2-A中峰3);在高湿条件下,每个杂质的含量均有明显的增大趋势;在高温条件下,杂质含量变化不明显。
|
1.头孢他美酸(cefetamet acid) 5.头孢他美酯(cefetamet pivoxil) 2~4、6~11.未知杂质(unknown impurity) A.酸破坏(acid destruction) B.碱破坏(base destruction) C.光照破坏(light destruction) D.氧化破坏(oxidation destruction) E.高湿破坏(high humidity destruction) F.高温破坏(heat destruction) 图 3 盐酸头孢他美酯分散片破坏性试验色谱图 Figure 3 Chromatograms of cefetamet pivoxil hydrochloride dispersible tablets under stressed conditions |
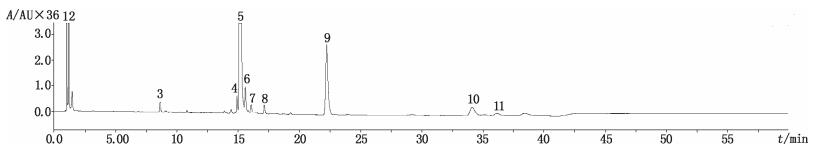
首先利用一级全扫描质谱得到各有关物质的精确相对分子质量和元素信息,再根据二级全扫描质谱获得碎片离子信息,结合头孢菌素类药物常见的质谱裂解方式[8-10],参考β-内酰胺抗生素杂质形成的常见机理[11],并参照文献[12]推测其可能的化学结构。在LC-TOF/MS条件下提取的样品总离子流图见图 3。通过比较UV特征图发现,图 4中峰1为图 2中的峰2,图 4中峰2为图 2中的峰1,其余峰号均相对应。
|
图 4 盐酸头孢他美酯分散片LC-MS总离子流图 Figure 4 LC-MS TIC profile of cefetamet pivoxil hydrochloride dispersible tablets sample |
峰1经正离子模式分析,其分子离子峰m/z 702,为[M+NH4]+的峰,即为C32H39N6O8S2;m/z 685,为[M+H]+的峰,即为C32H39N5O8S2,如图 5-A所示。推测其相对分子质量为683,经二级全扫描获得碎片离子有m/z 360、m/z 343、m/z 325,推测其结构式及质谱裂解途径见图 5-B。
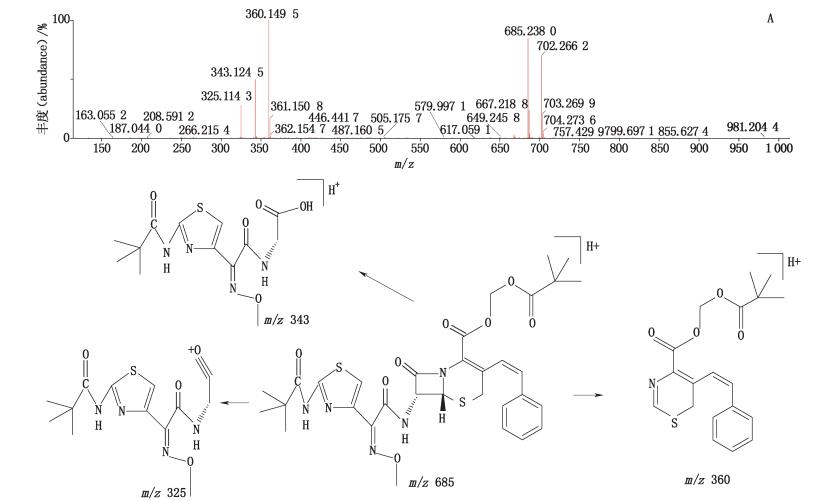
|
图 5 峰1[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 5 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 1(B) |
峰2经正离子模式分析,其分子离子峰m/z 398,为[M+H]+的峰,即为C14H15N5O5S2,如图 6-A所示。推测其相对分子质量为397,经二级全扫描获得碎片离子有m/z 241、m/z 227、m/z 197,推测其结构式及质谱裂解途径见图 6-B。取头孢他美酸对照品同法测定。结果显示,头孢他美酸对照品的MS一级、二级质谱信息与检出的位置与峰2一致,保留时间一致,因此峰2归属为头孢他美酸。
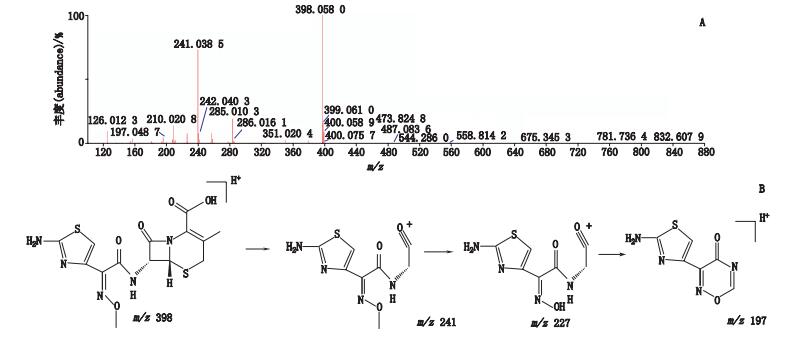
|
图 6 峰2[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 6 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 2(B) |
峰3经正离子模式分析,其分子离子峰m/z 482,为[M+H]+的峰,即为C19H24N5O6S2,如图 7-A所示。推测其相对分子质量为481,经二级全扫描获得碎片离子有m/z 398、m/z 380、m/z 241,推测其结构式及质谱裂解途径见图 7-B。
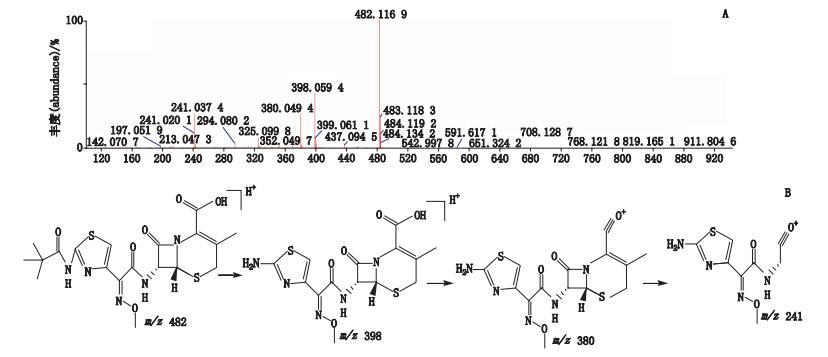
|
图 7 峰3[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 7 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 3(B) |
峰4经正离子模式分析,其分子离子峰m/z 542,为[M+H]+的峰,即为C21H28N5O8S2,如图 8-A所示。推测其相对分子质量为541,经二级全扫描获得碎片离子有m/z 524、m/z 272、m/z 253,推测其结构式及质谱裂解途径见图 8-B。
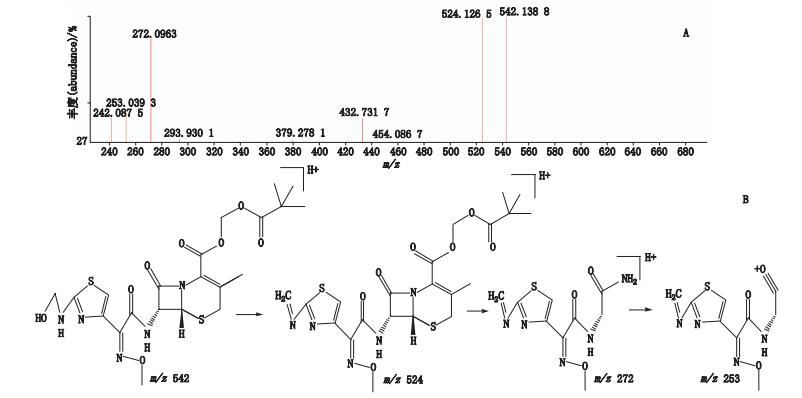
|
图 8 峰4[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 8 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 4(B) |
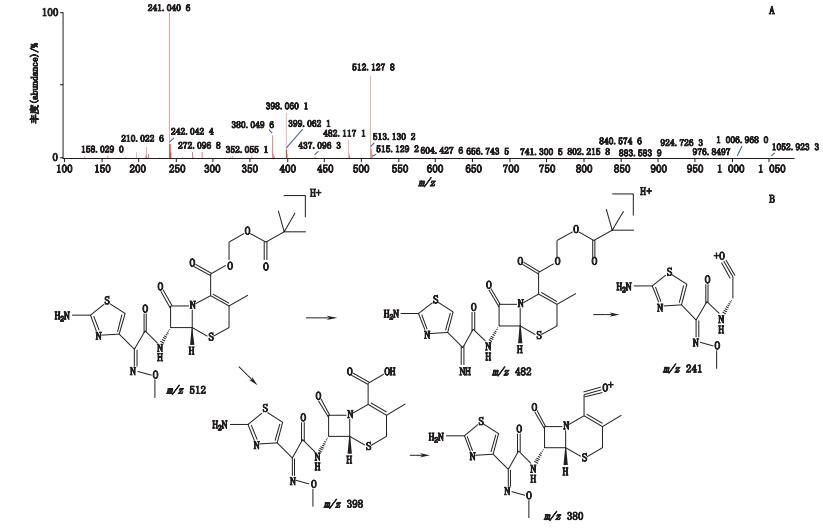
峰5、6的质谱图信息完全一致,应为同分异构体。经正离子模式分析,其分子离子峰m/z 512,为[M+H]+的峰,即为C20H26N5O7S2,如图 9-A所示。推测其相对分子质量为511,经二级全扫描获得碎片离子有m/z 482、m/z 398、m/z 380、m/z 241,推测其结构式及质谱裂解途径见图 9-B。峰5和6的母离子及二级碎片离子均与头孢他美酯对照品相同,推测峰5为头孢他美酯,峰6为头孢他美酯的同分异构体。
|
图 9 峰5、6[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 9 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 5, and peak 6(B) |
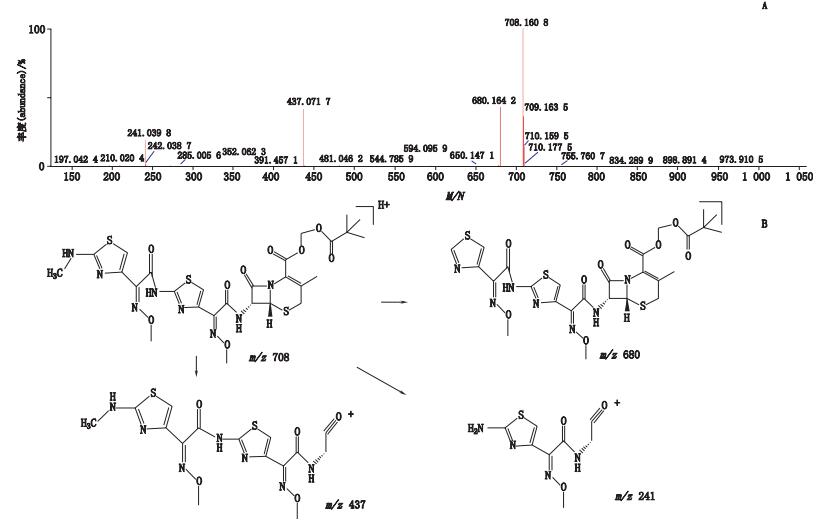
峰7经正离子模式分析,其分子离子峰m/z 708,为[M+H]+的峰,即为C27H32N8O9S3,如图 10-A所示。推测其相对分子质量为707,经二级全扫描获得碎片离子有m/z 680、m/z 437、m/z 241,推测其结构式及质谱裂解途径见图 10-B。
|
图 10 峰7[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 10 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 7(B) |
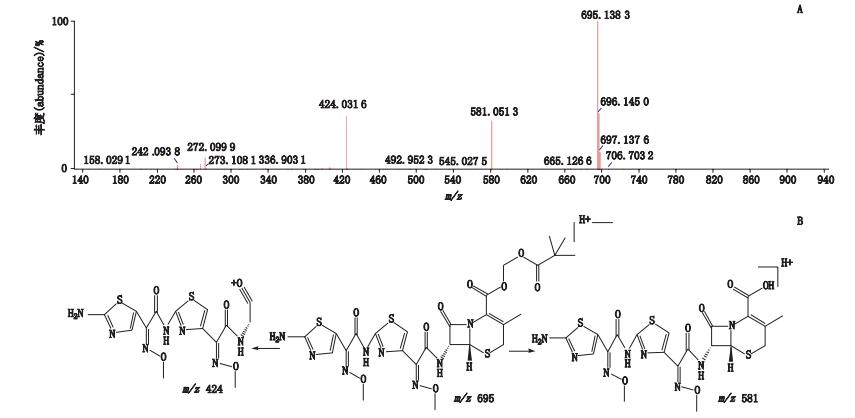
峰8经正离子模式分析,其分子离子峰m/z 695,为[M+H]+的峰,即为C26H31N8O9S3,如图 11-A所示。推测其相对分子质量为694,经二级全扫描获得碎片离子有m/z 581、m/z 424,推测其结构式及质谱裂解途径见图 11-B。
|
图 11 峰8[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 11 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 8(B) |
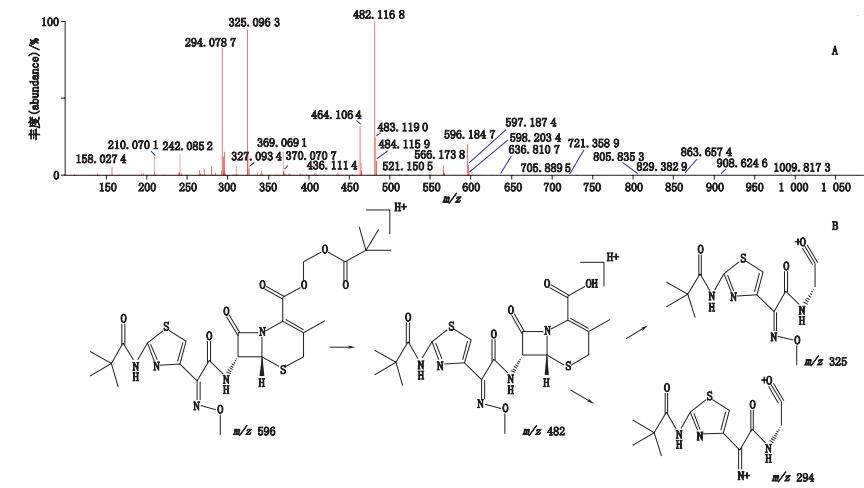
峰9经正离子模式分析,其分子离子峰m/z 596,为[M+H]+的峰,即为C25H34N5O8S2,如图 12-A所示。推测其相对分子质量为595,经二级全扫描获得碎片离子有m/z 482、m/z 464、m/z 325,推测其结构式及质谱裂解途径见图 12-B。
|
图 12 峰9[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 12 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 9(B) |
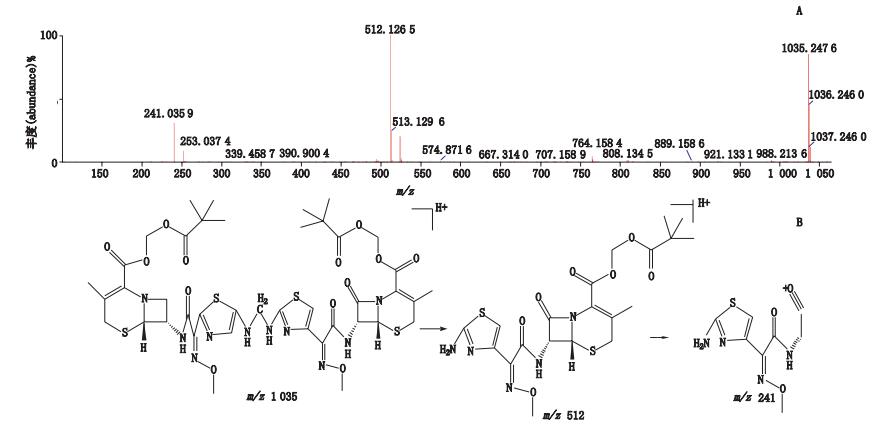
峰10、11的质谱图信息完全一致,应为同分异构体。经正离子模式分析,其分子离子峰m/z 1 035,为[M+H]+的峰,即为C41H51N10O14S4,如图 13-A所示。推测其相对分子质量为1 034,为头孢他美酯的二聚物,经二级全扫描获得碎片离子有m/z 512、m/z 241,推测其结构式及质谱裂解途径见图 13-B。
|
图 13 峰10、11[M+H]+二级质谱图(A)及可能裂解途径(B) Figure 13 [M+H]+ MS2 spectrum(A)and possible fragmentation pathway of peak 10 and peak 11(B) |
按原方法[4-6]检测发现,标准中所要求记录的保留时间均未能检测出峰9~11(图 2-A),而峰9在杂质含量中所占的比例较大,导致测定结果不能真实体现杂质的含量。控制β-内酰胺抗生素中的聚合物类杂质是质量控制的关键[13],因此需要对峰10与峰11的结构进行进一步确证,并通过葡聚糖凝胶G-10色谱柱对其进行质量控制。本文通过梯度洗脱法使盐酸头孢他美酯分散片中的主要有关物质检出并达到了有效分离,通过飞行时间质谱测定一级质谱和二级碎片离子的精确分子质量,从而推断出可能的分子式及分子结构,为杂质的结构鉴定提供科学依据。
| [1] |
马伟杭, 陈亚岗, 郑经川, 等. 盐酸头孢他美酯治疗细菌感染性疾病的多中心临床研究[J]. 中国抗生素杂志, 2001, 26(2): 139. MA WH, CHEN YG, ZHENG JC, et al. A multiple centre randomized controlled clinical study of cefetamet pivoxil hydrochloride in the treatment of bacterial infectious diseases[J]. Chin J Antibiot, 2001, 26(2): 139. |
| [2] |
张淑华, 欧真蓉, 陈蜀, 等. 国产头孢他美酯、头孢他美体内外抗菌作用研究[J]. 中国抗生素杂志, 2001, 26(2): 144. ZHANG SH, OU ZR, CHEN S, et al. The in vitro and in vivo antibacterial activity of cefetamet and cefetamet pivoxil[J]. Chin J Antibiot, 2001, 26(2): 144. |
| [3] |
肖克岳, 刘晓磊, 孟琴. 盐酸头孢他美酯分散片人体药物动力学及生物等效性研究[J]. 中南药学, 2006, 4(3): 180. XIAO KY, LIU XL, MENG Q. Pharmacokinetics and bioequivalance of cefetamet pivoxil dispersible tablets in healthy volunteers[J]. Cent South Pharm, 2006, 4(3): 180. |
| [4] |
中国药典2015年版. 二部[S]. 2015: 911. ChP 2015. Vol Ⅱ[S]. 2015:911 |
| [5] |
YBH05022010国家食品药品监督管理局标准[S]. 2010 YBH05022010 Standard of State Food and Drug Administration[S]. 2010 |
| [6] |
YBH05552008国家食品药品监督管理局标准[S]. 2008 YBH05552008 Standard of State Food and Drug Administration[S]. 2008 |
| [7] |
李丹凤, 黄丽丽, 刘庄蔚, 等. 盐酸头孢他美酯及其制剂中有关物质的HPLC法测定[J]. 中国医药工业杂志, 2016, 47(7): 918. LI DF, HUANG LL, LIU ZW, et al. Determination of the related substances in cefetamet pivoxil hydrochloride and its preparations by HPLC[J]. Chin J Pharm, 2016, 47(7): 918. |
| [8] |
胡敏, 胡昌勤, 刘文英. LC/MS鉴定头孢菌素降解物结构[J]. 药物分析杂志, 2005, 25(3): 369. HU M, HU CQ, LIU WY. Indentification of degradation compounds of cephalosporins by LC/MS[J]. Chin J Pharm Anal, 2005, 25(3): 369. |
| [9] |
王玲, 王英武, 陈刚, 等. 用电喷雾四极杆飞行时间质谱研究头孢类药物的质谱裂解规律[J]. 吉林大学学报(理学版), 2003, 41(1): 117. WANG L, WANG YW, CHEN G, et al. Fragmentation regularities of cephalosporin drugs by means of electrospray ionization quadrupole timeof-flight mass spectrometry[J]. J Jilin Univ(Sci Ed), 2003, 41(1): 117. |
| [10] |
陈兆坤, 胡昌勤. 头孢菌素类抗生素的降解机制[J]. 国外医药抗生素分册, 2004, 25(6): 249. CHEN ZK, HU CQ. Mechanisms of cephalosporins degradation[J]. World Notes Antibiot, 2004, 25(6): 249. |
| [11] |
胡昌勤, 蒋煜, 张靖溥, 等. 对β-内酰胺抗生素中微量不稳定杂质研究策略与方法的思考[J]. 中国新药杂志, 2013, 22(1): 4. HU CQ, JIANG Y, ZHANG JP, et al. Reflection on strategy and methods on strace unstable impurities of β-lactam antibiotics[J]. Chin J New Drugs, 2013, 22(1): 4. |
| [12] |
WANG DD, WANG F, WANG J. Characterization of the impurities and isomers in cefetamet pivoxil hydrochloride by liquid chromatography/time-of-flight mass spectrometry and ion trap mass spectrometry[J]. J Pharm Biomed Anal, 2015, 111: 71. DOI:10.1016/j.jpba.2015.03.013 |
| [13] |
胡昌勤. 2015年版《中国药典》有关抗生素的增修订及其质量控制方向[J]. 中国药学杂志, 2015, 50(20): 1764. HU CQ. Revision of specifications of antibiotics in the Chinese pharmacopoeia 2015 and the trend of antibiotic quality control[J]. Chin Pharm J, 2015, 50(20): 1764. |
 2017, Vol. 37
2017, Vol. 37 
