2. 吉林农业大学, 长春 130117
2. Jilin Agricultural University, Changchun 130117, China
荆防败毒丸具有清热散风、解毒消肿的功效,主要用于流行性感冒、恶寒发热、头痛咳嗽、瘟毒发颐等的治疗,该中药复方制剂由土茯苓、川芎、荆芥、防风、党参、甘草、桔梗、薄荷、前胡、柴胡、枳壳、独活、羌活共13味中药材加工而成,收载于卫生部部颁药品标准(中药成方制剂第一册)[1]。现标准仅规定了荆防败毒丸的性状、显微鉴别及制剂通则的检查项[1-2],未对该制剂处方中的任何药物所含成分进行定量测定,也未检索到对该制剂所含成分进行定量检测的文献报道。本品处方工艺中的土茯苓解毒、除湿、利关节;川芎活血行气、祛风止痛,是治疗头痛的首选药物。为确保该产品的质量稳定和疗效的一致性,本文以土茯苓中所含5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇与川芎中所含洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯、藁本内酯为指标成分,采用波长切换HPLC梯度洗脱法同时测定5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯的含量,为荆防败毒丸的质量标准的提高提供有效依据。
1 仪器与试药 1.1 仪器HP1100高效液相色谱仪(Agilent公司),配备Agilent 1100色谱工作站,G1315B可变波长检测器;Shiseido C18(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶;株式会社资生堂公司)色谱柱;梅特勒托利多AE240电子天平(Mettler Toledo公司);KQ-100DB数控超声仪(江苏省昆山超声仪器有限公司)。
1.2 试药对照品5-O-咖啡酰莽草酸(批号73263-62-4,纯度98.0%)购于Honest Joy Holdings Limited公司;对照品落新妇苷(批号111798-201504,纯度100.0%,4℃、避光保存)、花旗松素(批号111816-201102,纯度98.9%,阴凉处、避光保存)、黄杞苷(批号111906-201102,纯度93.7%,室温干燥保存)、白藜芦醇(批号111535-200502,纯度98.0%,干燥密闭保存)、藁本内酯(批号111737-201507,纯度98.0%,-20℃、避光保存)购于中国食品药品检定研究院;对照品洋川芎内酯H(批号94596-27-7,纯度97.0%)、洋川芎内酯Ⅰ(批号94596-28-8,纯度97.0%)、洋川芎内酯A(批号62006-39-7,纯度97.0%)、瑟丹酸内酯(批号6415-59-4,纯度97.0%)购于上海纯优生物科技有限公司。甲醇、乙腈为色谱纯,冰醋酸为分析纯,水为重蒸馏水。
荆防败毒丸(水丸,每10粒重1 g,批号为150912、151125、151207) 购于四川禾润制药有限公司。
2 方法与结果 2.1 溶液的制备 2.1.1 供试品溶液取荆防败毒丸适量,研成细粉,称取8.0 g,精密称定,置锥形瓶中,精密加入80%乙醇水溶液50 mL,具塞,称量,记录数据,超声(100 W,40 kHz)处理30 min,放冷,再次称量,用80%乙醇水溶液补足减失的量,摇匀,过滤,取续滤液,即得供试品溶液。
2.1.2 混合对照品溶液分别精密称取5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯的对照品各适量,用80%乙醇水溶液溶解并稀释,分别制成单一成分的对照品储备液(5-O-咖啡酰莽草酸1.826 mg·mL-1,落新妇苷4.150 mg·mL-1,花旗松素0.708 mg·mL-1,黄杞苷0.956 mg·mL-1,白藜芦醇0.484 mg·mL-1,洋川芎内酯H0.676 mg·mL-1,洋川芎内酯Ⅰ0.988 mg·mL-1,洋川芎内酯A1.272 mg·mL-1,瑟丹酸内酯0.614 mg·mL-1,藁本内酯1.932 mg·mL-1);再分别吸取各单一成分的对照品储备液:5-O-咖啡酰莽草酸5.0 mL、落新妇苷6.0 mL、花旗松素2.5 mL、黄杞苷5.0 mL、白藜芦醇2.5 mL、洋川芎内酯H 2.5 mL、洋川芎内酯Ⅰ 2.5 mL、洋川芎内酯A 5.0 mL、瑟丹酸内酯5.0 mL和藁本内酯5.0 mL,置同一100 mL量瓶中,加80%乙醇水溶液稀释至刻度,摇匀,即得混合对照品溶液。
2.1.3 阴性样品溶液按荆防败毒丸生产工艺过程分别制备缺少土茯苓、川芎的阴性样品,按照“2.1.1”项下方法制备土茯苓阴性样品溶液和川芎阴性样品溶液。
2.2 色谱条件采用Shiseido C18(4.6 mm×250 mm,5 μm)色谱柱;流动相:A相甲醇-乙腈(3:1),B相为0.1%醋酸水溶液,梯度洗脱[3-7](0~15 min,32.0%A;15~26 min,32.0%A→43.0%A;26~37 min,43.0%A→62.0%A;37~69 min,62.0%A→85.0%A;69~75 min,85.0%A→32.0%A);流速:1.2 mL·min-1;0~37 min时在291 nm[8-9]波长下检测5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷和白藜芦醇,37~75 min在280 nm[10-12]波长下检测洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯。理论塔板数按所测各成分色谱峰计均不低于2 500,分离度均不小于1.5。此系统条件下所测成分之间及与其他成分分离效果良好,且峰形较好。
2.3 含量测定方法学考察 2.3.1 线性关系考察分别精密吸取“2.1.2”项下的10个对照品储备液各0.1、0.2、0.5、1.0、2.0 mL,将其分别置于20 mL量瓶中并用80%乙醇水溶液稀释至刻度,摇匀,即得到一系列浓度的混合对照品溶液,按照上述测定方法进行测定,采用质量浓度X作为横坐标,测得的峰面积Y作为纵坐标,绘制标准曲线,5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯回归方程、线性范围详见表 1。
|
|
表 1 0个成分的回归方程及线性关系 Table 1 Regression equations and linear range of ten components |
分别精密吸取“2.1.3”项下的土茯苓阴性样品溶液、川芎阴性样品溶液及“2.1.2”项下的混合对照品溶液和“2.1.1”项下的供试品溶液,在上述色谱条件下依法进行测定。专属性试验结果表明,土茯苓阴性样品、川芎阴性样品的色谱图中,在10个成分对应的位置无干扰,表明该方法专属性良好,色谱图详见图 1。
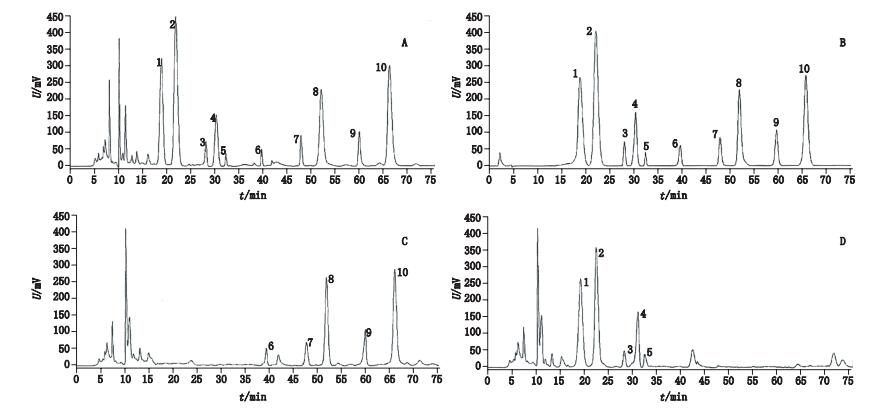
|
1. 5-O-咖啡酰莽草酸(5-O-caffeoylshikimic acid) 2.落新妇苷(astilbin) 3.花旗松素(taxifolin) 4.黄杞苷(engeletin) 5.白藜芦醇(resveratrol) 6.洋川芎内酯H(senkyunolide H) 7.洋川芎内酯Ⅰ(senkyunolide Ⅰ) 8.洋川芎内酯A(senkyunolide A) 9.瑟丹酸内酯(sedanolide) 10.藁本内酯(ligustilide) 图 1 样品(A)、对照品(B)、土茯苓阴性样品(C)、川芎阴性样品(D)色谱图 Figure 1 Chromatograms of sample(A), reference substances(B), negative sample without Smilacis Glabrae Rhizoma(C)and negative sample without Chuanxiong Rhizoma(D) |
取“2.1.1”项下的同一样品(批号150912) 的供试品溶液,分别于配制后在室温下放置0、2、4、8、12 h,按“2.2”项色谱条件进样测定待测成分峰面积,求得测定5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯峰面积的RSD依次为1.2%、0.78%、1.5%、1.0%、0.49%、0.76%、1.2%、0.85%、1.1%和0.97%,表明供试品溶液制备后12 h内较稳定。
2.3.4 重复性试验取同一批样品(批号150912)6份,分别按“2.1.1”项方法制备6份供试品溶液,按“2.2”项的色谱条件进行测定,计算荆防败毒丸中的5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯平均含量分别为0.578、1.661、0.105、0.332、0.071、0.103、0.161、0.437、0.180、0.587 mg·g-1,RSD分别为1.4%、0.96%、1.3%、0.85%、0.64%、0.69%、1.2%、0.87%、1.3%和0.62%。结果表明本方法重复性良好。
2.3.5 仪器精密度试验取“2.1.2”项下的混合对照品溶液,按“2.2”项下的色谱条件连续进样6次,记录待测成分的峰面积并计算RSD,结果5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯峰面积的RSD依次为0.95%、0.88%、1.0%、0.57%、0.81%、1.3%、0.97%、1.1%、0.95%和0.43%,显示仪器精密度良好。
2.3.6 加样回收率试验取已知含量荆防败毒丸样品(批号150912) 适量,分成6份,每份4.0 g,分别精密称定,加80%乙醇水溶液及“2.1.2”项下混合对照品溶液各25 mL,按“2.1.1”项下方法制备供试溶液,按“2.2”项下的色谱条件依法测定,计算10个成分的回收率和相对应的RSD,结果见表 2。
|
|
表 2 回收率实验结果 Table 2 Results of recovery test |
取3个批号的荆防败毒丸,按“2.1.1”项下方法制备供试品溶液,按“2.2”项下的色谱条件进样测定,以外标法计算荆防败毒丸中10个待测物含量,结果见表 3。
|
|
表 3 10个成分的含量测定结果(n=3,mg·g-1) Table 3 The contents of ten components |
为能兼顾荆防败毒丸中10个成分对提取溶剂要求,选取60%乙醇、80%乙醇水溶液和乙醇为提取溶剂进行考察;同时考察了超声提取时间(20、30、40 min)和水浴回流时间(20、30、40 min)对荆防败毒丸中10个成分提取率的影响,从而优化最佳的样品处理方法。综合考虑所测各成分的提取效果和操作的便捷性,最终选取80%乙醇水溶液超声提取30 min作为荆防败毒丸中10个成分同时测定的样品处理方法。
3.2 检测波长的选择本文所测土茯苓中的5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇和川芎中的洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯的最大紫外吸收波长不同,为准确反映各成分含量,通过波长切换法,选取所测成分的最大吸收波长进行测定。结果表明,在291 nm波长处5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇吸收值较大,在280 nm处洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯的峰吸收值较大,故采用波长切换法,选取291 nm(0~37 min)和280 nm(37~75 min)对荆防败毒丸中10个成分进行同时测定。
3.3 流动相的选择笔者在试验过程中分别采取乙腈-0.1%醋酸水溶液[3,13]、甲醇-0.2%的乙酸水溶液[4,14]、乙腈-0.025%磷酸水溶液[9]、乙腈-1%甲酸水溶液[11,15]、甲醇-乙腈(3:1) 与0.1%醋酸水溶液不同比例梯度洗脱,以10个待测成分色谱峰的出峰时间、峰形和分离度效果为评价指标进行综合评价,优选出荆防败毒丸中10个待测成分同时测定的最佳检测所使用的流动相。结果表明,以甲醇-乙腈(3:1) 与0.1%醋酸水溶液不同比例梯度洗脱时,10个待测成分色谱峰的出峰时间、峰形和分离度效果最佳,故选取甲醇-乙腈(3:1) 与0.1%醋酸水溶液作为流动相,按照本文确定的比例梯度洗脱。
4 结论本研究通过HPLC波长切换联合梯度洗脱技术,建立了同时测定荆防败毒丸中5-O-咖啡酰莽草酸、落新妇苷、花旗松素、黄杞苷、白藜芦醇、洋川芎内酯H、洋川芎内酯Ⅰ、洋川芎内酯A、瑟丹酸内酯和藁本内酯10个成分含量的方法。该方法简便、准确,可为中药成方制剂荆防败毒丸的质量控制方法的提高提供参考。
| [1] |
卫生部颁药品标准中药成方制剂. 第1册[S]. 1997: 112. Drug Specifications Promulgated by the Ministry of Public Health, P R China. Traditional Chinese Medicine Prescription Preparation. Vol Ⅰ[S]. 1997:112 |
| [2] |
中国药典2010年版. 一部[S]. 2010: 附录7, 30, 34. ChP 2010. Vol Ⅰ[S]. 2010:Appendix 7, 30, 34 |
| [3] |
张清峰, 张汉扬, 上官新晨, 等. 高效液相法同时测定土茯苓中五种多酚成分[J]. 现代食品科技, 2013, 29(9): 2275. ZHANG QF, ZHANG HY, SHANGGUAN XC, et al. Quantitative analysis of five polyphenols in Rhizoma Smilacis Glabrae by HPLC[J]. Mod Food Sci Technol, 2013, 29(9): 2275. |
| [4] |
刘洁, 余李敏, 翟帆. 高效液相色谱-质谱法同时测定川芎提取液中7种有效成分[J]. 中成药, 2010, 32(8): 1380. LIU J, YU LM, ZHAI F. Simultaneous determination of 7 kinds of bioactive components of Ligusticum chuanxiong Hort. by HPLC-MS[J]. Chin Tradit Pat Med, 2010, 32(8): 1380. |
| [5] |
徐硕, 尚明英, 刘广学, 等. 高效液相色谱法测定土茯苓药材中7种活性成分的含量[J]. 中国中药杂志, 2015, 40(3): 469. XU S, SHANG MY, LIU GX, et al. Simultaneous determination of seven bioactive constituents in Smilacis Glabrae Rhizoma by highperformance liquid chromatography[J]. China J Chin Mater Med, 2015, 40(3): 469. |
| [6] |
白梅, 刘为萍, 李素珍. HPLC测定不同产地土茯苓中落新妇苷和黄杞苷含量[J]. 药物分析杂志, 2013, 33(8): 1352. BAI M, LIU WP, LI SZ. HPLC determination of astilbin and engeletin in Smilax glabra from different producing areas[J]. Chin J Pharm Anal, 2013, 33(8): 1352. |
| [7] |
刘金亮, 范巧佳, 郑顺林, 等. HPLC测定不同采收期川芎药材中5种药效成分的含量[J]. 中国中药杂志, 2014, 39(9): 1650. LIU JL, FAN QJ, ZHENG SL, et al. Quantitative determination of 5 active ingredients in different harvest periods of Ligusticum chuanxiong by HPLC[J]. China J Chin Mater Med, 2014, 39(9): 1650. |
| [8] |
肖凤霞, 邓少东, 邓超明, 等. HPLC法测定土茯苓中3种活性成分的含量[J]. 广东药学院学报, 2011, 27(6): 604. XIAO FX, DENG SD, DENG CM, et al. Simultaneous determination of 3 components in Rhizoma Smilacis Glabrae by HPLC[J]. J Guangdong Pharm Univ, 2011, 27(6): 604. |
| [9] |
吴新荣, 刘志刚, 颜仁梁, 等. 高效液相色谱法同时测定土茯苓中落新妇苷、黄杞苷的含量[J]. 中国医院药学杂志, 2010, 30(10): 886. WU XR, LIU ZG, YAN RL, et al. Quantitative analysis of astilbin and engeletinin Rhizoma Smilacis Glabrae by HPLC[J]. China J Hosp Pharm, 2010, 30(10): 886. |
| [10] |
曹建敏, 王宗花, 丁明玉, 等. 反相高效液相色谱法同时测定川芎中的四种内酯类化合物[J]. 色谱, 2005, 23(5): 531. CAO JM, WANG ZH, DING MY, et al. Determination of lactone components in Chuanxiong by reversed-phase high performance liquid chromatography[J]. Chin J Chromatogr, 2005, 23(5): 531. |
| [11] |
田璐, 闫海霞, 傅欣彤, 等. 一测多评法同时测定川芎、当归饮片中多种化学成分的含量[J]. 药物分析杂志, 2014, 34(5): 848. TIAN L, YAN HX, FU XT, et al. Simultaneous determination of multiple components in decoction pieces of Chuanxiong Rhizoma and Angelicae Sinensis Radix by quantitative analysis of multicomponents by single maker[J]. Chin J Pharm Anal, 2014, 34(5): 848. |
| [12] |
姚宗玲, 杜守颖, 陆洋, 等. RP-HPLC同时测定不同来源川芎中5种有效成分的含量[J]. 中国中药杂志, 2010, 35(20): 2696. YAO ZL, DU SY, LU Y, et al. Simultaneous determination of five effective components in Rhizoma Chuanxiong by RP-HPLC[J]. China J Chin Mater Med, 2010, 35(20): 2696. |
| [13] |
邢婧, 任红, 汪轩, 等. HPLC法同时测定淫羊藿-川芎药对8种化学成分的含量[J]. 药物分析杂志, 2015, 35(6): 960. XING J, REN H, WANG X, et al. Simultaneous determination of eight ingredients in drug pair of Epimedii Folium and Chuanxiong Rhizoma by HPLC[J]. Chin J Pharm Anal, 2015, 35(6): 960. |
| [14] |
张永贵, 赵力, 杨小英. 土茯苓药材HPLC指纹图谱研究及主成分的含量测定[J]. 中国药房, 2016, 27(36): 5143. ZHANG YG, ZHAO L, YANG XY. Study on the quality of commercially available HPLC fingerprint and content determination of principal component of Smilacis Rhizoma[J]. China Pharm, 2016, 27(36): 5143. DOI:10.6039/j.issn.1001-0408.2016.36.33 |
| [15] |
何席呈, 杜洪志, 陈虎彪, 等. 基于UPLC-Q-TOF-MS内标物标准指纹图谱的土茯苓质量评价[J]. 药物分析杂志, 2015, 35(8): 1424. HE XC, DU HZ, CHEN HB, et al. Quality evaluation of Smilacis Glabrae Rhizoma based on standard fingerprint by UPLC-Q-TOFMS[J]. Chin J Pharm Anal, 2015, 35(8): 1424. |
 2017, Vol. 37
2017, Vol. 37 
