2. 福建农林大学菌草研究所, 福州 350002
2. Juncao Research Institute, Fujian Agriculture and Forestry University, Fuzhou 350002, China
辅酶Q10(coenzyme Q10,Co-Q10)是一种存在于自然界的脂溶性醌类化合物,其结构与维生素K相类似。同时,它也是一种优良的抗氧化剂,具有参与呼吸链电子传递[1],细胞抗氧化[2-3],阻止细胞凋亡[4-7],增强免疫力等功能,并且无毒,无致畸作用和无明显副作用,使用安全[8]。维生素E又称为生育酚,其中以α-生育酚的生物效应最高,具有促进生育和抗衰老的作用,参与细胞DNA合成的调节,可提高免疫力和对疾病的抵抗力[9]。一般情况下在保健食品中添加的是α-生育酚[10]或其衍生物。α-生育酚虽然具有极强的抗氧化性质,但也极易被氧化,在贮藏和运输的过程中易发生变质。天然维生素E属于脂溶性维生素,与水溶性有效成分或界面难以均匀混合,不利于消化吸收[11]。因此,生产中常采用衍生化法,α-生育酚醋酸酯是最常见的维生素E酯化衍生物,它除了具有较好的稳定性和储存性、可以作为机体内维生素E的前体物质、水解后发挥维生素E的功效外,还具有特殊功效如保护视觉神经,保护皮肤,促进溃疡愈合和抗击炎症[12]等,大大扩展了维生素E的应用领域。国内外将辅酶Q10用于营养保健品和食品添加剂时,常与维生素E配伍使用[13],两者的联合作用可提高各自抵抗外界氧化因子损害的能力,并具有协同作用[14]。
关于辅酶Q10和维生素E的含量测定方法常见的是HPLC法,但同时快速测定这2个化合物的HPLC法鲜有报道。相关文献报道或前处理烦琐,色谱出峰也不理想[15]或用到C30色谱柱[16],方法并不通用。本实验通过优化样品的前处理,以超声提取和冷冻离心代替皂化、萃取和浓缩等步骤,改进实验过程的简便性、可操作性及目标物的稳定性;优化色谱条件,缩短分析时间至小于6 min,建立同时快速测定辅酶Q10维生素E软胶囊中辅酶Q10和维生素E这2种功效成分含量的HPLC方法,为辅酶Q10维生素E软胶囊及同类产品的质量控制提供一种更加便捷高效和绿色环保的新方法。
1 仪器与试药LC-20型高效液相色谱仪系统,配SPD-M20A型二极管阵列检测器(SHIMADZU公司);Millipore Direct-Q纯水系统(Millipore公司);Thermo公司Accucore C18(150 mm×2.1 mm,2.6 µm;填料:十八烷基硅烷键合表面多孔实心核颗粒);KQ-250DE数控超声波清洗器(昆山市仪器有限公司);Allegra X-30离心机(BECKMAN公司);CPA225D十万分之一电子天平(赛多利斯公司)。
辅酶Q10对照品购自中国食品药品检定研究院(批号140611-200803,含量为100.0%);DL-α生育酚醋酸酯(DL-alpha tocopherol acetate)对照品,LOT NO. LC17386V,98.9%,SUPELCO公司;DL-α生育酚(DL-alpha tocopherol)对照品,LOT NO.LB91772V,99.9%,美国SUPELCO公司。
甲醇为色谱纯,无水乙醇为优级纯,试验用水为纯净水。
样品辅酶Q10维生素E软胶囊(400 mg·粒-1)由广州渔夫堡医药科技有限公司提供,批号为20151110、20151111、20151112。
2 溶液的制备 2.1 对照品储备液确称取对照品(按纯度标示折算)辅酶Q10 25.11 mg、DL-α生育酚醋酸酯40.05 mg及DL-α生育酚20.20mg,分别置于25 mL量瓶中,以无水乙醇溶解并定容至刻度,制成辅酶Q10 1.004 mg·mL-1、DL-α生育酚醋酸酯1.602 mg·mL-1及DL-α生育酚0.808 mg·mL-1的单一成分的对照品储备液。-18 ℃以下储存,备用。
2.2 系列混合对照品溶液分别吸取上述2种对照品储备液各5.00 mL于10 mL量瓶中,制成辅酶Q100.502 mg·mL-1和DL-α生育酚醋酸酯0.801 mg·mL-1的混合对照品溶液;分别精密量取混合对照品溶液适量,置于10 mL量瓶中,加无水乙醇稀释至刻度,混匀,得辅酶Q10质量浓度分别为0、0.063、0.126、0.251、0.502 mg·mL-1,DL-α生育酚醋酸酯质量浓度分别为0、0.100、0.200、0.400、0.801 mg·mL-1的系列混合对照品溶液。
2.3 供试品溶液精密称取辅酶Q10维生素E软胶囊内容物约0.1 g于50 mL离心管中,准确加无水乙醇25 mL,超声(500 W,40 kHz,50 ℃)提取2 min,放冷,于-18 ℃以下冷冻2 h,取出后8 000 r·min-1离心5 min,取上清液过0.22 μm有机滤膜,即得。全程避光操作。
2.4 空白样品溶液取无水乙醇,按“2.1.3”项不加样品进行操作,即得空白样品溶液。
3 色谱条件色谱柱:Accucore C18(150 mm×2.1 mm,2.6 µm);流动相:乙醇-甲醇(7:13);流速:0.4 mL·min-1;柱温:38 ℃;检测波长:280 nm;进样量:5 μL。在上述色谱条件下,辅酶Q10和维生素E的分离度均大于1.5,理论板数均大于1 000,色谱图见图 1。
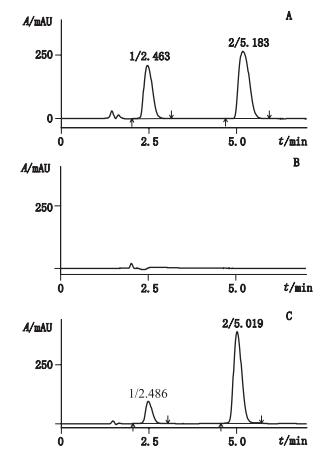
|
1.维生素E(vitamin E)2.辅酶Q10(coenzyme Q10) 图 1 空白样品溶液(B)、混合对照品溶液(A)及供试品溶液(C)的HPLC色谱图 Figure 1 HPLC chromatograms of blank sample solution(B), mixed reference substances solution(A)and sample solution(C) |
取“2.1.2”项下系列混合对照品溶液进样分析,以质量浓度X和对应的峰面积Y进行线性回归,辅酶Q10和维生素E质量浓度分别在0.063~0.502和0.100~0.801 mg·mL-1范围内呈良好线性,回归方程:
Y=1.194×107X-9.461×103 r=0.999 9
Y=3.784×106X-1.316×104 r=0.999 9
将低浓度的混合对照品溶液以流动相逐级稀释后进样20 μL测定,当S/N=3时,辅酶Q10和维生素E的检测限分别为1和3 μg·mL-1。
4.2 精密度试验取同一混合对照品溶液连续进样6次,结果辅酶Q10和维生素E峰面积的RSD分别为2.29%和1.67%,表明仪器精密度良好。
4.3 稳定性试验取同一供试品溶液,置于仪器自动进样器内(室温暗处),分别于0、4、8、12、24 h分析测定,结果辅酶Q10和维生素E峰面积的RSD分别为3.30%和2.78%,表明供试品溶液在室温暗处24 h内稳定性良好。
4.4 回收率和重复性试验选取同一胶囊样品内容物约0.05 g,共6份,分别加入对照品储备液各2、4 mL,每个添加水平3份,分别按“2.1.3”项方法制备供试溶液,进样测定。结果辅酶Q10在高、低水平的添加回收率分别为90.6%和98.3%,RSD分别为2.9%和4.0%,维生素E在高、低水平的添加回收率分别为98.9%和95.7%,RSD分别为3.1%和2.6%。表明该方法准确度、重复性良好。
5 样品测定取3批次的样品各3份,分别按本法与国标法[GB/T 5009.82—2003(维生素E)]进行平行测定,以外标法计算含量,结果见表 1。
|
|
表 1 3批样品中辅酶Q10和维生素E含量(mg·g-1,n=3) Table 1 Contents of coenzyme Q10 and vitamin E in 3 samples |
关于维生素E测定方法的现行国家标准[17-18]适用于天然食品中的维生素E,都需要将不同构型的维生素E经皂化转化为生育酚的形式,但预处理操作烦琐、费时,方法回收率低。考虑保健食品基质相对简单,维生素含量高,且构型较为单一,多以醋酸酯等添加剂的形式存在,本文参考中国药典[19]、美国药典[20]、日本药典[21]辅酶Q10测定的提取方法,即都是以无水乙醇溶解于50 ℃提取,再优化样品的预处理过程,以超声提取和冷冻离心去除杂质,使样品中辅酶Q10和维生素E均获得较高的提取效率。考察样品在2种不同提取方式下的维生素E提取效率,即按照国标法与本文“2.1.3”项下的超声提取法分别制备供试品溶液3批次各3份,分别按国标法与本法进样分析,计算α-生育酚含量平均值,结果见表 1。可见,本法与国标法的测定结果非常接近,国标法结果略低于本法。国标法的试样处理需经过皂化、提取、洗涤、浓缩等步骤,易使目标物损失,以致结果偏低,而本法采用超声提取和冷冻离心除杂,并不损失目标物,结果更加准确。且超声提取法操作明显简便、快速,又节约溶剂、人力,适用性强,可推广使用。
6.2 流动相的选择因为辅酶Q10和维生素E的极性都非常小,采用纯甲醇作为流动相时,维生素E可出峰但辅酶Q10不出峰。辅酶Q10微溶于乙醇,因此在流动相的甲醇中加入适量无水乙醇可使辅酶Q10和维生素E都出峰,并且随着乙醇的比例增大,辅酶Q10和维生素E的保留时间逐渐缩短。中国、美国、日本的药典[19-21]关于辅酶Q10的测定方法就是采用不同比例的无水乙醇-甲醇作为流动相。本文条件下当流动相中乙醇比例达到35%时,样品中的辅酶Q10和维生素E能够得到有效的分离(见图 1),故选择无水乙醇-甲醇(7:13)为流动相。另外,乙醇比甲醇毒性更低,沸点更高,挥发性更低,更加绿色环保,可以放心使用。
6.3 色谱柱的选择分别考察了DIONEX公司Acclaim 120 C18(250 mm×4.6 mm,5 μm)色谱柱、Welch公司Xtimate C18(250 mm×4.6 mm,5 μm)色谱柱与Thermo公司Accucore C18(150 mm×2.1 mm,2.6 μm)色谱柱,发现它们对目标组分均能很好分离,只是各色谱峰的保留时间有所差异。使用普通C18柱需增加无水乙醇的比例,流动相乙醇-甲醇比例调至13:7,都能获得满足分析要求的色谱图。而具有表面多孔增强核技术的Accucore C18柱,采用乙醇-甲醇(7:13)即可获得满意的保留时间及峰形,在更短的时间( < 6 min)实现优异的分离,柱效更高,灵敏度更高,并节约溶剂成本。因此,本文采用Accucore C18柱进行实验。实际应用中,也可以根据实验室条件选择常用的C18柱。
6.4 柱温的选择流动相中的无水乙醇具有较强的洗脱能力,但其粘度较大,在25 ℃的粘度是甲醇的2倍,上色谱柱后柱压明显增大,限制了它在HPLC中的使用。实验证明,在一般情况下,适当升高柱温可明显降低柱压。在本实验条件下,当柱温升到38 ℃左右,可忽略柱压的影响。故柱温选择38 ℃。
6.5 检测波长的选择检测波长的选择应从分析方法的灵敏度和专属性两方面考虑。分别取辅酶Q10和维生素E的混合对照品溶液及空白样品溶液进样,从二极管阵列检测器的扫描图上可以看出辅酶Q10和维生素E的最大吸收波长分别在275和284 nm处,空白样品溶液在275~284 nm处没有紫外吸收。而保健食品中辅酶Q10和维生素E的含量较高,即使不在其最大吸收波长处测定,仍能保证结果的准确度和精密度。因此本文根据具体情况,将280 nm作为辅酶Q10和维生素E共同的检测波长,而不使用分段波长,增强本法的适应性。
6.6 小结本文建立的HPLC法可同时快速测定辅酶Q10维生素E软胶囊中辅酶Q10和维生素E的含量,样品前处理简单高效,方法简便快速,经济环保,重复性好,准确度高,适应性强,为辅酶Q10维生素E类保健食品的全面质量控制提供一种新的方法。
| [1] |
MITCHELL P. Protonmotive redox mechanism of the cytochrome b-cl complex in the respiratory chain:protonmotive ubiquinone cycle[J]. FEBS Lett, 1975, 56(1): 1. DOI:10.1016/0014-5793(75)80098-6 |
| [2] |
JAMES AM, SMITH RA J, MURPHY MP. Antioxidant and prooxidant properties of mitochondrial coenzymc Q[J]. Arch Biochem Biophys, 2004, 423(1): 47. DOI:10.1016/j.abb.2003.12.025 |
| [3] |
FREI B, KIM MC, AMES BN. Ubiquinol-10 is an effective lipid soluble antioxidant at physiological concentrations[J]. Proc Natl Acad Sci USA, 1990, 87(12): 4879. DOI:10.1073/pnas.87.12.4879 |
| [4] |
ROSARIO B, TITO F, LAURA P, et al. Concomitant effect of topical ubiquinone Q10 and vitamin E to prevent keratocyte apoptosis after eximer laser photoablation in rabbits[J]. J Refrac Surg, 2002, 18(2): 135. |
| [5] |
KOONCUMCHOO P, SHARMA S, PORTER J, et al. Coenzyme Q10 provides neuroprotection in iron -induced apoptosis in dopaminergic neurons[J]. J Mol Neurosci, 2005, 28(2): 125. |
| [6] |
CHEN CC, LIOU SW, CHEN CC, et al. Coenzyme Q10 reduces ethanol induced apoptosis in corneal fibroblasts[J]. PLoS One, 2011, 6(4): 1. |
| [7] |
PAPUCCI L, SCHIAVONE N, WITORT E, et al. Coenzyme Q10 prevent apoptosis by inhibiting mitochondrial depolarization independently of its free radical scavenging property[J]. J Biol Chem, 2003, 278(30): 28220. DOI:10.1074/jbc.M302297200 |
| [8] |
王虹玲, 武婷茹, 战秀梅. 辅酶Q10抗氧化性及应用研究进展[J]. 食品研究与开发, 2015(19): 188. WANG HL, WU TR, ZHAN XM. Recent advance on antioxidant and application of coenzyme Q10[J]. Food Res Dev, 2015(19): 188. DOI:10.3969/j.issn.1005-6521.2015.19.049 |
| [9] |
ZINGG JM. Vitamin E:an overview of major research directions[J]. Mol Aspects Med, 2007, 28(5): 400. |
| [10] |
杨大进, 方从容, 王竹天, 等. 进口保健食品中维生素检测方法现状及展望[J]. 中国食品卫生杂志, 2004(1): 62. YANG DJ, FANG CR, WANG ZT, et al. Methods for determination of vitamins in import health foods-the current situation and prospect[J]. Chin J Food Hyg, 2004(1): 62. |
| [11] |
TRABER MG, ATKINSON J. Vitamin E, antioxidant and nothing more[J]. Free Radic Biol Med, 2007, 43(1): 4. DOI:10.1016/j.freeradbiomed.2007.03.024 |
| [12] |
TRABER MG, Elsner A, Brigelius-Flohé R. Synthetic as compared with natural vitamin E is preferentially excreted as α-CEHC in human urine:studies using deuterated α-tocopheryl acetates[J]. FEBS Lett, 1998, 437(1-2): 145. DOI:10.1016/S0014-5793(98)01210-1 |
| [13] |
李羽, 梁艺英, 冯晓文. 辅酶Q10与维生素E配伍的使用安全性探讨[J]. 现代食品科技, 2012, 28(1): 108. LI Y, LIANG YY, FENG XW. The edible safety of combined use of Coenzyme Q10 and Vitamin E[J]. Mod Food Sci Technol, 2012, 28(1): 108. |
| [14] |
孙艳妮, 刘建利, 邢连喜, 等. 维生素E和辅酶Q10相互作用研究[J]. 药物分析杂志, 2010, 30(6): 1118. SUN YN, LIU JL, XING LX, et al. Study the interaction between vitamin E and coenzyme Q10[J]. Chin J Pharm Anal, 2010, 30(6): 1118. |
| [15] |
KARPIŃSKA J, MIKOŁUĆ B, MOTKOWSKI R, et al. HPLC method for simultaneous determination of retinol, α-tocopherol and coenzyme Q10 in human plasma[J]. J Pharm Biomed Anal, 2006, 42(2): 232. DOI:10.1016/j.jpba.2006.03.037 |
| [16] |
GLEIZE B, STEIB M, ANDRÉ M, et al. Simple and fast HPLC method for simultaneous determination of retinol, tocopherols, coenzyme Q(10) and carotenoids in complex samples[J]. Food Chem, 2012, 134(4): 2560. DOI:10.1016/j.foodchem.2012.04.043 |
| [17] |
GB/T 5009. 82-2003食品中维生素A和维生素E的测定[S]. 2003 GB/T 5009. 82-2003 Determination of Retinol and Tocopherol in Foods[S]. 2003 |
| [18] |
GB 5413. 9-2010食品安全国家标准婴幼儿食品和乳品中维生素A、D、E的测定[S]. 2010 GB 5413. 9-2010 Determination of vitamin A, D, E in foods for infants and young children, milk and milk products according to the National Food Safety Standard[S]. 2010 |
| [19] |
中国药典2015年版. 二部[S]. 2015: 1218. ChP 2015. Vol Ⅱ[S]. 2015:1218 |
| [20] |
USP 35-NF 30[S]. 2012:1460
|
| [21] |
JP ⅩⅥ[S]. 2011:1548
|
 2017, Vol. 37
2017, Vol. 37 