2. 第二军医大学东方肝胆外科医院药材科, 上海 200438
2. Department of Pharmacy, Eastern Hepatobiliary Surgery Hospital, Shanghai 200438, China
茵陈蒿汤出自汉代张仲景所著《伤寒论》,由茵陈18 g、栀子9 g、大黄6 g组成,具有清热除湿、利胆退黄的功效,为治疗湿热黄疸的名方[1]。现代医学研究表明,该方具有保肝利胆[2]、抗肝纤维化[3]的作用,目前临床广泛用于治疗急性黄疸型肝炎[4]。君药茵陈含有黄酮、香豆素、有机酸等多种化学成分。已有文献报道,香豆素类成分滨蒿内酯、东莨菪内酯、秦皮乙素有潜在的抗炎、抗肝损伤作用[5-7];绿原酸为有机酸类的代表性成分,有清除体内自由基、抗氧化的药理活性,对小鼠肝损伤有显著保护作用,具有明显的保肝利胆的作用[8];黄酮类成分槲皮素和黄酮苷类成分金丝桃苷对四氯化碳诱导的小鼠急性肝损伤有保护作用[9-10]。栀子为茵陈蒿汤方剂中的臣药,有清热利尿、凉血解毒的功效,辅助君药加强治疗效果。栀子中具有较强药理活性的成分,主要为以京尼平苷为代表的环烯醚萜苷类成分,其与水解产物京尼平均有抗炎、抗肝损伤作用[11-13]。大黄中的两类主要活性化合物游离蒽醌(大黄酸、芦荟大黄素、大黄酚、大黄素、大黄素甲醚)和鞣质(儿茶素)均对肝脏损伤有一定治疗作用[14]。茵陈蒿汤3种药材中多种成分相辅相成、协同作用是其保肝利胆作用的重要基础,而各种潜在活性成分的含量与临床治疗效果密切相关。目前,茵陈蒿汤活性成分定量已有文献报道[15-17],如应用HPLC法测定茵陈蒿汤中绿原酸和栀子苷;田书霞等除了对上述2种物质定量,还对大黄蒽醌类成分进行定量研究;窦志华等建立了同时测定茵陈蒿汤中11个成分含量的测定方法。这些方法定量的成分主要来源于栀子、大黄,少有关注3味药材的代表性活性成分同时定量。因此,本实验建立了反相高效液相色谱法同时测定茵陈蒿汤3味药材中滨蒿内酯、儿茶素、绿原酸、东莨菪内酯、金丝桃苷、秦皮乙素、京尼平苷、槲皮素、京尼平、大黄酸、芦荟大黄素、大黄酚、大黄素、大黄素甲醚共14个有效成分的含量,为完善茵陈蒿汤质量评价标准提供了实验依据。
1 仪器与试药Agilent-1100系列HPLC仪(包括G1379A真空脱气仪、G1311A四元泵、G1367A自动进样器、G1316A柱温箱和G1315A DAD检测器),安捷伦公司;Agilent Eclipse Plus C18 (4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶),安捷伦公司;KQ-250DE型医用数控超声波清洗器,昆山市超声仪器有限公司;METTLER AE240型十万分之一电子天平,瑞士梅特勒公司;DJ-04药材粉碎机,上海定久公司;XW-80A型涡旋混合器,上海医科大学仪器厂。
茵陈、大黄、栀子购自上海德康医药商店,共3批次,经第二军医大学生药学教研室孙连娜副教授鉴定,具体信息见表 1。对照品滨蒿内酯(批号1902-17889)、儿茶素(批号1926-17777)、绿原酸(批号2997-17681)、东莨菪内酯(批号2955-19525)、金丝桃苷(批号2092-19526)、秦皮乙素(批号126-10815)、栀子苷(批号2846-17894)、槲皮素(批号3467-18782)、京尼平(批号1912-18950)、大黄酸(批号938-17891)、芦荟大黄素(批号984-17898)、大黄酚(批号1644-17899)、大黄素(批号2669-17890)、大黄素甲醚(批号1285-17669) 均购自上海诗丹德生物技术有限公司(纯度≥98.0%),磷酸为分析纯,乙腈为色谱纯,水为超纯水。
|
|
表 1 样品信息 Table 1 Information of samples |
色谱柱:Agilent Eclipse Plus C18 (4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~5 min,5%A;5~12 min,5%A→10%A;12~30 min,10%A→15%A;30~46 min,15%A→35%A;46~47 min,35%A→45%A;47~60 min,45%A→55%A;60~65 min,55%A→95%A;65~70 min,95%A→5%A;70~75 min,5%A);检测波长210 nm(0~21 min测定儿茶素、绿原酸和秦皮乙素,31~50 min测定京尼平、东莨菪内酯、滨蒿内酯和槲皮素)、238 nm(21~31 min测定京尼平苷和金丝桃苷)、254 nm(50~75 min测定芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚);流速:1.0 mL·min-1;柱温30 ℃;进样量:25 μL;运行时间:75 min。
2.2 溶液制备 2.2.1 供试品溶液参考已有文献[18],取大黄、栀子药材适量,置粉碎机中打碎,过100目筛,精密称定栀子粉末9 g及大黄粉末6 g,混合均匀;取茵陈18 g,精密称定,20倍水浸泡1 h。茵陈先煎,待液体体积减至1/2时加入上述混匀的栀子和大黄,煎煮10 min后6层纱布趁热过滤,收集滤液;残渣加入10倍水煎煮30 min再次提取;合并滤液,浓缩至3 g·mL-1。取浓缩液1 mL于10 mL量瓶中,用水稀释至刻度,经0.22 μm微孔滤膜过滤,取续滤液,即得。
2.2.2 混合对照品储备液精密称取滨蒿内酯、儿茶素、绿原酸、东莨菪内酯、金丝桃苷、秦皮乙素、京尼平苷、槲皮素、京尼平、大黄酸、芦荟大黄素、大黄酚、大黄素、大黄素甲醚的对照品适量,分别用甲醇溶解,制成质量浓度分别为1.12、1.52、0.90、1.39、1.17、1.20、1.00、1.14、1.58、1.36、1.12、0.92、1.11、1.10 mg·mL-1的14个对照品储备液。分别精密吸取儿茶素、东莨菪内酯、金丝桃苷、秦皮乙素、槲皮素、京尼平、芦荟大黄素、大黄酚、大黄素、大黄素甲醚的对照品储备液各0.2 mL,滨蒿内酯、大黄酸的对照品储备液各0.3 mL,绿原酸对照品储备液1 mL,京尼平苷对照品储备液2 mL,置同一10 mL量瓶中,用甲醇稀释至刻度,混匀,即得混合对照品溶液。将上述对照品储备液、混合对照品溶液于4 ℃保存,备用。
2.2.3 阴性样品溶液按处方比例,分别制备不含茵陈、栀子、大黄的阴性样品,按“2.2.1”项下方法制备阴性样品溶液。
2.3 方法学考察 2.3.1 系统适用性取阴性样品溶液、混合对照品溶液和样品溶液,在“2.1”项色谱条件下测定,发现各对照品色谱峰与其左右干扰峰分离度良好(分离度大于1.5),见图 1。
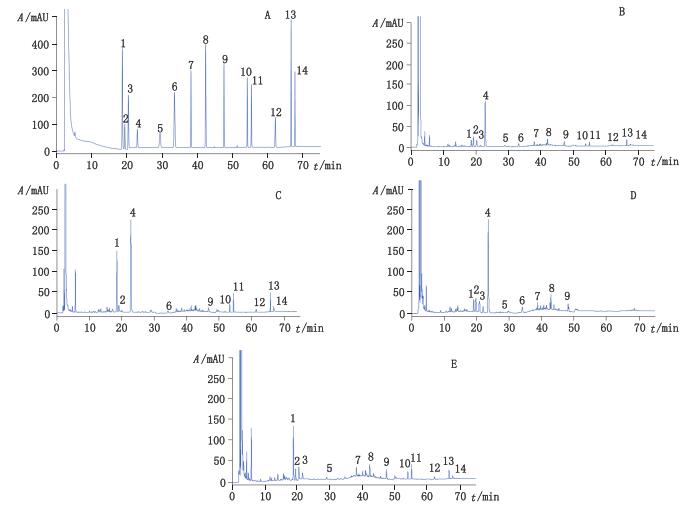
|
1.儿茶素(catechin) 2.绿原酸(chlorogenic acid) 3.秦皮乙素(esculetin) 4.京尼平苷(geniposide) 5.金丝桃苷(hyperoside) 6.京尼平(genipin) 7.东莨菪内酯(scopoletin) 8.滨蒿内酯(scoparone) 9.槲皮素(quercetin) 10.芦荟大黄素(aloe-emodin) 11.大黄酸(rhein) 12.大黄素(emodin) 13.大黄酚(chrysophanol) 14.大黄素甲醚(physcion) 图 1 混合对照品(A)、样品(B)、缺茵陈阴性样品(C)、缺大黄阴性样品(D)、缺栀子阴性样品(E)色谱图 Figure 1 HPLC chromatograms of reference substances(A), sample(B), negative samples without Artemisia capillaris Thunb.(C), Rheum palmatum L.(D)and Gardenia jasminoides Ellis(E) |
精密吸取混合对照品溶液1、5、10、20、30、40 μL,在“2.1”项色谱条件下测定,以峰面积积分值Y对进样量X(μg)回归,绘制标准曲线,计算14个成分的回归方程及线性范围,结果见表 2,表明在一定范围内进样量与峰面积呈良好的线性关系。
|
|
表 2 14个成分的回归方程、相关系数及线性范围 Table 2 The regression equations, correlation coefficients and linear range of 14 components |
精密吸取“2.2.2”项下混合对照品溶液25 μL,在“2.1”项色谱条件下连续进样6次,记录色谱图,分析计算数据得儿茶素、绿原酸、秦皮乙素、京尼平苷、金丝桃苷、京尼平、东莨菪内酯、滨蒿内酯、槲皮素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD(n=6) 分别为1.2%、1.2%、1.8%、0.95%、1.9%、0.80%、2.0%、0.70%、1.5%、0.56%、0.60%、0.56%、1.7%和1.8%,表明仪器精密度良好。
2.3.4 重复性试验取茵陈蒿汤原药材,按“2.2.1”项下方法平行制备供试品溶液6份,在“2.1”项色谱条件下测定,测得儿茶素、绿原酸、秦皮乙素、京尼平苷、金丝桃苷、京尼平、东莨菪内酯、滨蒿内酯、槲皮素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的平均含量分别为0.107、0.469、0.026、0.297、0.063、0.006、0.008、0.164、0.046、0.045、0.164、0.012、0.037、0.010 mg·g-1,RSD分别为0.80%、1.2%、1.6%、1.7%、1.5%、1.3%、1.8%、0.58%、1.1%、0.84%、1.8%、1.4%、1.6%、1.3%,表明该方法的重复性良好。
2.3.5 稳定性试验精密吸取供试品溶液25 μL,分别于0、2、4、8、12、24 h进样分析,测得峰面积的RSD分别为儿茶素1.3%、绿原酸0.67%、秦皮乙素1.1%、京尼平苷1.5%、金丝桃苷1.2%、京尼平0.60%、东莨菪内酯0.97%、滨蒿内酯1.0%、槲皮素1.7%、芦荟大黄素1.5%、大黄酸1.8%、大黄素1.9%、大黄酚1.4%、大黄素甲醚1.5%,表明供试品溶液中待测成分在24 h内稳定性良好。
2.3.6 回收率试验精密称取6份已知含量的茵陈蒿汤原药材样品16.5 g (茵陈9 g,栀子4.5 g,大黄3 g),精密添加一定体积的对照品储备液,按“2.2.1”项下方法制成供试品溶液,在“2.1”项色谱条件下测定,计算各成分的加样回收率以及RSD,结果见表 3。
|
|
表 3 茵陈蒿汤加样回收率试验结果(n=6) Table 3 Recovery results of Yin-Chen-Hao-Tang |
分别称取3个批次的茵陈蒿汤原药材,按“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,通过回归方程计算各成分在样品中的含量,结果见表 4。
|
|
表 4 茵陈蒿汤中各成分的不同批次含量测定结果(mg·g-1,n=3) Table 4 The determining results of different batches of samples |
本实验考察了煎煮法和超声法2种提取方法,实验结果表明2种方法均能提取出茵陈蒿汤的有效成分。根据传统提取方法为煎煮,且临床使用茵陈蒿汤亦为水煎液,因此,为保证其与传统给药方式和临床实际相一致,采用煎煮法。
3.2 色谱条件的优化 3.2.1 流动相的考察在流动相的选择上,比较了乙腈-水、乙腈-0.1%磷酸水溶液流动相,以各色谱峰分离度、出峰时间、峰形为评价指标。乙腈-0.1%磷酸水溶液梯度洗脱时,柱压小,各色谱峰分离良好,故选定乙腈-0.1%磷酸水溶液作为流动相。
3.2.2 检测波长的选择根据中国药典2015年版[19],选定蒽醌类成分(芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚)检测波长为254 nm,苷类成分京尼平苷检测波长为238 nm,金丝桃苷在此波长下也有很好的吸收,因此2种苷类均在此波长下定量。本研究采用波长切换法,绿原酸、儿茶素、秦皮乙素、京尼平、东莨菪内酯、滨蒿内酯、槲皮素在210 nm处有较好吸收,干扰少,故在210 nm对绿原酸、儿茶素、秦皮乙素、京尼平、东莨菪内酯、滨蒿内酯、槲皮素进行定量分析。综合考虑,本研究选择波长切换法210 nm(0~21 min,31~50 min)、238 nm(21~31 min)、254 nm(50~75 min)对14个化合物进行定量分析。
4 结论本实验建立了HPLC法同时测定茵陈蒿汤中14个成分的含量,方法简便,快速,测定结果准确可靠,重复性好,实用性强,可用于对茵陈蒿汤中14个物质的含量测定及质量控制。
| [1] |
邓中甲. 方剂学[M]. 北京: 中国中医药出版社, 1998, 293. DENG ZJ. Prescriptions[M]. Beijing: China Press of Traditional Chinese Medicine, 1998, 293. |
| [2] |
WANG S, LI X, NIU Y, et al. Identification and screening of chemical constituents with hepatoprotective effects from three traditional Chinese medicines for treating jaundice[J]. J Sep Sci, 2016, 39(19): 3690. DOI:10.1002/jssc.v39.19 |
| [3] |
王永宏, 赵晨曦, 陈本美, 等. 茵陈蒿汤对二甲基亚硝胺诱导大鼠肝纤维化的逆转作用[J]. 中国中药杂志, 2014, 39(8): 1473. WANG YH, ZHAO CX, CHEN BM, et al. Reverse effect of Yinchenhao decoction in dimethyl nitrosamine-induced hepatic fibrosis in rats[J]. China J Chin Mater Med, 2014, 39(8): 1473. |
| [4] |
李娟. 茵陈蒿汤治疗急性黄疸型肝炎的观察[J]. 中外医学研究, 2014, 12(7): 37. LI J. The observation of the acute jaundice hepatitis after the treatment by Yinchenhao Tang[J]. Chin Foreign Med Res, 2014, 12(7): 37. |
| [5] |
LEE HI, LEE MK. Coordinated regulation of scopoletin at adipose tissue-liver axis improved alcohol-induced lipid dysmetabolism and inflammation in rats[J]. Toxicol Lett, 2015, 237(3): 210. DOI:10.1016/j.toxlet.2015.06.016 |
| [6] |
SUBRAMANIAM SR, ELLIS EM. Umbelliferone and esculetin protect against N-nitrosodiethylamine-induced hepatotoxicity in rats[J]. Cell Biol Int, 2016, 40(7): 761. DOI:10.1002/cbin.v40.7 |
| [7] |
谭桢, 刘爱明, 罗敏, 等. 茵栀黄注射液抗胆汁淤积药效成分的筛选及其作用机制研究[J]. 中国中药杂志, 2016, 41(6): 1113. TAN Z, LIU AM, LUO M, et al. Screening of effective ingredients of Yinzhihuang injection against cholestasis and their mechanism[J]. China J Chin Mater Med, 2016, 41(6): 1113. |
| [8] |
史秀玲, 高银辉. 绿原酸对小鼠急性肝损伤的保护作用[J]. 中国实验方剂学杂志, 2011, 17(19): 199. SHI XL, GAO YH. Protective effects of chlorogenic acid on injury in mice[J]. Chin J Exp Tradit Med Form, 2011, 17(19): 199. DOI:10.3969/j.issn.1005-9903.2011.19.056 |
| [9] |
ZHANG JQ, SHI L, XU XN, et al. Therapeutic detoxification of quercetin against carbon tetrachloride-induced acute liver injury in mice and its mechanism[J]. J Zhejiang Univ Med Sci, 2014, 15(12): 1039. DOI:10.1631/jzus.B1400104 |
| [10] |
CHOI JH, KIM D W, YUN N, et al. Protective effects of hyperoside against carbon tetrachloride-induced liver damage in mice[J]. J Nat Prod, 2011, 74(5): 1055. DOI:10.1021/np200001x |
| [11] |
CHEN P, CHEN Y, WANG Y, et al. Comparative evaluation of hepatoprotective activities of geniposide, crocins and crocetin by CCl4-induced liver injury in mice[J]. Biomol Ther, 2016, 24(2): 156. DOI:10.4062/biomolther.2015.094 |
| [12] |
NAKATAKE R, TSUDA T, MATSUURA T, et al. Genipin inhibits the induction of inducible nitric oxide synthase through the inhibition of NF-kappaB activation in rat hepatocytes[J]. Drug Metab Lett, 2016, 10(4). |
| [13] |
KIM J, KIM HY, LEE SM. Protective effects of geniposide and genipin against hepatic ischemia/reperfusion injury in mice[J]. Biomol Ther, 2013, 21(2): 132. DOI:10.4062/biomolther.2013.005 |
| [14] |
覃鲁珊, 赵海平, 赵艳玲, 等. 大黄蒽醌与鞣质对大鼠肝脏的保护和损伤双向作用[J]. 中国中西医结合杂志, 2014, 34(6): 698. QIN LS, ZHAO HP, ZHAO YL, et al. Protection and bidirectional effect of rhubarb anthraquinone and tannins for rat's liver[J]. Chin J Integr Tradit West Med, 2014, 34(6): 698. |
| [15] |
葛建华, 窦志华, 罗琳, 等. HPLC法测定茵陈蒿汤中绿原酸和栀子苷的含量[J]. 江苏中医药, 2009, 41(1): 56. GE JH, DOU ZH, LUO L, et al. Simultaneous determination of chlorogenic acid and geniposide in Yin-Chen-Hao-Tang by HPLC[J]. Jiangsu Tradit Chin Med, 2009, 41(1): 56. |
| [16] |
田书霞, 阎姝, 王竹云, 等. 高效液相法同时测定茵陈蒿汤中7种成分[J]. 时珍国医国药, 2013, 24(2): 399. TIAN SX, YAN S, WANG ZY, et al. Simultaneous determination of seven constituents in Yin-Chen-Hao-Tang by HPLC[J]. Lishizhen Med Mater Med Res, 2013, 24(2): 399. |
| [17] |
窦志华, 孟萍, 姜晓燕, 等. 10家医院饮片组方的茵陈蒿汤中11种成分的含量测定[J]. 中国实验方剂学杂志, 2015, 21(23): 44. DOU ZH, MENG P, JIANG XY, et al. Determination of 11 constituents in Yinchenhao Tang composed by decoction pieces from hospitals of traditional Chinese medicine[J]. Chin J Exp Tradit Med Form, 2015, 21(23): 44. |
| [18] |
ZHANG H, WANG X, HU P, et al. Serum metabolomic characterization of liver fibrosis in rats and anti-fibrotic effects of Yin-Chen-Hao-Tang[J]. Molecules, 2016, 21(1): E126. |
| [19] |
中国药典2015年版. 一部[S]. 2015: 23, 239, 248. ChP 2015.Vol Ⅰ[S]. 2015:23, 239, 248 |
 2017, Vol. 37
2017, Vol. 37 
