氨基酸是组成蛋白质的基本单元,在人及动物生命活动中起着举足轻重的作用。除甘氨酸外,所有构成蛋白质的氨基酸都可以分为D-型和L-型。光学纯氨基酸是合成多肽和内酰胺类抗生素等药物的重要中间体,在药物合成、新材料开发、食品添加剂和精细化学品的研发等方面都有巨大的应用价值。
传统生命科学研究认为,除甘氨酸外,哺乳动物体内存在的构成蛋白质的其他19种氨基酸都是L-型氨基酸。自1980年起,随着现代分析技术的发展,研究者发现有数种内源性D-型氨基酸存在于人类和哺乳动物的体液和组织中,例如D-丝氨酸[1-2]、D-天门冬氨酸[3]、D-丙氨酸[4]和D-谷氨酸[5]等。研究发现,微量存在的D-型氨基酸或其与蛋白质的结合物在神经系统和内分泌系统的多种疾患的发病机制中起到了重要的调节子作用,或者可作为重要的疾病(如阿尔兹海默病、帕金森病、肌肉萎缩性侧面硬化病和视网膜病变等)标志物;而相对应的L-型氨基酸却没有以上生理功能[6-7]。近年来通过研究D-型氨基酸在哺乳动物体内的机能及其与某些疾病的关系,以开发新型药物、健康食品和新的疾病诊断方法已经成为相关领域的研究热点。但是生物样本中的D-型氨基酸相对于L-型氨基酸而言极其微量,因此体内氨基酸的手性拆分研究对D-型氨基酸的生理机能探索非常关键。
在D-型氨基酸的分析方法中,液相色谱法由于具有适用范围广、专属性较强、分离效率高、检测灵敏度高以及可用于制备分离等特点,近年来被广泛应用于制药工业、食品科学、代谢组学等领域的手性氨基酸分析中[8-10]。其中,手性固定相法(CSP法)是利用手性选择剂直接拆分对映体,并能同时高效率地得到2种高旋光纯度的对映体,也可拆分一些特殊的外消旋体(如不能衍生化或易消旋的化合物,具有特殊手性结构如螺旋或螺旋桨构象的化合物)。常用的液相色谱手性固定相包含“刷型”手性固定相(Pirkle型和QD型)[11-14]、蛋白质类固定相[15]、环糊精固定相[16]和多糖衍生物类手性固定相[17]、冠醚类手性固定相[18]、手性配体类固定相[19]、大环抗生素类固定相类[20]等。
其中,“刷型”手性固定相是20世纪80年代报道较多的HPLC中非常重要的一类手性固定相,这类手性固定相一般通过一定长度的间隔臂连接一个单分子层的手性有机分子到硅胶载体上而制得,因形状呈刷状,因而被称之为“刷型”或“束型”手性固定相[21]。“刷”型手性固定相具有确定的化学结构,其共同结构特征是在手性中心附近至少含有下列基团之一:π-酸或π-碱芳基;极性氢键给体/受体基团;形成偶极相互作用的极性基团;能够提供立体位阻、范德华作用或构型控制作用的大体积非极性基团[22-23]。该固定相具有独特的优点:(1) 经久耐用,共价键的存在使得硅胶上的键合物不易流失、可承受过载的样品量、可使用强溶剂进行洗脱、柱子可完全再生以及可适用于超临界流体色谱等;(2) 高色谱性能,载体上手性有机分子的键合密度大,可承受较大的进样量而不改变固定相的性质;(3) 线性范围宽,从化合物的分析到制备都可使用;(4) 广泛的溶剂适宜性,正相、反相流动相都适用。此类固定相通常有2种键合途径:(1) 含末端羧基的手性选择剂与氨基键合硅胶进行缩合反应,生成含酰胺型的手性固定相;(2) 含异氰酸酯的手性选择剂与氨基键合硅胶进行缩合反应,得到脲型结构。目前已有大量的“刷型”手性色谱柱出现,主要有Sumichiral OA,Chiralpak QD和QN等,此类固定相已被广泛用于氨基酸、乙内酰脲、胺类、醇类及硫醇类药物对映体的拆分[24-25]。本文主要综述了常用的“刷型”手性固定相在D-氨基酸对映体分析中的应用进展。
1 Sumichiral OA型手性固定相Sumichiral OA型手性固定相是由氨基酸键合相组成,又称为氨基酸型的固定相,主要有OA 2000、OA 2500、OA 3000、OA 3100、OA 3200、OA 4700、OA 4900等系列,其化学结构及其在手性氨基酸拆分中的应用见表 1。商业化的Sumichiral OA型手性固定相,尤其是含有强吸电子基团(3,5-二硝基)的OA 2500、含有2个手性中心(R,S)的OA 4700等固定相制备的填充柱对手性氨基酸具有较好的拆分效果[26-27]。徐修容等[28]最早对氨基酸键合固定相的合成及应用进行了研究,制备了不同取代基团的L-缬氨酸-酰胺型化学键合手性固定相,应用于缬氨酸、亮氨酸、苯丙氨酸等的手性拆分,但是分离效果不是很理想。为了提高其手性拆分能力,刘晋钫等[29]对其骨架结构进行适当改性,通过在主链上增加1个手性碳,制备得到一类新型的氨基酸手性固定相用来拆分N-乙酰基-α-氨基酸甲酯、N-乙酰基-β-二茂铁基丙氨酸乙酯及N-叔丁氧羰基亮氨酸甲酯等对映异构体。结果表明:该类型固定相对N-叔丁氧碳基亮氨酰亮氨酸甲酯的外消旋体具有良好的手性拆分能力,分离系数可达1.79。祝馨怡等[30]制备了L-苯丙氨酸键合型硅胶基质色谱固定相,并用于α-氨基酸的手性分离。在上述研究的基础上,可以发现通过对氨基酸进行适当的化学改性或更换固定相骨架上的氨基酸种类,可以增强固定相与分析物之间的三点作用力,从而改善化合物的手性分离。
|
|
表 1 Sumichiral OA型手性固定相的类型 Table 1 Sumichiral OA type CSPs |
但是目前商业化的Sumichiral OA系列手性色谱柱(粒径为3~5 μm)主要是硅胶基质的,在使用过程中存在pH适用范围窄(pH=2~8),传质阻力大,通透性较差,制备工艺复杂且成本高等不足[26];近年来,粒径为1~2 μm的填料迅速普及,它可显著提高柱效和缩短分析时间,但柱背压随填料粒径的减小而急剧上升[31]。因此,开发高效快速、高选择性且制备方法简单的新型手性色谱分离材料,已成为当前手性色谱固定相研究领域的热点之一。
整体柱是用有机或无机聚合方法在色谱柱内进行原位聚合形成的多孔的连续床固定相[32],可通过控制聚合条件(聚合物配方、反应时间、温度或光照时间)得到具有理想孔径和结构均匀的整体柱床。它不仅制备简单,耗时短,成本低,适合推广和应用,而且通透性好,机械强度高,柱压低,生物兼容性好,可实现分析物快速、高效、高通量的分离[33]。近年来,硅胶基质整体柱的研究取得了一系列的重大进展,文献报道的TEPIC-BACM-L手性整体柱在分离烷基苯的时候其柱效高达200 000 plates·s-1,柱压只有4.0 MPa[34]。但是氨基酸功能化的整体柱报道的非常少,Jun He等[35]制备了不同链长的氨基酸有机聚合物整体柱应用于电色谱同时分离了含有多个手性中心的麻黄碱和伪麻黄碱化合物,这将为开发氨基酸有机聚合物整体柱并将其应用于D-型氨基酸的手性分离提供了很大的可能。因此制备微径整体柱,不仅能提高氨基酸D/L异构体的分离效率,在较短的时间内取得较好的分离效果,且将其应用于实际样品分析中能够明显节省样品用量,因此对于微量样品的分离具有非常大的优势。根据其固定相的结构来看,将该固定相应用于整体柱中实现对手性样品的分离尤其是对D-氨基酸的分离检测具有很大的应用潜力。
2 金鸡纳碱类手性固定相天然产物金鸡纳生物碱(辛可宁、辛可尼丁、奎宁和奎尼丁等)分子是较早的抗疟药物,结构中含有多个手性中心,具有廉价易得、稳定和结构易于改性等特点,现已经广泛地被用于手性催化剂、手性配体、手性选择剂等方面[48]。其中较为重要的奎尼丁和奎宁类生物碱,属于氨基醇类化合物,目前已有一系列不同类型的弱阴离子如奎尼丁或奎宁离子修饰的硅胶填充柱[49-50]被开发,这些固定相在反相色谱条件下可分离氨基酸等手性对映体,特别适合拆分含有羧基和磷酸基等的酸性化合物;在正相条件下可用于分离醇类和联苯酚对映体[51]。其拆分机理是通过氢键、离子键、疏水作用等与对映体形成具有不同稳定性和分配性质的非对映体混合物而实现拆分。
目前,金鸡纳碱类硅胶基质填充柱的制备及其在手性氨基酸尤其是D-型氨基酸分离分析中的应用已经非常成熟。例如Hamase等[52]利用Chiralpak QN-AX和Chiralpak QD-AX实现了对老鼠组织、体液以及尿液中脂肪族氨基酸D-Val、D-allo-Ile、D-Ile、D-Leu的定量分析,说明其在实际样品的D-氨基酸分离分析中将具有不错的应用前景。Miyoshi等[39]利用Chiralpak QN-AX实现了日本传统黑须醋在陶器罐发酵生产过程中D-氨基酸的分析,同时在传统制作的黑须醋中发现了大量的D-Ala、D-Asp和D-Glu以及少量的D-Ser、D-Leu和D-allo-Ile的存在。Han等[5, 53]将QD-AX填充柱应用于二维液相色谱中实现了对鼠脑组织及其体液中D-Asp和D-Glu的分离分析。上述研究结果充分证明了奎尼丁和奎宁类硅胶基质手性固定相在实际样品的D-氨基酸手性拆分中的重要作用及应用价值。
虽然奎尼丁和奎宁类硅胶基质填充柱能够对氨基酸尤其是D-氨基酸实现较好的分离,但仍存在分离时间长,稳定性不好等缺点[54]。为了克服这些不足,奎尼丁和奎宁功能化的聚合物整体柱尤其是奎尼丁功能化的整体柱得到了快速发展。Lämmerhofer等[55-56]制备了一系列金鸡纳碱功能化的整体柱[例如,叔丁基氨基甲酰奎尼丁(t-BuCQD)修饰的硅胶基质整体柱和O-[2-(甲基丙烯酰氧基)乙基氨基甲酰基]-10,11-二氢奎尼丁(MQD)修饰的有机聚合物整体柱]应用于电色谱中分离了Leu、Ser、Val等几种手性氨基酸,但其分离的氨基酸种类非常有限。为了扩大其应用范围,本课题组制备了适用于微径液相色谱的poly(MQD-co-HEMA-co-EDMA)有机聚合物整体柱,发现其对3,5-二硝基苯甲酰(3,5-NBD)、3,5-二氯苯甲酰(3,5-NClB)、3,5-二甲氧基苯甲酰(3,5-DMB)、芴甲氧羰酰氯(Fmoc)、苯甲酰(B)、对硝基苯甲酰(p-NB)、邻氯苯甲酰(o-ClB)、间氯苯甲酰(m-ClB)、对氯苯甲酰(p-ClB)等修饰的47种氨基酸衍生物具有非常好的手性选择性,其中44种衍生物得到了基线分离[57]。后续本课题组为考察上述整体柱中共聚单体甲基丙烯酸-2-羟基乙酯(HEMA)的作用,制备了poly(MQD-co-EDMA)整体柱,研究结果显示HEMA对该整体柱的手性选择性影响不大。同时,将该整体柱与激光诱导荧光检测器(micro-LC/LIF-D)联用,实现了10种NBD-衍生化氨基酸的手性分离以及对D-型和L-型氨基酸的出峰顺序确认,发现除谷氨酸外,其他氨基酸都是D-型出峰在前,这有利于在实际生物样品中大量L-型氨基酸存在的同时,实现对微量D-型氨基酸的分离与检测[58]。以上例子充分说明,金鸡纳类“刷型”手性固定相在D-氨基酸检测中的重要作用和利用价值。
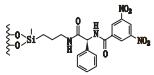
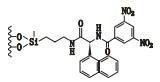
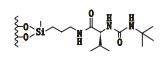
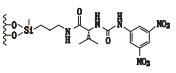
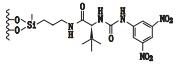
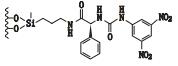
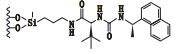
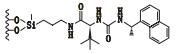
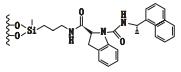
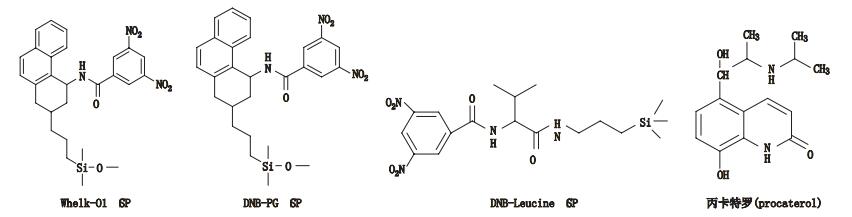
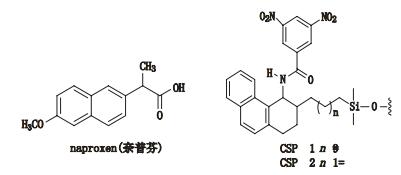
3 其他类 3.1 3,5-二硝基苯衍生化的固定相唐琴等[59]利用Whelk-O1[(3R,4S)-4-(3,5-dinitrobenzamido)-3-[3-(dimethylsilyloxy)propyl]-1,2,3,4-tert-rahydrophenanthrene]、DNB-PG、DNB-Leucine 3种“刷型”手性固定相(图 1)在正相流动相系统条件下使丙卡特罗得到了很好的拆分,选择系数达到1.4~1.8。William等[60]利用2种3,5-二硝基苯衍生化的固定相(图 2)对非甾体类抗炎药(萘普生)进行了手性分离,从分离结果上看,在手性固定相CSP 1上除了塞洛芬酸和酮洛芬,其他手性药物的的选择因子都是α > 1.15,在手性固定相CSP 2上所有外消旋体都达到了基线分离。以上例子说明,3,5-二硝基苯衍生化的固定相对外消旋体的分离具有很好的效果。
|
图 1 3种手性固定相及丙卡特罗的分子结构式 Figure 1 Molecular structures of three CSPs and procaterol |
|
图 2 2种固定相及非甾体手性药物奈普芬 Figure 2 Molecular structures of two CSPs and naproxen |
Svec等[61]首次利用铜催化的叠氮化物-炔烃环加成(CuAAC)反应将脯氨酸加成键合到毛细管柱上制备成硅胶基质的整体柱,使N-(3,5-NBD)亮氨酸己二烯酰胺和二乙酰胺,N-(3,5-NBD)丙氨酸己二烯酰胺和二乙酰胺得到了较好的分离,分离度高达11.4。
4 结语大部分药物都具有手性中心,手性分析分离的发展必定会促进手性药物的发展,也为手性新药的研制和开发提供了有效的分析手段。各种“刷型”手性固定相已经在D-氨基酸分析中得到广泛的应用,今后的研究方向应考虑进一步加强对基于氨基酸键合型手性固定相在其他手性样品上的分离及其在实际生物样品中的应用。目前这类手性固定相研究的还不是很多,一方面要制备出合适结构的单体;另一方面也要找到好的载体,使其更好地发挥拆分作用。因此,有理由相信,随着研究的深入,利用“刷型”手性固定相尤其是OA型手性固定相来进行手性氨基酸的拆分,甚至在生物样品中应有更广阔的应用前景,也会成为今后的研究热点。
| [1] |
MORENO-GUZMAN M, GARCIA-CARMONA L, MOLINEROFERNANDEZ A, et al. Bi-enzymatic biosensor for on-site, fast and reliable electrochemical detection of relevant D-amino acids in bacterial samples[J]. Sens Actuators B, 2017, 242(1): 95. |
| [2] |
HASHIMOTO A, NISHIKAMA T, HAYASHI T, et al. The presence of free D-serine in rat brain[J]. Febs Lett, 1992, 296(1): 33. DOI:10.1016/0014-5793(92)80397-Y |
| [3] |
KIM PM, DUAN X, HUANG AS, et al. Aspartate racemase, generating neuronal D-aspartate, regulates adult neurogenesis[J]. Proc Natl Acad Sci, 2010, 107(7): 3175. DOI:10.1073/pnas.0914706107 |
| [4] |
MIYOSHI Y, HAMASE K, TOJO Y, et al. Determination of D-serine and D-alanine in the tissues and physiological fluids of mice with various D-amino-acid oxidase activities using two-dimensional high-performance liquid chromatography with fluorescence detection[J]. J Chromatogr B, 2009, 877(24): 2506. DOI:10.1016/j.jchromb.2009.06.028 |
| [5] |
HAN H, MIYOSHI Y, UENO K, et al. Simultaneous determination of D-aspartic acid and D-glutamic acid in rat tissues and physiological fluids using a multi-loop two-dimensional HPLC procedure[J]. J Chromatogr B, 2011, 879(29): 3196. DOI:10.1016/j.jchromb.2011.01.023 |
| [6] |
SASABEA J, MIYOSHI Y, SUZUKI M, et al. D-amino acid oxidase controls motoneuron degeneration through D-serine[J]. Proc Natl Acad Sci, 2012, 109(2): 627. DOI:10.1073/pnas.1114639109 |
| [7] |
HAN H, WANG QQ, WU HH, et al. Establishment and application of an automated chiral two dimensional high performance liquid chromatography for Bio-analysis of D-acidic amino acids[J]. Chin J Anal Chem, 2014, 42(6): 891. DOI:10.1016/S1872-2040(14)60746-5 |
| [8] |
KATO S, ISHIHARA T, HEMMI H, et al. Alterations in D-amino acid concentrations and microbial community structures during the fermentation of red and white wines[J]. J Biosci Bioeng, 2011, 111(1): 104. DOI:10.1016/j.jbiosc.2010.08.019 |
| [9] |
TAO YQ, QUEBBEMANN NR, JULIAN RR, et al. Discriminating D-amino acid-containing peptide epimers by radical directed dissociation mass spectrometry[J]. Anal Chem, 2012, 84(15): 6814. DOI:10.1021/ac3013434 |
| [10] |
MUTAGUCHI Y, KOBAYASHI J, OIKAWA T, et al. D-amino acids in fermentative foods[M]/D-Amino Acids. Tokyo, Japan: Springer, 2016:341
|
| [11] |
SARDELLA R, CAROTTI A, GIOIELLO A, et al. Chromatographyic separation of free dafachronic acid epimers with a novel trizole click quinidine-based chiral stationary phase[J]. J Chromatogr A, 2014, 1339(25): 96. |
| [12] |
PIETTE V, LAMMERHOFER M, BISCHOFF K, et al. Highperformance liquid chromatographic enantioseparation of N-protected α-amino acids using nonporous silica modified by a quinine carbamate as chiral stationary phase[J]. Chirality, 1997, 9(2): 157. DOI:10.1002/(ISSN)1520-636X |
| [13] |
LAMMERHOFER M, LINDNER W. Quinine and quinidine derivatives as chiral selectors I. Brush type chiral stationary phases for high-performance liquid chromatography based on cinchonan carbamates and their application as chiral anion exchangers[J]. J Chromatogr A, 1996, 741(1): 33. DOI:10.1016/0021-9673(96)00137-9 |
| [14] |
PIETTE V, LAMMERHOFER M, LINDNER W, et al. Enantiomer separation of N-protected amino acids by non-aqueous capillary electrophoresis and high-performance liquid chromatography with tert-butyl carbamoylated quinine in either the background electrolyte or the stationary phase[J]. J Chromatogr A, 2003, 987(1-2): 421. DOI:10.1016/S0021-9673(02)01465-6 |
| [15] |
LIU Z, OTSUKA K, TERABE S, et al. Physically adsorbed chiral stationary phase of avidin on monolithic silica column for capillary electrochromatography and capillary liquid chromatography[J]. Electrophoresis, 2002, 23(17): 2973. DOI:10.1002/(ISSN)1522-2683 |
| [16] |
WANG Y, ONG TT, LI LS, et al. Enantioseparation of a novel" click" chemistry derived native β-cyclodextrin chiral stationary phase for high-performance liquid chromatography[J]. J Chromatogr A, 2009, 1216(12): 2388. DOI:10.1016/j.chroma.2009.01.039 |
| [17] |
ISLAM MF, LEE W. Liquid chromatographic enantiomer separation of α -amino acid esters as nitrobenzoxadiazole derivatives using polysaccharide-derived chiral stationary phases[J]. J Chosun Nat Sci, 2015, 8(2): 111. DOI:10.13160/ricns.2015.8.2.111 |
| [18] |
LEE MS, KHAN FN, SHIN SC, et al. Comparison of polarimetry and crown ether-based HPLC chiral stationary phase method to determine(L)-amino acid optical purity[J]. Food Chem, 2012, 135(2): 343. DOI:10.1016/j.foodchem.2012.05.003 |
| [19] |
SCHMID MG, SCHREINER K, REISINGER D, et al. Fast chiral separation by ligand-exchange HPLC using a dynamically coated monolithic column[J]. J Sep Sci, 2006, 29(10): 1470. DOI:10.1002/(ISSN)1615-9314 |
| [20] |
LLISZ I, BERKECZ R, PÉTER A. HPLC separation of amino acid enantiomers and small peptides on macrocyclic antibiotic-based chiral stationary phases:a review[J]. J Sep Sci, 2006, 29(10): 1305. DOI:10.1002/(ISSN)1615-9314 |
| [21] |
DAPPEN R, ARM H, MEYER VR. Applications and limitations of commercially available chiral stationary phases for high-performance liquid chromatography[J]. J Chromatogr A, 1986, 373: 1. DOI:10.1016/S0021-9673(00)80205-8 |
| [22] |
PIRKLE WH, FINN JM, SCHREINER JL, et al. A widely useful chiral stationary phase for the high-performance liquid chromatography separation of enantiomers[J]. J Am Chem Soc, 1981, 103(13): 3964. DOI:10.1021/ja00403a076 |
| [23] |
PIRKLE WH, HYUN MH. A chiral stationary phase for the facile resolution of amino acids, amino alcohols and amines as the N-3, 5-dinitrobenzoyl derivatives[J]. J Org Chem, 1984, 49(17): 3043. DOI:10.1021/jo00191a001 |
| [24] |
OHKUBO T, TNO S, SUGAWARA K, et al. Enantiomer separation of dihydropyridine derivative calcium antagonists by highperformance liquid chromatography with chiral stationary phases[J]. J Chromatogr A, 1994, 659(2): 467. DOI:10.1016/0021-9673(94)85088-7 |
| [25] |
HAMASE K, MORIKAWA A, OHGUSU T, et al. Comprehensive analysis of branched aliphatic D-amino acids in mammals using an integrated multi-loop two-dimensional column-switching highperformance liquid chromatographic system combining reversedphase and enantioselective columns[J]. J Chromatogr A, 2007, 1143(1-2): 105. DOI:10.1016/j.chroma.2006.12.078 |
| [26] |
KATO M, DULAY MT, BENNETT B, et al. Enantiomeric separation of amino acids and nonprotein amino acids using a particle-loaded monolithic column[J]. Electrophoresis, 2000, 21(15): 3154. |
| [27] |
KATO M, FUKUSHIMA T, SANTA T. Preparation and evaluation of new Pirkle type chiral stationary phases with long alkyl chains for the separation of amino acid enantiomers derivatized with NBD-F[J]. Analyst, 1998, 123: 2877. DOI:10.1039/a806304d |
| [28] |
徐修容, 唐琴梅, 施铭英. 高效液相色谱手性固定相的研究Ⅱ、数种L-缬氨酸-酰胺型固定相的制备及拆分对映体的比较[J]. 色谱, 1984, 1(1): 22. XU XR, TANG QM, SHI MY. Stationary phase in liquid chromatography Ⅱ, preparation of a series of substituted L-valylamide type bonded phases and comparison in resolution of enantionmers[J]. Chin J Chromatogr, 1984, 1(1): 22. |
| [29] |
刘晋钫, 徐修容, 黄嘉鑫. 高效液相色谱手性固定相的研V-二肽叔丁酰胺型手性固定相拆分α-氨基酸、二茂铁基氨基酸及二生物对映异构体[J]. 色谱, 1990, 8(4): 229. LIU JF, XU XR, HUANG JX. Chiral stationary phases in liquid chromatography V, resolution of racemic derivatives of α-amino acid, ferrocenyl amino acid, and dipeptide on tert-butylamide bonded phases[J]. Chin J Chromatogr, 1990, 8(4): 229. |
| [30] |
祝馨怡, 蔡迎春, 陈立仁. α-氨基酸在L-苯丙氨酸手性配体交换色谱固定相上的分研究[J]. 化学试剂, 2003, 25(2): 65. ZHU XY, CAI YC, CHEN LR. Study on the enantioseparation of amino acids by high performance ligand-exchange chromatography on L-phenylalanine chiral stationary phases[J]. Chem Reagents, 2003, 25(2): 65. |
| [31] |
BUNCH DR, WANG S. Applications of monolithic columns in liquid chromatography-based clinical chemistry assays[J]. J Sep Sci, 2011, 34(16-17): 2003. |
| [32] |
AGGARWAL P, TOLLEY HD, LEE ML. Monolithic bed structure for capillary liquid chromatography[J]. J Chromatogr A, 2012, 1219(6): 1. |
| [33] |
CABRERA K. Applications of silica-based monolithic HPLC columns[J]. J Sep Sci, 2004, 27(10-11): 843. DOI:10.1002/(ISSN)1615-9314 |
| [34] |
HOSOYA K, HIRA N, YAMAMOTO K, et al. High-performance polymer-based monolithic capillary column[J]. Anal Chem, 2006, 78(16): 5729. DOI:10.1021/ac0605391 |
| [35] |
HE J, WANG XC, MIKE M, et al. Amino acid bound surfactants:a new synthetic family of polymeric monoliths opening up possibilities for chiral separations in capillary electrochromatography[J]. Anal Chem, 2012, 84(12): 5236. DOI:10.1021/ac300944z |
| [36] |
OYAMA T, NEGISHI E, ONIGAHARA H, et al. Design and synthesis of a novel pre-column derivatization reagent with a 6-methoxy-4-quinolone moiety for fluorescence and tandem mass spectrometric detection and its application to chiral amino acid analysis[J]. J Pharm Biomed Anal, 2015, 116(10): 71. |
| [37] |
NAOBUMI O, HAJIMU K, et al. Enantiomer separation by HPLC with some urea derivatives of L-valine as novel chiral stationary phases[J]. J Liq Chromatogr, 1986, 9(2-3): 511. DOI:10.1080/01483918608076650 |
| [38] |
董斌, 姜珍, 梁爱仙. OA-2500S手性柱拆分3种氨基酸对映体[J]. 西北药学杂志, 2010, 25(5): 325. DONG B, JIANG Z, LIANG AX. Separation of three kinds of amino acid enantiomers on OA-2500S[J]. Northwest Pharm J, 2010, 25(5): 325. |
| [39] |
MIYOSHI Y, NAGANO M, ISHIGO S, et al. Chiral amino acid analysis of Japanese traditional Kurozu and the developmental changes during earthenware jar fermentation processes[J]. J Chromatogr B, 2014, 966(1): 187. |
| [40] |
KOGA R, MIYOSHI Y, NEGISHI E, et al. Enantioselective twodimensional high-performance liquid chromatographic determination of N-methyl-D-aspartic acid and its analogues in mammals and bivalves[J]. J Chromatogr A, 2012, 1269(21): 255. |
| [41] |
HAMASE K, MIYOSHI Y, UENO K, et al. Simultaneous determination of hydrophilic amino acid enantiomers in mammalian tissues and physiological fluids applying a fully automated microtwo-dimensional high-performance liquid chromatographic concept[J]. J Chromatogr A, 2010, 1217(7): 1056. DOI:10.1016/j.chroma.2009.09.002 |
| [42] |
KARAKAWA S, MIYOSHI Y, KONNO R, et al. Two-dimensional high-performance liquid chromatographic determination of daynight variation of D-alanine in mammals and factors controlling the circadian changes[J]. Anal Bioanal Chem, 2013, 405(25): 8083. DOI:10.1007/s00216-013-7071-2 |
| [43] |
MIYOSHI Y, OYAMA T, ITOH Y, et al. Enantioselective twodimensional high-performance liquid chromatographic determination of amino acids; analysis and physiological significance of D-amino acids in mammals[J]. Chromatography, 2014, 35(1): 49. DOI:10.15583/jpchrom.2014.005 |
| [44] |
HAMASE K, NAKAUCHI Y, MIYOSHI Y, et al. Enantioselective determination of extraterrestrial amino acids using a two-dimensional chiral high-performance liquid chromatographic system[J]. Chromatography, 2014, 35(2): 103. DOI:10.15583/jpchrom.2014.014 |
| [45] |
CUI Y, JIANG Z, SUN JY, et al. Enantiomeric purity determination of(L)-amino acids with pre-column derivatization and chiral stationary phase:Development and validation of the method[J]. Food Chem, 2014, 158(1): 401. |
| [46] |
HANG Y, NISHIKAWA T, SATOH K, et al. Urinary excretion of D-serine in human:comparison of different ages and species[J]. Biol Pharm Bull, 1998, 21(2): 156. DOI:10.1248/bpb.21.156 |
| [47] |
沈含熙, 杨国生, 高如琦. 高效液相色谱手性固定相对氨基酸衍生物对映体分离研究[J]. 高等学校化学简报, 1997, 16(7): 1072. SHEN HX, YANG GS, GAO RQ. Studies on separation of derivatives of amino acid of enantiomers on chiral stationary phase by high performance liquid chromatography[J]. Chin J Chin Univ, 1997, 16(7): 1072. |
| [48] |
杨亚娜, 张敏如. 金鸡纳生物碱在手性分离中的应用[J]. 中国医药工业杂志, 2006, 37(8): 563. YANG YN, ZHANG MR. Application of cinchona in chiral separation[J]. Chin J Pharm, 2006, 37(8): 563. |
| [49] |
LAMMERHOFER M, GYLLENHAAL O, LINDNER W. HPLC enantiomer separation of a chiral 1, 4-dihydropyridine monocarboxylic acid[J]. J Pharm Biomed Anal, 2004, 35(2): 259. DOI:10.1016/S0731-7085(03)00644-7 |
| [50] |
BICKER W, LAMMERHOFER M, LINDNER W. Direct highperformance liquid chromatographic method for enantioselective and diastereoselective determination of selected pyrethroic acids[J]. J Chromatogr A, 2004, 1035(1): 37. DOI:10.1016/j.chroma.2004.02.036 |
| [51] |
ROSINI C, BERTUCCI C, PINI D, et al. Cinchona alkaloids for preparing new, easily accessible chiral stationary phases. I. 11-(10, 11-dihydro-6-methoxy-cinchonan-9-OL)-tiopropylsilanized silica[J]. Tetra Lett, 1985, 26(28): 3361. DOI:10.1016/S0040-4039(00)98298-4 |
| [52] |
HAMASE K, MORIKAWA A, OHGUSU T, et al. Comprehensive analysis of branched aliphatic D-amino acids in mammals using an integrated multi-loop two-dimensional column-switching highperformance liquid chromatographic system combining reversedphase and enantioselective columns[J]. J Chromatogr A, 2007, 1143(1-2): 105. DOI:10.1016/j.chroma.2006.12.078 |
| [53] |
HAN H, MIYOSHI Y, KOGA R, et al. Changes in D-aspartic acid and D-glutamic acid levels in the tissues and physiological fluids of mice with various D-aspartate oxidase activities[J]. J Pharm Biomed Anal, 2015, 116(10): 47. |
| [54] |
LAMMERHOFER M, SVEC F, FRECHET JMJ, e t a l. Chiral monolithic columns for enantioselective capillary electrochromatography prepared by copolymerization of a monomer with quinidine functionality. 2. Effect of chromatographic conditions on the chiral separations[J]. Anal Chem, 2000, 72(19): 4623. DOI:10.1021/ac000323d |
| [55] |
LAMMERHOFER M, SVEC F, FRECHET JMJ, et al. Monolithic stationary phases for enantioselective capillary electrochromatography[J]. J Microcolumn Sep, 2000, 12(12): 597. DOI:10.1002/(ISSN)1520-667X |
| [56] |
LAMMERHOFER M, GARGANO A. Monoliths with chiral surface functionalization for enantioselective capillary electrochromatography[J]. J Pharm Biomed Anal, 2010, 53(5): 1091. DOI:10.1016/j.jpba.2010.05.026 |
| [57] |
WANG QQ, FENG J, HAN H, et al. Enantioseparation of N-derivatized amino acids by micro-liquid chromatography using carbamoylated quinidine functionalized monolithic stationary phase[J]. J Chromatogr A, 2014, 1363(10): 207. |
| [58] |
WU HH, WANG QQ, RUAN M, et al. Enantioseparation of N-derivatized amino acids by micro-liquid chromatography/laser induced fluorescence detection using quinidine-based monolithic columns[J]. J Pharm Biomed Anal, 2016, 121(20): 244. |
| [59] |
唐琴, 陈先勇, 宋航. 丙卡特罗在三种刷型手性固定相上的直接拆分[J]. 分析测试学报, 2010, 29(4): 407. TANG Q, CHEN XY, SONG H. Study on direct separation of drug procaterol enantiomers by using three brush type CSPs[J]. J Instrum Anal, 2010, 29(4): 407. |
| [60] |
WILLIAM HP, CHRISTOPHER JW. An improved chiral stationary phase for the chromatographic separation of underivatized naproxen enantiomers[J]. J Liq Chromatogr, 1992, 15(11): 1947. DOI:10.1080/10826079208020869 |
| [61] |
MICHAEL DS, JEAN MJF, FRANTISEK S. In-column preparation of a brush-type chiral stationary phase using click chemistry and a silica monolith[J]. J Sep Sci, 2009, 32(1): 21. DOI:10.1002/jssc.v32:1 |
 2017, Vol. 37
2017, Vol. 37