硝苯地平(nifedipine)是二氢吡啶类钙拮抗剂,能选择性地拮抗钙离子通道,阻断平滑肌的兴奋收缩耦联,扩张血管,临床使用硝苯地平的普通制剂治疗高血压和心绞痛,半衰期短(2~3 h),易引起血压波动,反射性致心率加快,不利于心肌缺血和心力衰竭的控制,且短而强的扩血管作用可能增加冠心病的发病率[1-3]。而硝苯地平的缓释、控释制剂能够实现硝苯地平在体内的缓慢释放,维持血药浓度平衡,减少用药总剂量,减轻药物不良反应,药效显著延长。既保留了硝苯地平钙拮抗剂药效学的优良性能,又明显改善了其药动学特点,因此硝苯地平的缓释、控释制剂一直是医药界研究的热点。
目前国内外能够实现硝苯地平的零级释放的产品几乎都采用渗透泵技术,如德国拜耳公司生产的硝苯地平控释片(拜新同,Adalat GITS),其制备工艺复杂,需要进行二次压片、包衣和激光打孔等工序,生产难度大,设备要求高[4]。而自研的硝苯地平缓释片通过分析影响骨架片中药物释放的因素,筛选骨架材料羟丙甲纤维素的目标粘度及处方组成,有效控制药物接近恒速释放,避免了渗透泵片前期释药滞后、后期释放不完全等缺点,生产工艺简单,更适于大规模生产。
本文参考张启明等[5]《采用多条溶出曲线评价口服服固体制剂的内在质量》一文,对对照制剂进行剖析,并按照国家《关于开展仿制药质量和疗效一致性评价的意见》的要求,对自研硝苯地平缓释片和对照制剂(拜新同,Adalat GITS)进行释放曲线测定和对比,考察自研制剂与对照制剂在4种不同介质中释放曲线的一致性,并考察3批自研制剂释放曲线的均一性和重现性。结果自研制剂与对照制剂体外释放度基本一致。
1 仪器与试药岛津LC-2010高效液相色谱仪、Waters H-Class超高速液相色谱仪、UV检测器;安捷伦公司Zorbax SB-C18(150 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶);DISTEK EVOLUTION 6300自动溶出仪。
硝苯地平对照品:中国食品药品检定研究院,批号100338-200502,含量为99.9%。对照制剂:拜新同(Adalat GITS),拜耳医药保健有限公司,批号BJ00666,规格30 mg。自研制剂:硝苯地平缓释片(Ⅲ),国药集团广东环球制药有限公司,批号100501、100601、100602,规格30 mg,批量为20万片。
盐酸、氯化钠、冰醋酸、醋酸钠、磷酸二氢钾、无水磷酸氢二钠均为分析纯,十二烷基硫酸钠为化学纯,甲醇、乙腈为色谱纯,水为纯化水。
2 释放度测定方法 2.1 色谱条件[6]色谱柱:安捷伦Zorbax SB-C18(150 mm×4.6 mm,5 μm);流动相:甲醇-乙腈-水(25:25:50);流速:1.0 mL·min-1;检测波长:235 nm;进样量:20 μL。
2.2 释放度测定法避光操作。取样品6片,照释放度测定法(中国药典2010年版二部附录Ⅹ D)第一法,采用溶出度测定法(中国药典2010年版二部附录Ⅹ C)第二法(桨法)的装置,将片剂放入沉降篮内,以“3.2.1”项下的0.5%十二烷基硫酸钠水溶液900 mL为释放介质,转速为100 r·min-1,依法操作,分别在2、4、6、8、10、12、16、20、24 h取溶液10 mL,滤过,弃去初滤液5 mL,并即时补充相同温度、相同体积的释放介质,取续滤液作为供试品溶液;另取硝苯地平对照品约15 mg,精密称定,置10 mL量瓶中,加甲醇适量超声使溶解,放冷,用甲醇稀释至刻度,摇匀,精密量取适量,用释放介质定量稀释制成每1 mL中约含硝苯地平15 μg的溶液,作为对照品溶液。精密量取供试品溶液及对照品溶液各20 μL,注入液相色谱仪,记录色谱图,按外标法以峰面积分别计算每片在不同时间的累计释放量。
3 方法与结果 3.1 释放度测定验证[7] 3.1.1 专属性考察取空白辅料、自研制剂及硝苯地平对照品适量(约相当于硝苯地平30 mg),分别置200 mL量瓶中,加甲醇溶解并定容,滤过,精密量取续滤液10 mL至200 mL量瓶中,分别加释放介质稀释并定容。精密量取上述溶液各20μL,注入液相色谱仪,记录色谱图。结果见图 1,空白辅料对硝苯地平缓释片释放度测定无干扰,表明本方法专属性良好。
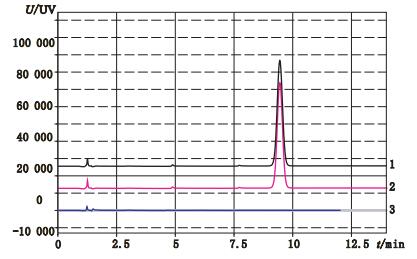
|
1.对照品(reference substance)2.自研制剂(self-prepared preparation)3.空白辅料(blank excipient) 图 1 专属性考察结果 Figure 1 Results of specialization test |
避光操作。精密称取硝苯地平对照品30 mg,加甲醇溶解并用释放介质稀释得质量浓度为1.627、3.254、8.135、16.270、32.540、48.810μg·mL-1的系列对照品溶液,精密量取上述对照品溶液各20 μL,注入液相色谱仪,记录色谱图。以硝苯地平浓度为横坐标,峰面积为纵坐标,进行线性回归,得线性方程:
Y=6.609 7×104X-9.89×102 r=0.999 9
表明硝苯地平质量浓度在1.627~48.810μg·mL-1的范围内线性关系良好。
3.1.3 重复性试验取自研制剂(批号:100501)6片,按“2.2”项下释放度测定法操作,在24 h时取样,滤过,弃去初滤液5 mL,精密量取各续滤液20 μL,注入液相色谱仪,记录色谱图,计算释放度的RSD为2.25%,表明本方法重复性良好。
3.1.4 中间精密度试验取自研制剂(批号:100501)6片,改变分析日期、人员和设备,按“2.2”项下释放度测定法操作,在24 h时取样,滤过,弃去初滤液5 mL,精密量取各续滤液20 μL,注入液相色谱仪,记录色谱图,计算释放度的RSD为1.73%,表明本方法中间精密度良好。
3.1.5 准确度试验精密称取硝苯地平对照品85 mg,置250 mL量瓶中,加甲醇溶解并定容,作为对照品储备液,精密量取对照品储备液1、8、14、20、24 mL(约相当于释放量达到5%、40%、70%、100%、120%),并加入等量的空白辅料,分别置200 mL量瓶中,加释放介质定容,滤过,弃去初滤液5 mL,精密量取各续滤液20 μL,注入液相色谱仪,记录色谱图,每个浓度平行操作3份,计算回收率。结果见表 1,回收率平均值为99.8%,表明本方法准确度良好。
|
|
表 1 回收率试验结果 Table 1 Results of recovery test |
取“3.1.2”项下质量浓度为1.627、16.270、32.540 μg·mL-1的对照品溶液(约相当于释放量达到5%、50%、100%的浓度),滤过,分别精密量取弃去初滤液5 mL后的续滤液各20 μL,注入液相色谱仪,记录色谱图,比较过滤前后的溶液浓度。另取自研制剂释放度试验24 h的供试品溶液同法处理。结果见表 2,滤膜对硝苯地平的吸附率在2%以下,表明滤膜对硝苯地平缓释片释放度测定无吸附干扰。
|
|
表 2 滤膜干扰试验结果 Table 2 Results of filter membrane interference test |
取自研制剂(批号:100501),按“2.2”项下释放度测定法操作,以0.5%十二烷基硫酸钠水溶液900 mL为释放介质,在2、6、10、24 h时取样,置室温条件下避光放置,分别在0、4、8、12、24、48、72 h精密量取各20 μL,注入液相色谱仪,记录色谱图,计算释放度RSD。结果见表 3,表明供试品溶液在室温条件下避光放置72 h稳定。
|
|
表 3 溶液稳定性试验结果 Table 3 Results of stability test for release solution |
取10 h释放度溶液,在确定的色谱条件基础上,分别改变流速、柱温、色谱柱及流动相比例进行测定,计算释放度溶液浓度及RSD。结果见表 4,在色谱条件有微小变化时,测定不受影响,表明此方法耐用性良好。
|
|
表 4 耐用性试验结果 Table 4 Results of robustness |
0.5%十二烷基硫酸钠水溶液:取十二烷基硫酸钠5.0 g,加水溶解并定容至1 000 mL,即得。
0.5%十二烷基硫酸钠的pH 1.2溶液:取氯化钠2.0 g和十二烷基硫酸钠5.0 g,加水适量溶解后,加盐酸7 mL,再加水稀释至1 000 mL,混匀,即得。
0.5%十二烷基硫酸钠的pH 4.0溶液:取十二烷基硫酸钠5.0 g,加0.05 mol·L-1醋酸溶液与0.05 mol·L-1醋酸钠溶液(16.4:3.6)的混合溶液溶解并定容至1 000 mL,即得。
0.5%十二烷基硫酸钠的pH 6.8溶液:取磷酸二氢钾1.7 g、无水磷酸氢二钠1.775 g和十二烷基硫酸钠5.0 g,加水溶解并定容至1 000 mL,即得。
3.2.2 释放曲线的测定取自研制剂(批号:100501)进行加速稳定性试验,在温度40 ℃±2 ℃、相对湿度75%±5%条件下放置6个月,得加速6个月自研制剂。按“2.2”项下释放度测定法操作,分别测定0 d自研制剂(批号:100501)、0 d对照制剂、加速6个月自研制剂样品在上述4种释放介质中的释放曲线,并采用相似性f2因子法评价不同pH介质条件下自研制剂与对照制剂释放曲线的相似性。结果见图 2,f2因子汇总见表 5。结果表明自研制剂与对照制剂在4种不同释放介质中释放曲线f2因子均大于50;0 d自研制剂与加速6个月样品在4种不同释放介质中释放曲线f2因子均大于80,基本重叠。
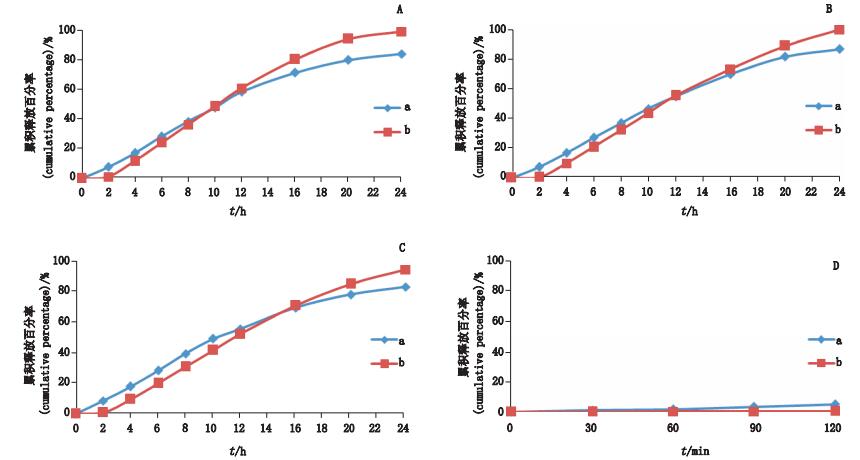
|
A.水(water)B.pH 6.8 C.pH 4.0 D.pH 1.2 图 2 自研制剂(a)与对照制剂(b)四曲线对比 Figure 2 Comparison on release curve of self-prepared preparation(a) and contrast preparation(b) in four different mediums |
|
|
表 5 f2因子结果 Table 5 Results of f2 factors analysis |
分别取3批自研制剂(批号:100501、100601、100602)0 d及加速6个月样品,按“2.2”项下释放度测定法操作测定,计算各时间点批内及批间RSD。结果见表 6,3批自研制剂0 d及加速6个月样品批内差异均符合前期RSD<20%,后期RSD<10%的要求[8],批间差异符合RSD<10%的要求,表明样品均一性及工艺重现性良好,且样品在加速试验条件下仍能保持稳定释放。
|
|
表 6 释放度均一性、重现性结果 Table 6 Homogeneity and reproducibility results of release rate |
由于硝苯地平在4种介质中的溶解度相近(pH 1.2:11 μg·mL-1;pH 4.0:14 μg·mL-1;pH 6.8:10 μg·mL-1;水:11 μg·mL-1)[9]且溶液稳定性良好,故本实验仅验证标准草案中释放度项下的介质(0.5%十二烷基硫酸钠水溶液)的测定方法。
自研制剂与对照制剂的释放曲线对比试验研究可知:① 自研制剂与对照制剂在4种不同释放介质中的释放曲线相似,可以判定自研制剂与对照制剂体外释放行为一致[10];② 自研制剂0 d样品与加速6个月样品在4种不同释放介质中的释放曲线基本重叠,表明自研制剂样品在加速试验条件下仍能保持稳定释放;③ 3批自研制剂均一性和重现性均符合《化学药物口服缓释制剂药学研究技术指导原则》要求[11],表明自研制剂工艺稳定,样品质量可控。
根据国办发[2016]8号文《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》[12],要求国内已批准上市的化学仿制药必须按照与原研药品质量和疗效一致的原则开展一致性评价工作,敦促药品企业通过“在严格的溶出度试验条件下,在各种介质中均具有较高的、一定的溶出曲线”这一要求,大力推动制剂工艺的充分、详尽研究来提高体内外相关性,从而增加生物等效性试验的成功率,杜绝生物等效性试验的造假行为[13]。
上述研究结果表明自研硝苯地平缓释片(Ⅲ)与对照制剂“拜新同”体外药学一致[14]。
| [1] |
FOSTER TS, HAMANN SR, RICHARDS VR, et al. Nifedipine kinetics and bioavailability after single intravenous and oral doses in normal subjects[J]. J Clin Pharmacol, 1983, 23(4): 161. DOI:10.1002/jcph.1983.23.issue-4 |
| [2] |
KONDO S, KUCHIKI A, YAMAMOTO K, et al. Identification of nifedipine metabolites and their determination by gas chromatography[J]. Chem Pham Bull(Tokyo), 1980, 28(1): 1. DOI:10.1248/cpb.28.1 |
| [3] |
RAMSCH KD, GRAEFE KH, SCHERLIN GD, et al. Pharmacokinetics and metabolism of calcium-blocking agents nifedipine, nitrendipine, and nimodipine[J]. Am J Nephrol, 1986, 6(Suppl 1): 73. |
| [4] |
徐冬地, 谭丰苹, 林莹. 硝苯地平骨架控释片的制备及其体外释放性能[J]. 精细化工, 2007, 24(12): 1149. XU DD, TAN FP, LIN Y. Perparation and in vitro release property of nifedipine matrix tablet[J]. Fine Chem, 2007, 24(12): 1149. DOI:10.3321/j.issn:1003-5214.2007.12.002 |
| [5] |
张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946. ZHANG QM, XIE MF, NING BM, et al. Evaluation of solidoral products by dissolution profiles in different mediums[J]. Chin J Pharm, 2009, 40(12): 946. DOI:10.3969/j.issn.1001-8255.2009.12.019 |
| [6] |
WS-395(X-343)-99硝苯地平控释片[S]. 2000 WS-395(X-343)-99 Nifedipine Controlled Release Tablets[S]. 2000 |
| [7] |
国家食品药品监督管理总局. 化学药物质量控制分析方法验证技术指导原则[EB/OL]. [2016-03-15]. http://www.sda.gov.cn/WS01/CL1616/83418.html State Food and Drug Administration. Guidance for Verification Technique of the Quality Analysis Method of Chemical Drugs[EB/OL]. [2016-03-15]. http://www.sda.gov.cn/WS01/CL1616/83418.html http://www.doc88.com/p-7824559947119.html |
| [8] |
谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308. XIE MF. Evaluation methods of comparability of dissolution curve[J]. Chin J Pharm, 2009, 40(4): 308. |
| [9] |
国家食品药品监督管理总局药品审评中心. 药品体外溶出试验信息库: 硝苯地平[DB/OL]. [2016-03-15]. http://www.cde.org.cn/drugInfo.do?method=init&frameStr=3 Center for Drug Evaluation, State Food and Drug Administration. Drug Dissolution Test Information Base:Nifedipine[DB/OL].[2016-03-15]. http://www.cde.org.cn/drugInfo.do?method=init&frameStr=3 |
| [10] |
谢沐风. 简介日本药品品质再评价工程(溶出度研究系列一)[J]. 中国药品标准, 2005, 6(6): 42. XIE MF. The introduce about the project of drug quality's reevaluation in Japan(Series one of the dissolution study)[J]. Drug Stand China, 2005, 6(6): 42. |
| [11] |
国家食品药品监督管理总局. 化学药物口服缓释制剂药学研究技术指导原则[EB/OL]. 2007[2016-03-15]. http://www.sda.gov.cn/WS01/CL1036/27060.html State Food and Drug Administration. Guidance for Design and Evaluation of the Extended Release Oral Dosage Forms of Chemical Drugs[EB/OL]. [2016-03-15]. http://www.sda.gov.cn/WS01/CL1036/27060.html |
| [12] |
国家食品药品监督管理总局. 国务院办公厅关于开展仿制药质量和疗效一致性评价的意见[EB/OL]. [2016-03-15]. http://www.sda.gov.cn/WS01/CL1035/146200.html State Food and Drug Administration. Opinions of the general office of the State Council on the Consistency Evaluation of the Quality and Efficacy of ANDA[EB/OL]. [2016-03-15]. http://www.sda.gov.cn/WS01/CL1035/146200.html |
| [13] |
谢沐风, 张启明, 陈洁, 等. 国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J]. 中国药事, 2008, 22(3): 257. XIE MF, ZHANG QM, CHEN J, et al. Introduction of foreign drug administration evaluating the internal quality of oral solid formulations by drug dissolution curve[J]. Chin Pharm Aff, 2008, 22(3): 257. |
| [14] |
郁庆华, 谢冉行. 开展仿制药质量一致性评价的探讨[J]. 上海医药, 2014, 35(7): 49. YU QH, XIE RX. Discussion on developing generics quality consistency evaluation[J]. Shanghai Med Pharm J, 2014, 35(7): 49. |
 2017, Vol. 37
2017, Vol. 37 