2. 中国药科大学药学院, 南京 210009
2. College of Pharmacy, China Pharmaceutical University Nanjing 210009, China
聚山梨酯80(polysorbate 80),又叫吐温80(Tween 80),其化学名称为聚氧乙烯20山梨醇酐单油酸酯,为淡黄色的粘稠液体。易溶于水、甲醇、乙醇等,属于亲水型非离子表面活性剂。由于其具有较好的助溶作用,在制备难溶性药物的注射剂时,常用作助溶剂、乳化剂和稳定剂,为药物制剂中常见的辅料之一[1-2]。该辅料已收入多国药典,包括中国药典(Chinese Pharmacopoeia,ChP)、欧洲药典(European Pharmacopoeia,EP)、英国药典(British Pharmacopoeia,BP)、美国药典(United States Pharmacopoeia,USP)、日本药局方(The Japanese Pharmacopoeia,JP)。聚山梨酯80应用很广泛,但是在一些应用中譬如注射剂中可能出现溶血、过敏等副作用[3-8],这些副作用的出现让人们警惕吐温的使用,并研究其出现原因。聚山梨酯80不是简单的化合物,它是很多组分的混合物,组分可能含有聚氧乙烯山梨醇酐、聚氧乙烯山梨醇酐一油酸脂、聚氧乙烯山梨醇酐二油酸脂、聚氧乙烯山梨醇酐三油酸脂、聚氧乙烯山梨醇酐四油酸脂、聚氧乙烯异山梨醇酐、聚氧乙烯异山梨醇酐一油酸脂、聚氧乙烯异山梨醇酐二油酸脂、聚氧乙烯异山梨醇酐三油酸脂、聚氧乙烯异山梨醇酐四油酸脂、聚乙二醇、聚乙二醇一油酸酯和聚乙二醇二油酸酯等[9]。聚山梨酯80现有分析方法有中国药典理化鉴别法、紫外分析法[10]、液相分析法[11-13]、液质联用分析法[14]、基质辅助激光解吸电离飞行时间质谱(MALDI-TOF/MS)分析法[15-16]等。由于各组分之间理化性质相差不大,利用常规液相色谱法、紫外分光光度法、理化方法不能有效分离其中各组分,也就不能有效鉴别聚山梨酯80。
核磁共振(Nuclear magnetic resonance,NMR)是20世纪40年代发展起来的一项新的分析技术。利用磁共振技术可以在不破坏样品的情况下确定物质的化学结构及某种成分的含量分布,其应用已迅速扩展到物理、化学领域之外的医疗、生物工程等方面,成为分析生物大分子复杂结构和诊断病情最强有力的方法之一。目前USP和EP都已收载了核磁共振分析方法用于药物的检查,例如USP用1H-NMR定性鉴别β-葡聚糖,EP用13C-NMR定性鉴别低分子量肝素钠等。
聚山梨酯80结构组成复杂,很多分析方法得不出其组分。由于核磁共振技术在定性和定量方面的独特优势,本课题组对聚山梨酯80的组分以及结构式进行详细研究。在核磁共振方法的研究中,核磁共振信号峰的归属是展开研究的基础。本文利用核磁共振技术1H谱、13C谱和相关2D谱图对聚山梨酯80结构式进行详细的解析。得到聚山梨酯80核磁共振图谱归属,为进一步研究聚山梨酯80奠定了很好的基础。
1 仪器及试药Bruker公司Ascend-500核磁共振仪,默克公司Milli-Q的纯水仪。
试剂氘代甲醇、重水购自SIGMA-Aldrich;聚山梨酯80样品购自SIGMA-Aldrich公司。
2 供试品溶液配制称取聚山梨酯80样品约60 mg,加入氘代甲醇0.6 mL,使其完成溶解,转移到5 mm核磁管中待测。
3 仪器参数设置一维13C-NMR波谱是在装配5 mm BBO探头的Bruker Ascend-500核磁共振谱仪上采集。采样时间(AQ)1.1 s,弛豫时间(D1)1 s,测量温度(T)25 ℃,谱宽(SW)δC 236.6,采样点数(data point)64 k,扫描次数(NS)32 768次,线展宽因子0.3 Hz。
一维1H-NMR波谱是在装配5 mm BBO探头的Bruker Ascend-500核磁共振谱仪上采集。采样时间(AQ)4.38 s,弛豫时间(D1)2 s,测量温度(T)25 ℃,谱宽(SW)δH 15,采样点数(data point)64 k,扫描次数(NS)128次,线展宽因子0.3 Hz。
二维HSQC-NMR波谱是在装配5 mm BBO探头的Bruker Ascend-500核磁共振谱仪上采集。采样时间(AQ)0.19 s,弛豫时间(D1)1.38 s,测量温度(T)25 ℃,谱宽(SW)δH 15,δC 200,采样点数64 k,二维实验扫描次数(NS)为16次。
二维HMBC-NMR波谱是在装配5 mm BBO探头的Bruker Ascend-500核磁共振谱仪上采集。采样时间(AQ)0.19 s,弛豫时间(D1)1.38 s,测量温度(T)25 ℃,谱宽(SW)δH 15,δC 200,采样点数64 k,二维实验扫描次数(NS)为16次。
二维COSY-NMR波谱是在装配5 mm BBO探头的Bruker Ascend-500核磁共振谱仪上采集。采样时间(AQ)0.20 s,弛豫时间(D1)1.45 s,测量温度(T)25 ℃,谱宽(SW)δH 15,采样点数64 k,扫描次数(NS)16次。
4 结果与讨论 4.1 聚山梨酯80结构分析聚山梨酯80是以失水山梨醇为母核,4个羟基端聚合一定数目的环氧乙烷单体,形成4个聚氧乙烯侧链,4个羟基端中的1个连接一分子的油酸(见图 1)。其中,油酸为含有1个不饱和双键的十八碳脂肪酸。在聚山梨酯80的分子结构式中,结合油酸酯的聚氧乙烯侧链为疏水基团,未结合油酸酯的聚氧乙烯侧链为亲水基团。聚山梨酯80的亲疏水相互作用是由聚氧乙烯侧链的状态决定的,因此,聚山梨酯80聚氧乙烯侧链核磁共振信号的归属对研究亲疏水相互作用有重要意义。本文采集了聚山梨酯80的一维氢谱(1H谱)、碳谱(13C谱)、二维异核单量子相关谱(二维HSQC谱)、异核多量子相关谱(HMBC谱)、同核位移相关谱(COSY谱),并对谱图进行了详细解析。
|
图 1 聚山梨酯80结构式 Figure 1 The structure of polysorbate 80 |
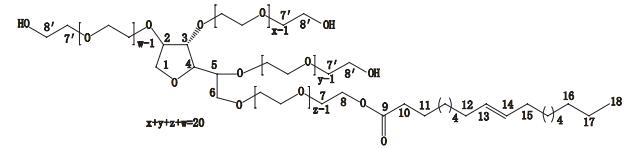
HSQC谱的信息是直接相连的碳氢关系,得到一键CH连接。在聚山梨酯80核磁共振HSQC谱(图 2)中,F2维化学位移δH 5.37处是双键氢,它对应的F1维化学位移δC 130碳就是双键碳;F2维化学位移δH 4.23处是基团-CH2OCO-的氢信号峰,它对应的F1维化学位移δC 63.2的碳是基团-CH2OCO-的连接氢的碳信号峰;F2维化学位移δH 3.66处是基团-OCH2CH2-的氢信号峰,它对应的F1维化学位移δC 70.2的碳是基团-OCH2CH2-的连接氢的碳信号峰;F2维化学位移δH 2.36处是基团-OCOCH2-的氢信号峰,它对应的F1维化学位移δC 33.6的碳是基团-OCOCH2-的连接氢的碳信号峰;F2维化学位移δH 2.06处是基团-CH2CH=CHCH2-连接双键的氢信号峰,它对应的F1维化学位移δC 26.8的碳是基团-CH2CH=CHCH2-的连接双键碳信号峰;F2维化学位移δH 1.64处是基团-OCOCH2CH2-的末端氢信号峰,它对应的F1维化学位移δC 24.7的碳是基团-OCOCH2CH2-的末端碳信号峰;F2维化学位移δH 1.50处是基团-CH2CH2-的氢信号峰,它对应的F1维化学位移δC 28.7-29.5的碳是基团-CH2CH2-的碳信号峰;F2维化学位移δH 0.93处是基团-CH3的氢信号峰,它对应的F1维化学位移δC 13.1的碳是基团-CH3的碳信号峰。
|
图 2 聚山梨酯80核磁共振HSQC谱 Figure 2 HSQC-NMR spectra of polysorbate 80 |
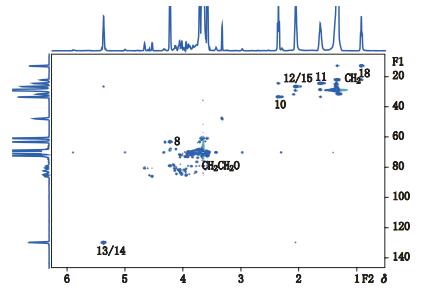
HMBC谱的将1H核和远程耦合的13C核关联起来,通常为2~3个键的质子与碳的耦合信息,给出的是远程偶合的碳氢关系。在聚山梨酯80的HMBC谱(图 3)中,F2维化学位移δH 5.37对应的F1维化学位移δC 26.8是C-12与H-13相关以及C-15与H-14相关;F2维化学位移δH 4.23对应的F1维化学位移δC 68.8是C-7与H-8相关;F2维化学位移δH 4.23对应的F1维化学位移δC 173.9是C-9与H-8相关;F2维化学位移δH 3.66对应的F1维化学位移δC 70.2是基团-OCH2CH2-中碳氢相关;F2维化学位移δH 2.36对应的F1维化学位移δC 173.9是C-9与H-10相关;F2维化学位移δH 2.36对应的F1维化学位移δC 26.8是C-12与H-10相关;F2维化学位移δH 2.36对应的F1维化学位移δC 24.7是C-11与H-10相关;F2维化学位移δH 2.36对应的F1维化学位移δC 173.9是C-9与H-10相关;F2维化学位移δH 2.06对应的F1维化学位移δC 129.5是C-13与H-12相关以及C-14与H-15相关;F2维化学位移δH 1.64对应的F1维化学位移δC 173.9是C-9与H-11相关;F2维化学位移δH 1.64对应的F1维化学位移δC 26.8是C-12与H-11相关;F2维化学位移δH 1.34对应的F1维化学位移δC 13.1是C-18与H-17相关;F2维化学位移δH 2.36对应的F1维化学位移δC 173.9是C-9与H-10相关;F2维化学位移δH 0.93对应的F1维化学位移δC 31.7是C-16与H-18相关;F2维化学位移δH 0.93对应的F1维化学位移δC 22.4是C-17与H-18相关。
|
图 3 聚山梨酯80核磁共振HMBC谱 Figure 3 HMBC-NMR spectra of polysorbate 80 |
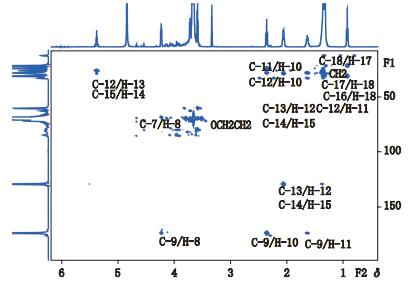
COSY谱的信息是相连2~3个化学键氢的关系。在聚山梨酯80的COSY谱(图 4)中,F2维化学位移δH 0.93对应的F1维化学位移δH 1.34是H-17与H-18相关;F2维化学位移δH 1.36对应的F1维化学位移δH 1.64是H-11与-CH2相关;F2维化学位移δH 1.36对应的F1维化学位移δH 2.06是H-15与-CH2相关;F2维化学位移δH 1.64对应的F1维化学位移δH 2.36是H-10与H-11相关;F2维化学位移δH 2.06对应的F1维化学位移δH 5.37是H-12与H-13以及H-14与H-15相关;F2维化学位移δH 3.66对应的F1维化学位移δH 3.66是-CH2CH2O基团相连氢相关。由于δH 3.66处的-CH2CH2O基团所含质子数较多,故在δH 3.66处附件信号重合严重。
|
图 4 聚山梨酯80核磁共振COSY谱 Figure 4 COSY-NMR spectra of polysorbate 80 |
根据上文聚山梨酯80核磁共振HSQC、HMBC、COSY谱解析得出其1H、13C谱归属,结果总结如表 1、表 2;图 5归属总结见表 1;图 6的归属总结见表 2。
|
|
表 1 氢谱归属 Table 1 The assignment of 1H-NMR spectrum |
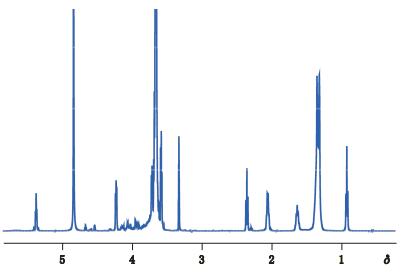
|
图 5 聚山梨酯80核磁共振1H谱 Figure 5 1H-NMR spectrum of polysorbate 80 |
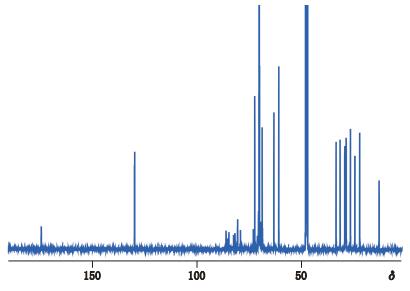
|
图 6 聚山梨酯80核磁共振13C谱 Figure 6 13C-NMR spectrum of polysorbate 80 |
|
|
表 2 碳谱归属 Table 2 the assignment of 13C-NMR spectrum |
聚山梨酯80应用非常广泛,但是应用在注射剂中时出现溶血等副作用,这些副作用的出现引起人们关注,随后出现了很多研究聚山梨酯80组成的方法,例如高效液相色谱法、高效液相色谱与质谱联用法等。但是这些方法不能有效分离聚山梨酯80各组分,也没有研究出聚山梨酯80的结构。得到聚山梨酯80的结构是研究聚山梨酯80副作用的先决条件,是研究聚山梨酯80副作用的首要基础。本文利用核磁共振技术1H谱、13C谱、HSQC谱、HMBC谱、COSY谱研究聚山梨酯80,通过这些图谱解析得到聚山梨酯80核磁共振图谱归属,并得到聚山梨酯80的结构式,这为进一步研究聚山梨酯80奠定了坚实的基础。
| [1] |
HUOT E, BARRENA-GONZALEZ C, PETITDEMANGE H. Tween 80 effect on bacteriocin synthesis by Lactococcus lactis subsp. cremoris J46[J]. Lett Appl Microbiol, 1996, 22(4): 307. DOI:10.1111/j.1472-765X.1996.tb01167.x |
| [2] |
SILVESTRE MP, CHAIYASIT W, BRANNAN RG, et al. Ability of surfactant headgroup size to alter lipid and antioxidant oxidation in oil-in-water emulsions[J]. J Agric Food Chem, 2000, 48(6): 2057. DOI:10.1021/jf991162l |
| [3] |
SHELLEY WB, TALANIN N, SHELLEY ED. Polysorbate 80 hypersensitivity[J]. Lancet, 1995, 345(8960): 1312. DOI:10.1016/S0140-6736(95)90963-X |
| [4] |
BADIU I, GEUNA M, HEFFLER E, et al. Hypersensitivity reaction to human papillomavirus vaccine due to polysorbate 80[J]. BMJ Case Rep, 2012. DOI:10.1136/bcr.02.2012.5797 |
| [5] |
GOUGH WB, ZEILER RH, BARRECA P, et al. Hypotensive action of commercial intravenous amiodarone and polysorbate 80 in dogs[J]. J Cardiovasc Pharmacol, 1982, 4(3): 375. DOI:10.1097/00005344-198205000-00006 |
| [6] |
MASINI E, PLANCHENAULT J, PEZZIARDI F, et al. Histaminereleasing properties of Polysorbate 80 in vitro and in vivo:correlation with its hypotensive action in the dog[J]. Agents Actions, 1985, 16(6): 470. DOI:10.1007/BF01983649 |
| [7] |
STEELE RH, LIMAYE S, CLELAND B, et al. Hypersensitivity reactions to the polysorbate contained in recombinant erythropoietin and darbepoietin[J]. Nephrology(Carlton), 2005, 10(3): 317. |
| [8] |
CHEUNG WK, NATARAJAN J, SANDERS M, et al. Comparative pharmacokinetics, safety, and tolerability after subcutaneous administration of recombinant human erythropoietin formulated wit different stabilizers[J]. Biopharm Drug Dispos, 2000, 21(6): 211. DOI:10.1002/(ISSN)1099-081X |
| [9] |
AYORINDE FO, GELAIN SV, JOHNSON JH, et al. Analysis of some commercial polysorbate formulations using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2000, 14(22): 2116. DOI:10.1002/(ISSN)1097-0231 |
| [10] |
WUELFING WP, KOSUDA K, TEMPLETON AC, et al. Polysorbate 80 UV/vis spectral and chromatographic characteristics-defining boundary conditions for use of the surfactant in dissolution analysis[J]. J Pharm Biomed Anal, 2006, 41(3): 774. DOI:10.1016/j.jpba.2006.01.020 |
| [11] |
ABRAR S, TRATHNIGG B. Analysis of polyethyleneoxide macromonomers by liquid chromatography along the critical adsorption line[J]. Anal Bioanal Chem, 2011, 400(8): 2577. DOI:10.1007/s00216-010-4554-2 |
| [12] |
ABRAR S, TRATHNIGG B. Separation of polysorbates by liquid chromatography on a HILIC column and identification of peaks by MALDI-TOF MS[J]. Anal Bioanal Chem, 2011, 400(7): 2119. DOI:10.1007/s00216-011-4933-3 |
| [13] |
ABRAR S, TRATHNIGG B. Characterization of polyoxyethylenes according to the number of hydroxy end groups by hydrophilic interaction chromatography at critical conditions for polyethylene glycol[J]. Anal Bioanal Chem, 2011, 400(8): 2531. DOI:10.1007/s00216-010-4448-3 |
| [14] |
VU DANG H, GRAY AI, WATSON D, et al. Composition analysis of two batches of polysorbate 60 using MS and NMR techniques[J]. J Pharm Biomed Anal, 2006, 40(5): 1155. DOI:10.1016/j.jpba.2005.10.007 |
| [15] |
FRISON-NORRIE S, SPORNS P. Investigating the molecular heterogeneity of polysorbate emulsifiers by MALDI-TOF MS[J]. J Agric Food Chem, 2001, 49(7): 3335. DOI:10.1021/jf010096w |
| [16] |
ZHANG Q, MENG Y, YANG H, et al. Quantitative analysis of polysorbates 20 and 40 by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2013, 27(24): 2777. DOI:10.1002/rcm.6743 |
 2017, Vol. 37
2017, Vol. 37 
