吡罗昔康是昔康类非甾体消炎镇痛药,主要应用于骨关节炎、类风湿关节炎和强直性脊柱炎的症状缓解。中国药典2015年版、欧洲药典(EP 8.0)、英国药典(BP 2015)、美国药典(USP 38)和日本药局方(JP 16)均收载吡罗昔康及制剂。查阅文献[1-2],吡罗昔康存在多种晶型,在不同溶剂中结晶能得到3种相互转化的晶型,最新报道通过电喷雾技术亦能获得新的晶型[3]。有文献报道[4]采用二氯乙烷作为结晶溶剂能得到PⅡ晶型,1,2-二氯乙烷为一类溶剂,结晶后溶剂的残留问题不容忽视,吡罗昔康现行检验标准中对制剂及原料中残留溶剂未作规定,而中国药典对一类溶剂的残留量有严格限定,应控制其残留量。
近红外漫反射光谱(near infrared diffuse reflection spectrum,NIDRS)法是近年来迅速发展的一种绿色分析技术,不需对样品进行预处理,简便且无污染。NIRDS不仅反映活性成分的化学结构信息,还反映活性成分的晶型工艺信息以及工艺特征,这些丰富的信息决定了近红外技术既可测定化学成分, 也能分析物理性质,现已应用于多个行业的品质分析和在线控制[5-9]。本文基于PⅡ晶型吡罗昔康中溶剂残留超标情况,通过NIR模型快速区分吡罗昔康片中原料药的晶型,建立GC-MS法分析PⅡ晶型原料药生产的吡罗昔康片中1,2-二氯乙烷残留,方法快速简便,结果互相印证,准确可靠。
1 仪器及试剂Matrix-F型傅里叶变换红外光谱仪(Bruker公司),内置半导体冷却的铟镓砷(InGaAs)检测器,配备1.5 m漫反射固体光纤探头,分析软件为OPUS 7.2;粉末X射线衍射仪(Bruker公司);6890-5975C气相色谱质谱联用仪(Agilent公司)。
1,2-二氯乙烷为色谱纯,含量≥99.0%;二甲基亚砜为色谱纯,含量≥99.8%。吡罗昔康对照品(批号100177-200603)购自中国食品药品检定研究院。
吡罗昔康片为国家评价性抽验品种,共138批,分别来自14个生产企业;吡罗昔康原料F1、F2、F3、F4、F5、F6、F7共7批,来自国内4个生产企业。
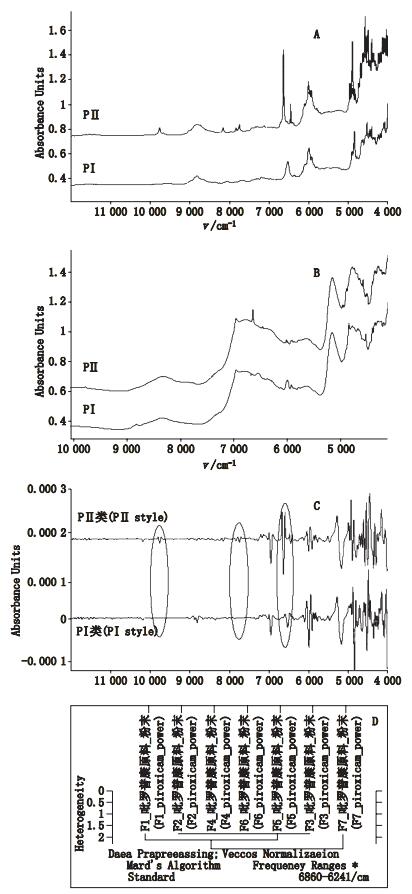
2 方法与结果 2.1 NIR分析 2.1.1 NIR光谱的采集采用直接接触采样,糖衣片磨去糖衣。采用固体光纤探头测样,分辨率为8 cm-1,扫描32次,扫描范围为12 000~4 000 cm-1,温度为(25±2)℃,相对湿度为45%~58%。每批样品扫6片,每片扫描1次,得到6张原始光谱,用原始光谱建模。吡罗昔康原料及制剂的典型NIR图见图 1。
|
A.吡罗昔康原料药(NIR spectra of pirocicam raw materials)B.吡罗昔康片(NIR spectra of pirocicam tablets)C.吡罗昔康片(二阶导数处理)[NIR spectra of pirocicam tablets(manipulated by secondderivative)]D.吡罗昔康原料药聚类分析图(cluster analysis spectrum of pirocicam raw materials) 图 1 吡罗昔康原料及制剂NIR及聚类分析图 Figure 1 NIR spectra of pirocicam raw materials and tablets and cluster analysis spectrum of pirocicam raw materials |
相关系数法是将待测光谱与参考光谱进行比较,得到相关系数r,以此来比较指定光谱与参考光谱相似程度。
对吡罗昔康原料图谱进行聚类分析后得到,吡罗昔康原料药可以分为2类,分别代表 2种晶型,且原料与制剂的晶型一一对应,将对应的制剂分为PⅠ、PⅡ 2类。由图 1可以看出,PⅡ型样品的特征峰位经二阶导数处理后更加明显,建立特征谱段相关系数模型以区分2种类型的制剂。运用OPUS软件的Quick Compare(相关系数法)方法建立模型,使用PⅡ型样品中任意1批的1张原始光谱,采用二阶导数法进行预处理,建模谱段为9 800~9 720、8 180~8 140、7 860~7 720、6 700~6 600、6 480~6 440、6 100~5 980、4 995~4 960、4 850~4 800和4 620~4 450 cm-1,平滑点数为21,相关系数r阈值为97%。
2.1.3 模型对于样品的识别用相关系数模型分析138批制剂样品,阈值在97%以上的属于PⅡ类样品,低于97%的则属于PⅠ类样品。结果显示,有3个企业14批样品属于PⅡ类制剂,阈值在97%以上;有5个企业共12批样品验证的阈值在85%~97%之间,剩余112样品验证阈值在85%以下。
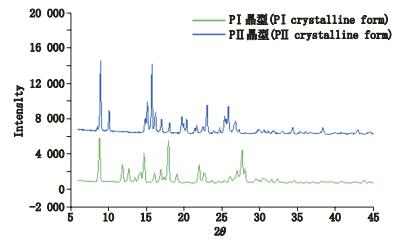
2.2 PXRD判断晶型结果扫描时间:0.2 s;步长:0.05 s;2θ:6°~45°。分别测定7批原料及对照品,并将结果与晶体药物粉末衍射标准品联合委员会(JCPDS)的图谱比较,结果如图 2所示,F1~F6这6批原料药及对照品的图谱一致,属于PⅠ晶型,原料药F7属于PⅡ晶型,结果与NIR聚类分析结果一致,说明NIR模型分析结果准确。
|
图 2 吡罗昔康原料PXRD图 Figure 2 PXRD spectra of pirocicam raw materials |
对照溶液:取1,2-二氯乙烷适量,精密称定,加入二甲基亚砜制成质量浓度为2.5 mg·L-1的溶液,作为对照储备液;精密量取对照储备液2 mL,置10 mL量瓶中,加二甲基亚砜稀释至刻度,摇匀,即得对照溶液。
原料溶液:取吡罗昔康原料0.1 g,置于20 mL顶空瓶中,加入二甲基亚砜1.0 mL,加盖密封,摇匀。
吡罗昔康片溶液:取相当于吡罗昔康50 mg的药品粉末,置于20 mL顶空瓶中,加入二甲基亚砜1.0 mL,加盖密封,摇匀。
2.3.2 色谱条件色谱柱:Agilent DB-225毛细管柱(30 m×0.25 mm,0.25 μm);柱温:程序升温,40 ℃维持2 min,再以2 ℃·min-1的升温速率升至70 ℃,再以60 ℃·min-1升温速率升至200 ℃维持3 min;进样口温度:210 ℃;顶空瓶平衡温度:90 ℃;平衡时间:30 min;进样体积:1.0 mL。1,2-二氯乙烷特征离子:m/z 62、49、98、27,以m/z 62离子作为定量离子。
2.3.3 线性关系考察分别精密量取对照储备液0.2、0.5、1.0、1.5、2.0、2.5、3.0 mL,置10 mL量瓶中,加二甲基亚砜稀释至刻度,配成系列对照品溶液①~⑦,各取1.0 mL分别置20 mL顶空瓶中进行测定,得到线性方程:
Y=761.0X+163.6 r=0.999 7
质量浓度在0.36~3.90 mg·L-1范围内线性关系良好。
2.3.4 精密度考察精密量取对照储备液2 mL,置10 mL量瓶中,加二甲基亚砜稀释至刻度,摇匀,各取1.0 mL分别置20 mL顶空瓶中进行测定,平行测定6份,1,2-二氯乙烷对照溶液峰面积的RSD为1.0%,精密度良好。
2.3.5 重复性试验称取任1批片剂,按“2.3.1”项下方法平行制备6份溶液,进行测定,结果峰面积的RSD为0.9%,重复性良好。
2.3.6 检出限的测定将系列对照溶液① 作为母液逐步稀释,按“2.3.2”项色谱条件进行检测,将结果折算得到样品的检出限为0.000 088%。
2.3.7 回收率试验原料药:称取同一批原料药0.1 g置于20 mL顶空瓶中,加入系列对照溶液② 1.0 mL,平行制备6份溶液进行测定,得到平均回收率为91.5%,RSD为1.3%。片剂:称取同一批片剂粉末(相当于吡罗昔康50 mg)置于20 mL顶空瓶中,加入系列对照溶液② 1.0 mL,平行制备6份溶液,进样测定,得到平均回收率为90.9%,RSD为1.4%。
2.4 样品测定 2.4.1 原料药取各批次样品,按“2.3.1”项下方法制备溶液,按“2.3.2”项下实验条件测定;结果显示,6批PⅠ类原料中未发现1,2-二氯乙烷残留,PⅡ类原料中检出1,2-二氯乙烷残留量为0.036 6%,超出中国药典2015年版规定约70倍(规定限度为0.000 5%)。
2.4.2 吡罗昔康片由原料测定的结果推断,使用PⅡ类原料生产的制剂存在二氯乙烷残留的可能性极大。结合近红外相关系数模型分析的结果,对阈值在85%以上的片剂样品进行测定,GC-MS图见图 3,残留溶剂阳性的样品结果见表 1。如表 1所示,3个企业共14批阈值在97%以上的样品均检出较大量的1,2-二氯乙烷残留,而阈值在85%~97%之间的样品均未检出溶剂残留,这与近红外模型识别的结果一致。为进一步验证近红外模型的结果,对阈值在85%以下的样品进行测定,结果显示,均未存在溶剂残留。

|
1. 1,2-二氯乙烷(1,2-dichloride ethane) 图 3 吡罗昔康片中1,2-二氯乙烷GC-MS图 Figure 3 GC-MS spectrum of 1, 2-dichloride ethane for pirocicam tablets |
|
|
表 1 吡罗昔康片剂溶剂残留检测结果 Table 1 The determination results of solvent residue in piroxicam tablets |
NIR定性鉴别模型包括通用模型、一致性模型和相关系数模型,与中红外定性分析不同,NIR定性分析很少用于化合物的结构剖析,而主要用于物质的归类分析和判别分析。吡罗昔康PⅡ类原料药及使用PⅡ类原料药生产的制剂的近红外图谱的特征峰位较明显,并且相关系数法通过在特征谱段计算相关系数r,r能反映2张光谱的相似程度,能更快速进行区分;一致性模型适用于“一厂一品”建模,前期实验发现一致性模型对于样品的误判率较大;由于各企业使用原辅料及生产工艺不同,通用性模型不适用于大范围,厂家较多的样品的区分。
3.2 光谱的预处理方法相关系数方法中对于光谱的预处理方法仅有一阶和二阶导数处理,对光谱进行导数化处理会使峰位变陡,二阶导数比一阶导数会使特征谱段的差异更为突出。
3.3 平滑点数和阈值的设定分别比较平滑点数在9、13、17、21、25,阈值在99%、97%、95%的情况下,模型对于样品识别能力。平滑点数过大或过小,会改变峰位的尖锐程度;阈值设计不合理会导致模型对样品的误判。结合GC分析的结果和近红外图谱中峰位情况,选择平滑点数为21,阈值为97%最为合理。
3.4 晶型的识别判断药物晶型的常用方法有PXRD法、红外光谱法(IR法)等,这些方法能很好识别原料药,但是对于制剂,由于辅料的干扰未能有效识别。而NIDRS法能反映活性成分的工艺晶型信息,实验结果很好地应证了这一点。NIDRS法采用简单的聚类分析对原料药的进行分类识别,其结果与PXRD法分析晶型的结果是一致的;相关系数模型对制剂中原料药为PⅡ晶型的样品识别结果与GC-MS分析二氯乙烷残留阳性的PⅡ晶型样品一致,说明NIRDS法能很好地识别原料药及制剂的晶型。
3.5 NIDRS关于1,2-二氯乙烷的识别1,2-二氯乙烷由于C-H键的存在,在NIR谱图中存在吸收峰,其特征峰位集中在末端4 000-4 500 cm-1,制剂中大部分辅料的吸收峰处于末端。NIDRS方法物质的定量浓度为0.1%,因此1,2-二氯乙烷的峰位极容易因为微小的含量和被辅料峰所掩盖而难以识别。
3.6 片剂中二氯乙烷残留的分析实验表明,通过NIR模型快速识别吡罗昔康片的晶型进而判断溶剂的残留,方法快速,比常规的批批分析节省了大量时间,有利于企业在生产中的在线控制。
3.7 国内吡罗昔康原料工艺常用的合成工艺[10-11]均为在氢氧化钠乙醇溶液中溶解后用盐酸调至酸性析出吡罗昔康结晶,均没有提到使用1,2-二氯乙烷,作为一类溶剂,1,2-二氯乙烷是可以致癌并被强烈怀疑对人和环境有害的溶剂,对眼睛及呼吸道有刺激作用,不应在合成工艺中超量使用。
3.8 PⅡ晶型实验发现采用多种溶剂对吡罗昔康进行重结晶处理后均可得到PⅡ晶型,但使用二氯乙烷作为结晶溶剂,在室温条件下即可得到PⅡ晶型,结晶条件简单便捷;而使用乙醇等溶剂则需要进行冷冻重结晶等处理,工艺较烦琐,因此应注意控制PⅡ晶型合成工艺及严格把控PⅡ晶型中的溶剂残留。
4 结论已有文献报道[12-13]利用顶空气相色谱法测定吡罗昔康中的甲醇、乙醇、甲苯、二甲苯、丙酮等有机溶剂的残留量,未见有关于1,2-二氯乙烷残留的报道。1,2-二氯乙烷作为一类溶剂,在原料及制剂的生产使用中应严格控制。本文运用GC-MS法分析吡罗昔康中的1,2-二氯乙烷残留量,并通过NIDRS法快速分析片剂中的原料药晶型差异进而检测片剂中1,2-二氯乙烷残留,方法独特创新,快速简便,结果准确可靠。
| [1] |
刘巍. 固体核磁技术在药物多晶型研究中的作用[D]. 兰州: 兰州大学, 2011 LIU W. Structural Studies of Polymorphs of Pharmaceutical Compound Using Solid-state NMR Spectroscopy[D]. Lanzhou:Lanzhou University, 2011 |
| [2] |
赵会英, 苏德森, 胡愈, 等. 吡罗昔康多晶型的制备及其热稳定性[J]. 沈阳药科大学学报, 2000, 17(2): 101. ZHAO HY, SU DS, HU Y, et al. Preparation and heat stability of piroxicam polymorphs[J]. J Shenyang Pharm Univ, 2000, 17(2): 101. |
| [3] |
MAIJA N, JORMA R, MATTI M, et al. Solid state transformations in consequence of electrospraying-A novel polymorphic form of piroxicam[J]. Eur J Pharm Biopharm, 2015, 89: 182. DOI:10.1016/j.ejpb.2014.11.027 |
| [4] |
吴范宏, 王葆丹, 奚关根. 美洛昔康和炎痛喜康的合成[J]. 华东理工大学学报, 2002, 28(3): 282. WU FH, WANG BD, XI GG. Synthesis of meloxicam and piroxicam[J]. J East China Univ Sci Technol, 2002, 28(3): 282. |
| [5] |
STORME-PARIS I, CLAROT I, ESPOSITO S, et al. Near Infrared Spectroscopy homogeneity evaluation of complex powder blends in a small-scale pharmaceutical preformulation process, a real-life application[J]. Eur J Pharm Biopharm, 2009, 72(1): 189. DOI:10.1016/j.ejpb.2008.11.002 |
| [6] |
ALEXANDRINO GL, KHORASANI MR, AMIGO JM, et al. Monitoring of multiple solid-state transformations at tablet surfaces using multi-series near-infrared hyperspectral imaging and multivariate curve resolution[J]. Eur J Pharm Biopharm, 2015, 98: 189. |
| [7] |
COSTA GB, FERNANDES DD, GOMES AA, et al. Using near infrared spectroscopy to classify soybean oil according to expiration date[J]. Food Chem, 2016, 196: 539. DOI:10.1016/j.foodchem.2015.09.076 |
| [8] |
薛晶, 贾燕花, 李进, 等. 头孢曲松钠的亚晶型分类及对产品质量的影响[J]. 药学学报, 2014, 49(7): 1034. XUE J, JIA YH, LI J, et al. Subtype classification of ceftriaxone sodium and its influence on the quality of product[J]. Acta Pharm Sin, 2014, 49(7): 1034. |
| [9] |
耿莹, 程奇蕾, 何兰. 近红外光谱法鉴别普伐他汀钠片及其原料药晶型的一致性研究[J]. 现代药物与临床, 2014, 29(10): 1105. GENG Y, CHENG QL, HE L. Identification of uniformity in pravastatin sodium tablets and crystallographic form in their active pharmaceutical ingredient by NIDRS method[J]. Drugs Clin, 2014, 29(10): 1105. |
| [10] |
付金广. 吡罗昔康工艺的改进[J]. 山东化工, 2013, 42(9): 19. FU JG. Improvement of piroxicam synthesis[J]. Shandong Chem Ind, 2013, 42(9): 19. |
| [11] |
何健雄. 吡罗昔康合成的改进[J]. 医药工业, 1987, 18(12): 531. HE JX. Improvement of piroxicam synthesis[J]. Pharm Ind, 1987, 18(12): 531. |
| [12] |
李育, 赵靖霞, 杨根金, 等. 顶空气相色谱法测定吡罗昔康原料药有机溶剂残留量[J]. 药学实践杂志, 2011, 29(1): 31. LI Y, ZHAO JX, YANG GJ, et al. Determination of residual by headspace gas chromatography organic solvents in piroxicam[J]. J Pharm Pract, 2011, 29(1): 31. |
| [13] |
彭炳先. 顶空气相色谱法测定吡罗昔康原料药中有机溶剂残留量[J]. 理化检验-化学分册, 2011, 47(9): 1060. PENG BX. Determination of residual organic solvents in raw medicinal proxicam by head space gas chromatography[J]. Phys Test Chem Anal, 2011, 47(9): 1060. |
 2017, Vol. 37
2017, Vol. 37 
