痔特佳胶囊由炒槐角、地榆炭、黄芩、炒枳壳、当归、防风、阿胶、鞣质8味药组成,具有清热消肿,凉血止血,收敛的功效,用于一、二期内痔,血栓性外痔,肛窦炎、直肠炎等。国家药品标准YBZ09402006-2010Z中只有黄芩苷的含量测定项,难以全面控制本制剂的内在质量。炒槐角清热泻火,凉血止血;地榆炭凉血止血,解毒敛疮;炒枳壳理气宽中,行滞消胀;鞣质具很强的收敛性,对于本制剂均具有非常重要的作用[1-2]。对于处方类似的痔特佳片剂各组分测定已有较多文献报道[3-5],但仅限于1~2味药的质量控制。作者参考相关文献[6-15],选择没食子酸、柚皮苷、槐角苷、新橙皮苷、黄芩苷、黄芩素和汉黄芩素作为炒槐角、地榆炭、黄芩、炒枳壳和鞣质的指标成分,建立了HPLC法同时测定7个成分的含量测定方法。该方法专属性强,操作简便,结果准确,为更好控制药品质量提供依据。
1 仪器与试药 1.1 仪器岛津LC-20A系列高效液相色谱仪(SHIMADZU公司,包括DGU-20A脱气机、SIL-20自动进样系统、SPD-20A紫外检测器、CTO-20A柱温箱、LCsolution色谱工作站);Hydrosphere C18色谱柱(250 mm×4.6 mm,5 μm;填料:十八烷基硅烷键合硅胶;YMC公司);METTLER TOLEDO MS205DU十万分之一电子天平(梅特勒-托利多公司);KS-300E超声波清洗器(宁波科生仪器厂);BWS-10恒温水浴锅(上海一恒科技有限公司)。
1.2 试药痔特佳胶囊,山东中大千方制药有限公司提供,批号20150201、20150501、20150801。
对照品没食子酸(批号110831-201204,含量89.9%)、柚皮苷(批号110722-2011111,含量93.2%)、槐角苷(批号111695-201502,含量98.8%)、新橙皮苷(批号111857-201102,含量99.6%)、黄芩苷(批号110715-201318,含量93.3%)、黄芩素(批号111595-200604,供含量测定用)、汉黄芩素(批号111514-200403,供含量测定用)均购自中国食品药品检定研究院。
乙腈、甲醇为色谱纯,磷酸为分析纯,水为纯化水。
2 方法与结果 2.1 溶液的制备 2.1.1 混合对照品溶液精密称取没食子酸、柚皮苷、槐角苷、新橙皮苷、黄芩苷、黄芩素和汉黄芩素对照品适量,加70%甲醇水溶液制成质量浓度分别为没食子酸13.6 μg·mL-1、柚皮苷25.6 μg·mL-1、槐角苷73.3 μg·mL-1、新橙皮苷24.8 μg·mL-1、黄芩苷158.6 μg·mL-1、黄芩素19.7 μg·mL-1和汉黄芩素4.9 μg·mL-1的混合溶液,即得。
2.1.2 供试品溶液取本品内容物,研细,精密称取约0.2 g,精密加入70%甲醇水溶液50 mL,称量,回流提取60 min,放冷,再称量,用70%甲醇水溶液补足减失的量,摇匀,用0.45 μm的微孔滤膜滤过,取续滤液,即得。
2.1.3 阴性样品溶液按处方比例及制备工艺分别制备不含炒槐角、地榆炭、鞣质的阴性样品,不含炒枳壳的阴性样品,不含地榆炭的阴性样品和不含黄芩的阴性样品,再按“2.1.2”项下方法操作,分别制得各阴性样品溶液。
2.2 色谱条件与系统适用性试验采用YMC公司Hydrosphere C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱(0~3 min,5%A;3~15 min,5%A→19%A;15~32 min,19%A;32~34 min,19%A→24%A;34~42 min,24%A;42~45 min,24%A→40%A;45~50 min,40%A;50~53 min,40%A→49%A;53~58 min,49%A),流速为1.0 mL·min-1,检测波长为280 nm,柱温为30 ℃,进样量为10 μL。
在上述色谱条件下,分别吸取上述混合对照品溶液、供试品溶液及阴性样品溶液各10 μL,注入液相色谱仪进行测定,记录色谱图。结果样品色谱中目标峰与其他组分分离效果良好,分离度均大于1.5,理论板数均不低于5 000。色谱图见图 1。
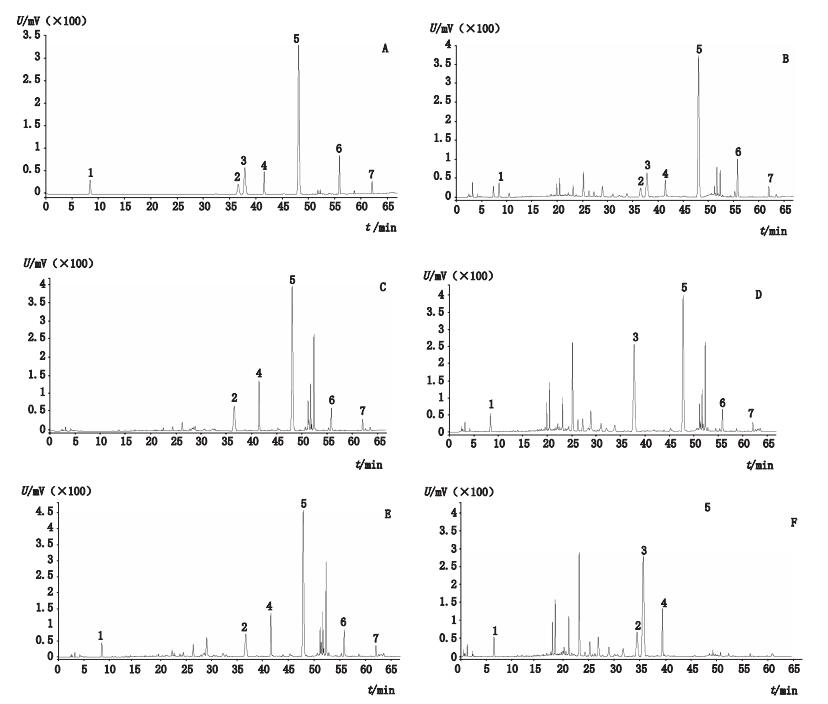
|
A.混合对照品(mixed reference substances)B.供试品(test sample)C.缺炒槐角、地榆炭、鞣质阴性样品(negative sample without stir fried Sophorae Fructus,charred Sanguisorbae Radix and tannins)D.缺炒枳壳阴性样品(negative sample without stir fried Aurantii Fructus)E.缺炒槐角阴性样品(negative sample without stir fried Sophorae Fructus)F.缺黄芩阴性样品(negative sample without Scutellariae Radix) 1.没食子酸(gallic acid)2.柚皮苷(naringin)3.槐角苷(sophoricoside)4.新橙皮苷(neohesperidin)5.黄芩苷(baicalin)6.黄芩素(baicalein)7.汉黄芩素(wogonin) 图 1 HPLC色谱图 Figure 1 HPLC chromatograms |
分别精密吸取“2.1.1”项下混合对照品溶液各1、2、5、10、15、20 μL,依次注入液相色谱仪,按“2.2”项下色谱条件进行测定。分别以对照品的进样量(μg)为横坐标,峰面积为纵坐标,进行线性回归,计算回归方程。另取“2.1.1”项下的混合对照品溶液,逐级稀释并进样测定,以仪器的信噪比S/N为3时计算检测限(LOD),以仪器的信噪比S/N为10时计算定量限(LOQ),结果见表 1。
|
|
表 1 7个成分的线性关系、检测限、定量限结果 Table 1 Linear relationship, LOD and LOQ of seven constituents |
精密吸取“2.1.1”项下混合对照品溶液10 μL,连续进样6次,记录色谱峰的峰面积,计算没食子酸、柚皮苷、槐角苷、新橙皮苷、黄芩苷、黄芩素和汉黄芩素峰面积的RSD分别为0.4%、0.7%、0.5%、0.3%、0.6%、0.6%、1.2%;试验结果显示仪器精密度良好。
2.5 供试品溶液稳定性试验取同一份供试品溶液,分别在制备后0、5、10、15、20、25 h,按“2.2”项下色谱条件进行测定,记录峰面积,计算没食子酸、柚皮苷、槐角苷、新橙皮苷、黄芩苷、黄芩素和汉黄芩素峰面积的RSD分别为0.5%、0.7%、0.7%、0.5%、0.8%、0.5%、1.1%;表明供试品溶液在25 h内稳定,能够满足测定需要。
2.6 重复性试验取同一批样品(批号为20150501),按“2.1.2”项下方法平行制备6份供试品溶液;按“2.2”项下色谱条件进样测定,计算没食子酸、柚皮苷、槐角苷、新橙皮苷、黄芩苷、黄芩素和汉黄芩素的含量平均值分别为3.09、6.72、19.9、6.16、45.2、5.78、1.22 mg·g-1,RSD分别为0.8%、0.9%、0.7%、1.1%、0.5%、1.0%、1.5%;试验结果表明方法重复性良好。
2.7 加样回收率试验精密称取“2.6”项下已测知含量的样品(批号为20150501)0.1 g,共取6份,分别精密加入“2.1.1”项下混合对照品溶液25 mL,再精密加入70%甲醇水溶液25 mL,按“2.1.2”项下方法制备供试溶液,照“2.2”项下色谱条件进样测定,计算回收率。结果见表 2。
|
|
表 2 7个成分回收率试验结果(n=6) Table 2 Results of recovery tests of seven constituents |
取3批痔特佳胶囊,分别按“2.1.2”项下方法制备供试品溶液,按“2.2”项下色谱条件进行测定,外标法计算各成分的含量,结果见表 3。
|
|
表 3 痔特佳胶囊中7个成分的含量测定结果(mg·g-1,n=3) Table 3 Contents of 7 constituents in Zhitejia capsules |
作者尝试了乙腈-水、乙腈-0.1%磷酸水溶液、乙腈-0.05%磷酸水溶液、乙腈-0.2%醋酸水溶液、乙腈-0.1%醋酸水溶液等不同流动相组合进行梯度洗脱,结果以乙腈-0.05%磷酸水溶液分离度最佳,峰形最好。
3.2 波长的选择7个成分的紫外光谱扫描结果显示在280 nm处均有较强的吸收,故选择280 nm作为检测波长。
3.3 供试品溶液制备方法的考察对比多种提取溶剂(甲醇、乙醇、70%甲醇水溶液、50%甲醇水溶液),提取方式(超声处理、加热回流),提取时间(20、40、60、80 min)等影响因素,7种组分在不同组合中提取效率略有不同,综合结果以文中选择的70%甲醇水溶液回流提取60 min提取效率最高。
| [1] |
中国药典2015年版. 一部[S]. 2015: 126, 246, 355. ChP 2015. Vol Ⅰ[S]. 2015:126, 246, 355 |
| [2] |
WS1-129(B)-89卫生部药品标准[S]. 1989. WS1-129(B)-89 Drug Specifications Promulgated by the Ministry of Public Health, PR China[S]. 1989 |
| [3] |
索志荣, 秦海燕, 杜利成. HPLC法测定痔特佳片中染料木素、染料木苷和黄芩苷的含量[J]. 药物分析杂志, 2009, 29(10): 1662. SUO ZR, QIN HY, DU LC. HPLC determination of genistein, genistin and baicalin in Zhitejia tablets[J]. Chin J Pharm Anal, 2009, 29(10): 1662. |
| [4] |
王建明, 姜哲, 张晓燕. 痔特佳片鉴别与含量测定的研究[J]. 中国实验方剂学杂志, 2008, 14(9): 15. WANG JM, JIANG Z, ZHANG XY. Study on identification and content determination of Zhitejia tablets[J]. Chin J Exp Tradit Med Form, 2008, 14(9): 15. |
| [5] |
林小毅. 高效液相色谱法同时测定痔特佳片中柚皮苷和黄芩苷的含量[J]. 海峡药学, 2008, 20(6): 59. LIN XY. Determination of naringin and baicalin in Zhitejia tablets by HPLC[J]. Strait Pharm J, 2008, 20(6): 59. |
| [6] |
魏晓亮, 王冬梅, 张瑜, 等. RP-HPLC同时测定槐角丸中4种有效成分的含量[J]. 中国药学杂志, 2011, 46(7): 549. WEI XL, WANG DM, ZHAN GY, et al. Simultaneous determination of four effective components in Huaijiao pills by RPHPLC[J]. Chin Pharm J, 2011, 46(7): 549. |
| [7] |
靳怡然, 田婷婷, 贺璠, 等. 液相色谱-串联质谱法同时测定地榆槐角丸中9种化学成分[J]. 河北医科大学学报, 2015, 36(7): 745. JIN YR, TIAN TT, HE F, et al. Simultaneous determination of nine constituents in Di-Yu-Huai-Jiao pills by LC-MS/MS[J]. J Hebei Med Univ, 2015, 36(7): 745. |
| [8] |
车晓彦, 邓晓鸿, 周娟, 等. 槐角丸的HPLC特征图谱研究及柚皮苷和新橙皮苷的测定[J]. 华西药学杂志, 2013, 28(6): 645. CHEN XY, DENG XH, ZHOU J, et al. HPLC specific chromatograms study of Huaijiao pills and determination of naringin and neohesperidin[J]. West China J Pharm Sci, 2013, 28(6): 645. |
| [9] |
孟珺, 王立军. HPLC同时测定槐角丸中槐角苷、黄芩苷和柚皮苷含量[J]. 中药材, 2011, 34(4): 638. MENG J, WANG LJ. Simultaneous determination of sophoricoside, baicalin and naringin in Huaijiao pills by HPLC[J]. J Chin Med Mater, 2011, 34(4): 638. |
| [10] |
滕宇, 卢静华. RP-HPLC法同时测定地榆槐角丸中芍药苷、橙皮苷和黄芩苷[J]. 中成药, 2013, 35(9): 1929. TENG Y, LU JH. Simultaneous determination of paeoniflorin, hesperidine and baicalin in Diyu Huaijiao pills by RP-HPLC[J]. Chin Tradit Pat Med, 2013, 35(9): 1929. |
| [11] |
陈青竹, 喻明洁, 杨波, 等. 参榆颗粒的质量标准研究[J]. 第三军医大学学报, 2013, 35(12): 1252. CHEN QZ, YU MJ, YANG P, et al. Quality standard for Shenyu granules[J]. J Third Mil Med Univ, 2013, 35(12): 1252. |
| [12] |
周蓬, 马帅. 高效液相色谱法同时测定双金连合剂中7种成分含量[J]. 中国医院药学杂志, 2014, 34(17): 1479. ZHOU P, MA S. HPLC determination of seven components in Shuangjinlian mixture[J]. Chin Hosp Pharm J, 2014, 34(17): 1479. |
| [13] |
张金莲, 曾昭君, 李志强, 等. HPLC法测定枳壳不同炮制品中活性成分[J]. 中成药, 2014, 36(11): 2355. ZHANG JL, ZENG ZJ, LI ZQ, et al. Determination of active constituents from processed Aurantii Fructus by HPLC[J]. Chin Tradit Pat Med, 2014, 36(11): 2355. |
| [14] |
陈学建, 秦昆明, 李鹏, 等. 枳壳炮制前后HPLC特征图谱及橙皮苷含量测定研究[J]. 中华中医药学刊, 2013, 31(7): 1671. CHEN XJ, QIN KM, LI P, et al. Study on HPLC specific chromatograms and content of hesperidin of crude and processed Fructus Aurantii[J]. Chin Arch Tradit Chin Med, 2013, 31(7): 1671. |
| [15] |
蒋以号, 吕妍, 曹旻旻, 等. HPLC法测定枳壳不同炮制品中柚皮苷、橙皮苷和新橙皮苷的含量[J]. 中华中医药杂志, 2011, 26(3): 601. JIANG YH, LÜ Y, CAO MM, et al. Contents determination of naringin, hesperidin and neohesperidin in processed products of Fructus Aurantii by HPLC[J]. China J Tradit Chin Med Pharm, 2011, 26(3): 601. |
 2017, Vol. 37
2017, Vol. 37 