甜叶菊(Stevia rebaudiana Bertoni)别名甜菊、糖草,属菊科(Composite)斯台比亚属(Stevia),原产地在南美亚热带地区,1977年我国引进栽培获得成功。甜叶菊中含有甜叶菊糖苷[1],具有高甜度(为蔗糖的200~300倍)、低热量(仅为蔗糖的1/300)的特性[2],因而日益引起人们的关注和重视,被誉为最有发展前途的新糖源[3-4]。为进一步全面开发甜叶菊的应用,经研究发现甜叶菊中含有丰富的绿原酸类成分。Karakose[5]等人用串联质谱的方法在甜叶菊叶片中检测到了24种绿原酸类物质,包括咖啡酰奎宁酸、二咖啡酰奎宁酸和三咖啡酰奎宁酸。
绿原酸在植物界的分布十分广泛,从双子叶植物到蕨类植物都有分布,主要存在于忍冬科忍冬属(Lonicera)、菊科蒿属(Artemisia)等植物中。在杜仲、金银花、咖啡豆、菊花等植物中的含量非常高。此外,马铃薯、胡萝卜、菠菜、苹果等蔬菜水果中也含有绿原酸[6]。植物体内存在的绿原酸往往是混合物而非单一组分,包括单咖啡酰奎宁酸、双咖啡酰奎宁酸、三咖啡酰奎宁酸、绿原酸甲酯、绿原酸乙酯等[7]。绿原酸类化合物是一种重要的生物活性物质,具有抗菌、抗病毒、增高白血球、保肝利胆、抗肿瘤、降血压、降血脂、抗氧化及免疫调节等多种药理作用[8-9]。除了药用外,含绿原酸类化合物的植物和提取物还可以应用于食品、保健品及化妆品中,发挥多种功效作用,因此绿原酸是食品、药品、保健品、化妆品等工业的重要原料。为研究甜叶菊中绿原酸类成分[10-12],本文对甜叶菊中6种绿原酸类成分进行了含量测定方法研究,为甜叶菊的质量控制提供参考依据。
1 仪器和材料Agilent 1200型高效液相色谱仪(四元泵、脱气机、检测器);Agilent ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm;填料:十八烷基硅烷键合硅胶);Mettler Toledo AL204电子分析天平;Milli-Q Advantage A10纯水机。
对照品新绿原酸(批号150312)、绿原酸(批号150316)、隐绿原酸(批号141219)、异绿原酸B(批号150410)、异绿原酸A(批号150423)、异绿原酸C(批号150126)购于成都曼斯特生物科技有限公司,纯度均大于98.0%。乙腈、甲酸为色谱纯试剂,去离子水为Milli-Q纯水机制备。
2 方法与结果 2.1 色谱条件采用ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm)和在线过滤器,流动相A为0.1%甲酸水溶液,流动相B为乙腈,梯度洗脱(0~15 min,8%B→17%B;15~30 min,17%B→18%B;30~40 min,18%B→20%B;40~50 min,20%B→40%B;50~60 min,40%B→50%B),检测波长327 nm,柱温30 ℃,进样量5 μL。混合对照品溶液及样品的色谱图见图 1。
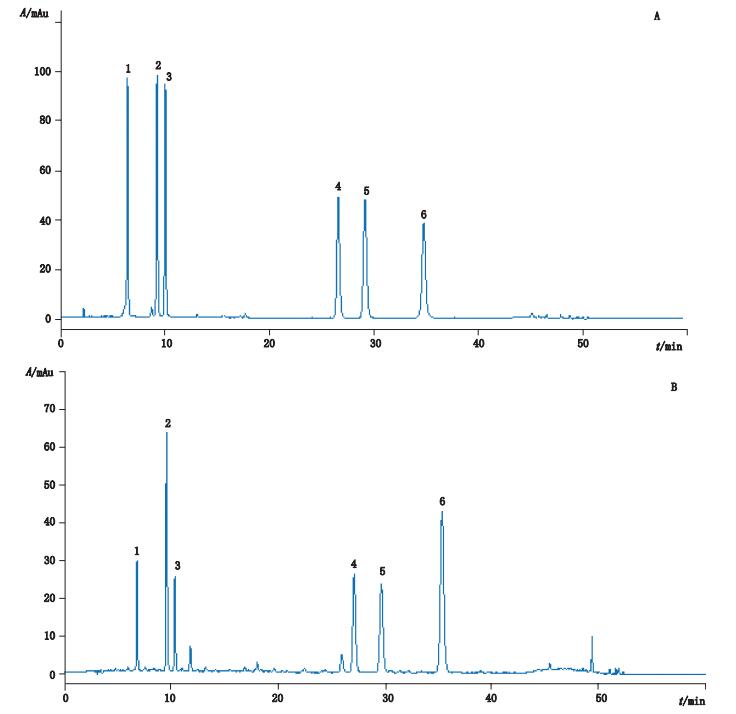
|
1.新绿原酸(5-caffeoylquinic acid)2.绿原酸(chlorogenic acid)3.隐绿原酸(4-caffeoylquinic acid)4.异绿原酸B(3,4-dicaffeoylquinic acid)5.异绿原酸A(3,5-dicaffeoylquinic acid)6.异绿原酸C(4,5-dicaffeoylquinic acid) 图 1 对照品(A)和样品S6(B)色谱图 Figure 1 HPLC chromatograms of reference substances(A) and sample S6(B) |
取甜叶菊样品50 g左右,用粉碎机粉碎,全部过24目筛,称取1 g样品于具塞锥形瓶中,加去离子水100 mL,称量,盖上塞子,95 ℃水浴加热90 min,放冷,用水补足减失的量,摇匀,过滤,取续滤液经微孔滤膜(0.22 μm)过滤,即得。
2.3 对照品储备液的制备精密称取6个对照品各约10 mg(精确至0.1 mg),分别置于6个10 mL量瓶中,加入甲醇溶解并定容,制成质量浓度分别为新绿原酸1.05 mg·mL-1、绿原酸1.01 mg·mL-1、隐绿原酸0.98 mg·mL-1、异绿原酸B1.10 mg·mL-1、异绿原酸A1.04 mg·mL-1、异绿原酸C1.03 mg·mL-1的对照品储备液,存放于4 ℃冰箱,备用。
2.4 线性关系考察精密吸取6个对照品储备液均0.05、0.1、0.25、0.5、0.75、1 mL,一一对应,分别置于6个5 mL量瓶中,加甲醇定容,制成不同浓度的混合对照品溶液,按“2.1”项下色谱条件进样分析。以峰面积Y为纵坐标,以质量浓度X(μg·mL-1)为横坐标,绘制标准曲线,并计算相关系数及线性范围(表 1)。结果显示6个化合物线性关系均良好。
|
|
表 1 6个化合物的线性关系 Table 1 Linearity correlations of six analytes |
精密吸取混合对照品溶液(质量浓度约为100 μg·mL-1),按“2.1”项下色谱条件连续进样6次,记录每个化合物的色谱峰峰面积,并计算RSD。新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C的精密度RSD分别为0.75%、0.56%、0.44%、0.23%、0.94%、1.24%,表明仪器精密度良好。
2.6 重复性试验取安徽宿州样品,称取6份,按“2.2”项下步骤制备供试品溶液,按“2.1”项下色谱条件进样分析,记录所测6个化合物的色谱峰峰面积,并计算含量。新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C含量的平均值分别为0.108%、0.277%、0.110%、0.180%、0.157%、0.350%,RSD分别为1.24%、0.45%、1.46%、2.10%、1.07%、1.64%,表明该方法重复性良好。
2.7 稳定性试验取安徽宿州供试品溶液,在室温下放置,分别于0、4、8、14 h进样分析,记录所测6个化合物的色谱峰峰面积,计算新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C峰面积的RSD分别为0.54%、3.42%、1.76%、2.60%、1.24%、2.84%。表明溶液中6个化合物在14 h内稳定性较好。
2.8 加样回收率试验取已知含量的安徽宿州样品5份,每份约0.5 g,精密稳定,分别精密加入新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C的对照品储备液0.55、1.40、0.55、0.90、0.80、1.75 mL,按“2.2”项下步骤制备供试溶液,按“2.1”项下色谱条件进样分析,计算回收率。结果上述化合物的平均回收率分别为98.3%、95.2%、100.1%、97.3%、95.6%、96.1%,RSD分别为0.42%、1.79%、1.51%、2.75%、2.06%、0.84%,表明该方法回收率良好。
2.9 样品含量测定取5个产地9个甜叶菊样品,按“2.2”项下步骤制备供试品溶液,按“2.1”项下色谱条件进样分析,用外标法计算6个化合物的含量,结果见表 2。
|
|
表 2 样品测定结果(%) Table 2 Determination results of samples |
本研究分别考察了样品加甲醇超声提取1 h和加水95 ℃水浴提取1 h,检测绿原酸类成分含量;结果表明加水95 ℃水浴提取1 h测定的绿原酸总含量比加甲醇超声提取1 h的高,因此选择加水水浴提取绿原酸类成分。分别考察了80、90、95、100 ℃热水浴提取1 h,检测绿原酸类成分含量,结果表明95、100 ℃水浴提取测定的绿原酸总含量较高,由于95 ℃水浴更易操作,因此选择水浴温度为95 ℃。还考察了95 ℃水浴提取1、1.5、2 h,结果表明提取1.5 h,绿原酸类成分即能提取完全,因此确定样品提取条件:样品加水95 ℃水浴提取1.5 h。本研究采用热水提取甜叶菊中绿原酸类成分,操作简单,没有使用有机溶剂,安全无毒,特别适合安全生产含绿原酸类成分的提取物。
3.2 含量测定结果分析本研究发现,作为糖草使用的甜叶菊除了含有高含量的甜菊糖苷外,还含有丰富的绿原酸类成分,6种酚酸含量之和高达6.726%,绿原酸含量高达2.450%。因此,在对甜叶菊中甜菊糖苷加工提取的时候,还可以综合利用其中绿原酸类成分,做到充分利用甜叶菊原料[13]。
3.3 小结绿原酸是药用植物中非常重要的功效成分[14],《中国药典》2015年版一部中有多种药材及制剂将绿原酸作为含量测定项进行质量控制[15]。本研究发现甜叶菊中含有丰富的绿原酸类成分,可为开发高含量绿原酸类成分产品提供重要的植物来源。
| [1] |
朱吟吟, 周凌. 高效液相色谱法测定甜叶菊中的3个甜菊醇糖苷的含量[J]. 药物分析杂志, 2014, 34(1): 184. ZHU YY, ZHOU L. HPLC determination of three steviol glycosides in Stevia rebaudiana Bertoni[J]. Chin J Pharm Anal, 2014, 34(1): 184. |
| [2] |
胡献丽, 董文宾, 郑丹, 等. 甜菊及甜菊糖研究进展[J]. 食品研究与开发, 2005, 26(1): 36. HU XL, DONG WB, ZHENG D, et al. Proceeding in use of the inulin[J]. Food Res Dev, 2005, 26(1): 36. |
| [3] |
朱东顺, 岳林旭, 李立安, 等. 浅析山东省甜叶菊生产现状及发展对策[J]. 中国糖料, 2001, 23(4): 43. ZHU DS, YUE LX, LI LA, et al. Current situation of inulin production in Shandong province and countermeasures for its development[J]. Sugar Crops China, 2001, 23(4): 43. |
| [4] |
JEPPESEN P B. Stevioside induces antihyperglycaemic, insulinotropic and glucagonostatic effects in vivo:studies in the diabetic GotoKakizaki(GK)rats[J]. Phytomedicine, 2002, 9(1): 9. DOI:10.1078/0944-7113-00081 |
| [5] |
KARAKOSE H, JAISWAL R, KUHNERT N. Characterisation and quantification of hydrocinnamate derivatives in Stevia rebaudiana leaves by LC-MS[J]. J Agric Food Chem, 2011, 59(18): 10143. DOI:10.1021/jf202185m |
| [6] |
PIRJOMATTILA, HEHSTROM J. Phenolic acids in potatoes, vegetables, and some of their products[J]. J Food Comp Anal, 2006, 19: 205. DOI:10.1016/j.jfca.2005.09.003 |
| [7] |
赵昱, 赵军, 李湘萍, 等. 咖啡酰奎尼酸类化合物研究进展[J]. 中国中药杂志, 2006, 32(11): 869. ZHAO Y, ZHAO J, LI XP, et al. Advances in caffeoylquinic acid research[J]. China J Chin Mater Med, 2006, 32(11): 869. DOI:10.3321/j.issn:1001-5302.2006.11.001 |
| [8] |
刘军海, 裘爱泳. 绿原酸及其提取纯化和应用前景[J]. 粮食与油脂, 2003, 16(9): 44. LIU JH, QIU AY. Application and extraction, purifying technology of chlorogenic acid[J]. Cereals Oils, 2003, 16(9): 44. |
| [9] |
吴卫华, 康桢, 欧阳冬生, 等. 绿原酸的药理学研究进展[J]. 天然产物研究与开发, 2006, 18(4): 691. WU WH, KANG Z, OUYANG DS, et al. Progresses in the pharmacology of chlorogenic acid[J]. Nat Prod Res Dev, 2006, 18(4): 691. |
| [10] |
付晓, 尹忠平, 上官新晨, 等. HPLC法同时测定甜叶菊中3种绿原酸类化合物[J]. 食品科技, 2014, 39(8): 276. FU X, YIN ZP, SHANGGUAN XC, et al. HPLC simultaneous determination of three caffeoylquinic acids in leaves of Stevia rebaudianum Bertoni[J]. Food Sci Technol, 2014, 39(8): 276. |
| [11] |
李军, 姜华, 石任兵. HPLC法测定甜叶菊有效部位中4个酚类成分含量[J]. 药物分析杂志, 2009, 29(4): 536. LI J, JIANG H, SHI RB. HPLC determination of four phenolic components in effective fraction of Stevia rebaudiana Bertoni[J]. Chin J Pharm Anal, 2009, 29(4): 536. |
| [12] |
郑荣, 郏征伟, 王柯, 等. 金银花提取物中6种有机酸类成分的测定[J]. 中成药, 2013, 35(3): 560. ZHENG R, JIA ZW, WANG K, et al. Quality control of six organic acids in Lonicerae Japonicae Flos extract[J]. Chin Tradit Pat Med, 2013, 35(3): 560. |
| [13] |
马磊, 石岩. 甜叶菊的综合开发利用[J]. 中国糖料, 2009, 31(3): 68. MA L, SHI Y. Comprehensive development and utilization of Stevia[J]. Sugar Crops China, 2009, 31(3): 68. |
| [14] |
王丽萍, 郭栋, 王果, 等. 中药绿原酸的研究进展[J]. 时珍国医国药, 2011, 22(4): 961. WANG LP, GUO D, WANG G, et al. Advancement of chlorogenic acid in traditional Chinese medicine[J]. Lishizhen Med Mater Med Res, 2011, 22(4): 961. |
| [15] |
中国药典2015年版. 一部[S]. 2015: 30. ChP2015. Vol Ⅰ[S]. 2015:30 |
 2017, Vol. 37
2017, Vol. 37 