2. 山东中医药大学实验中心, 济南 250355
2. Experience Center of Shandong University of Traditional Chinese Medicine, Jinan 250355, China
半夏来源于天南星科半夏属植物半夏Pinellia ternata(Thunb.)Breit.,始载于《神农本草经》,其药用部位为块茎,具有燥湿化痰、降逆止呕、消痞散结的功效[1],为历代医家及现代临床成方中药中重要的一味中药。目前报道的半夏中主要化学成分有生物碱、氨基酸、挥发油、有机酸、核苷等[2-4]。其中核苷类成分具有广泛的生理活性,是生物细胞维持生命活动的基本组成元素,该类成分可参与DNA的代谢过程,具有抗肿瘤,抗病毒,免疫调节,改善细胞代谢,镇静中枢神经,抗血小板凝集,抗心律失常和抗惊厥等多种生物活性[5-8]。核苷常作为半夏等根及根茎类中药的含量测定指标性成分[9],已有文献报道半夏中核苷成分的含量测定[10-13],但对生半夏及其伪品掌叶半夏、水半夏以及天南星中核苷类成分同时作含量测定比较的较少。半夏作为一种传统临床用药,用量大,但产量低,野生资源匮乏,栽培品种质资源也得不到很好的质量保证。故市场上常会出现用与半夏同属不同种但产量大、价格低的掌叶半夏,甚至同科不同属的伪品比如水半夏、天南星混作半夏使用[14-17],影响临床药效。为了进一步对半夏药材进行甄别,本课题组在吕爱娟等[11]测定半夏核苷类含量的基础上进行优化,利用高效液相色谱法对半夏及其伪品中的核苷类化学成分进行研究分析,同时测定半夏及其伪品中的9种核苷类成分含量,比较半夏药材与伪品之间差异,为选育半夏优良品种提供依据,为半夏的药效物质基础研究及质量评价与控制提供参考方法。
1 仪器与试药 1.1 仪器Agilent 1200高效液相色谱系统,包括自动进样器、在线脱气机、四元梯度泵、柱温箱和DAD检测器(Agilent,美国);Diamonsil C18色谱柱[150 mm×4.6 mm,5 μm;硅胶(>99%);北京迪马欧泰科技发展中心,中国]实验室超纯水器(PURELAB ELGA,英国);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司,中国),TD5A台式低速离心机(盐城市凯特实验仪器有限公司,中国)。
1.2 试药9种核苷对照品:尿嘧啶(批号N-024-150730)、尿苷(批号N-025-150730)、腺嘌呤(批号X-060-150801)、腺苷(批号X-022-141027)、次黄嘌呤(批号C-069-150728)、次黄嘌呤核苷(批号J-059-150730)、胸苷(批号X-074-150715)、胞苷(批号B-109-150715)和鸟苷(批号N-021-150730均购于成都瑞芬思生物科技有限公司,标示含量≥98%(经本实验用高效液相色谱仪检测,纯度均在98%以上)。流动相所用乙腈、甲醇为色谱纯;甲酸、三乙胺为分析纯;实验用水为超纯水。
实验用12批药材经山东中医药大学生药教研室徐凌川教授鉴定为天南星科植物半夏属半夏Pinellia ternate(Thunb.)Breit.的干燥块茎、天南星科植物半夏属掌叶半夏Pinellia pedatisecta Schott.的干燥块茎、天南星科植物异叶天南星Arisaema heterophyllum Bl.的干燥块茎、天南星科犁头尖属水半夏Typhonium flagelliforme(Lodd.)Blume的干燥块茎。以上所有药材凭证标本存于本实验室,样品来源见表 1。
|
|
表 1 样品来源 Table 1 The source of samples |
采用Diamonsil C18色谱柱(150 mm×4.6 mm,5 μm),以水(A)-甲醇(B)为流动相,梯度洗脱(0~7.0 min,2%B;7.0~7.1 min,2%B→3%B;7.1~13.0 min,3%B;13.0~25.0 min,3%B→20%B;25.0~40.0 min,20%B→100%B),流速0.8 mL·min-1,检测波长262 nm,柱温25 ℃,进样量50 μL。
2.2 混合对照品储备液制备分别准确称取尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、次黄嘌呤核苷、鸟苷、胸苷和腺苷的对照品适量,加水溶解配制成每1 mL含上述9个化合物依次为145、210、212、202、204、192、196、218、206 μg的对照品储备液,精密移取上述各对照品储备液适量,加水配成每1 mL依次含5.80、8.40、8.48、8.08、8.16、7.68、7.84、8.72、8.24 μg的混合对照品储备液,备用。
2.3 供试品溶液制备取半夏样品粉末(过65目筛)各约0.2 g,精密称定,置25 mL磨口具塞锥形瓶中,分别加超纯水10 mL,超声(功率250 W,频率40 kHz)提取1 h,放冷,用水补足减失的量,离心(3 000 r·min-1)10 min,上清液以0.22 μm微孔滤膜滤过,即得。
2.4 方法学考察 2.4.1 线性关系考察及检测限、定量限测定精密吸取“2.2”项下混合对照品储备液0.2、2、4、6、8 mL,分别置于10 mL量瓶中,加水定容至刻度,即得5个浓度系列的混合对照品溶液;精密吸取混合对照品储备液及5个浓度系列的混合对照品溶液各50 μL,按照“2.1”项下色谱条件进样测定,以各对照品峰面积Y对对照品质量浓度X(μg·mL-1)进行线性回归,得回归方程。结果见表 2。并测定检测限(LOD,S/N=3)和定量限(LOQ,S/N=10),结果见表 2。
|
|
表 2 9种核苷类成分的回归数据、检测限及定量限(n=6) Table 2 Regression data, limit of detection(LOD)and limit of quantification(LOQ)of 9 investigated nucleosides |
取同一份混合对照品溶液,同一天连续进样6次,计算各成分峰面积的RSD,考察日内精密度;每天进样2次,连续测定3 d,计算各成分峰面积的RSD,考察日间精密度。结果尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、次黄嘌呤核苷、鸟苷、胸苷和腺苷的日内精密度RSD(n=6)分别为0.28%、0.75%、0.27%、0.43%、2.82%、1.74%、1.08%、0.76%和1.14%;日间精密度RSD(n=6)分别为0.40%、0.45%、0.37%、0.41%、2.95%、2.04%、1.91%、1.02%和1.22%。数据表明日内和日间精密度良好。
2.4.3 重复性考察取1号样品的粉末6份,分别按照“2.3”项下方法制备供试品溶液,按照“2.1”项下色谱条件进样测定,以外标法计算含量。结果尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、次黄嘌呤核苷、鸟苷、胸苷和腺苷的平均含量分别为5.84、124.58、19.88、172.06、131.45、7.91、204.41、29.11、68.73μg·g-1,RSD分别为0.89%、1.89%、1.69%、0.55%、1.39%、3.84%、1.65%、0.92%和0.85%,表明本法重复性良好。
2.4.4 稳定性考察取同一份供试品溶液,分别于制备后0、2、4、8、12、24 h按“2.1”项下色谱条件进样,测定尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、次黄嘌呤核苷、鸟苷、胸苷和腺苷峰面积的RSD(n=6)分别为2.55%、1.94%、0.76%、0.50%、1.09%、3.63%、1.29%、1.33%和0.26%。表明样品中9种核苷类成分提取后24 h内稳定性良好。
2.4.5 加样回收率考察称取己知含量的1号样品的粉末6份,每份约0.1 g,精密称定,按各成分在原药材中的含有量分别精密加入等量的各对照品储备液,按“2.3”项下方法制备供试溶液(加入提取溶剂水的体积为10 mL减去加入对各对照品储备液的体积共1.13 mL),进样测定,计算加样回收率。结果见表 3。表中9种成分的平均加样回收率(n=6)在96.73%~103.56%,RSD在0.33%~4.05%之间,表明本法准确度良好。
|
|
表 3 半夏中9种核苷类成分的加样回收率考察(n=6) Table 3 Recoveries of 6 investigated nucleosides in Pinelliae Rhizoma |
按照“2.3”项下方法制备供试品溶液,进样测定3次,以外标法计算不同来源的半夏及伪品中尿嘧啶、胞苷、次黄嘌呤、尿苷、腺嘌呤、次黄嘌呤核苷、鸟苷、胸苷和腺苷的含量,HPLC谱图见图 1,含量测定结果见表 4。
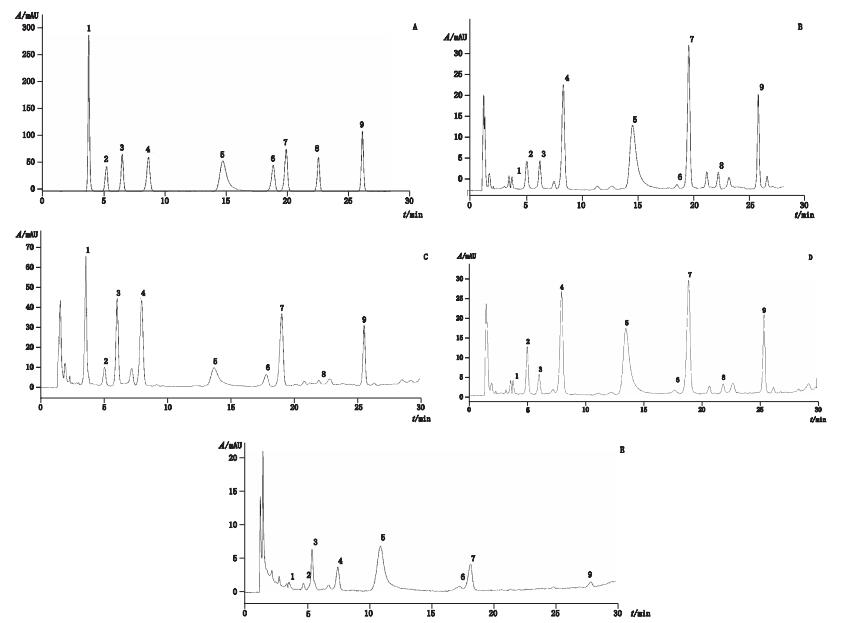
|
A.混合对照品(a mixture of reference substances)B.半夏(Pinelliae Rhizoma)C.水半夏(Typhonii Flagelliformis Rhizoma D.掌叶半夏(Pinelliae Pedatisectae Rhizoma)E.天南星(Arisaemae Rhizoma) 1.尿嘧啶(uracil)2.胞苷(cytidine)3.次黄嘌呤(hypoxanthine)4.尿苷(uridine)5.腺嘌呤(adenine)6.次黄嘌呤核苷(inosine)7.鸟苷(guanosine)8.胸苷(thymidine)9.腺苷(adenosine) 图 1 混合对照品及样品HPLC色谱图 Figure 1 HPLC chromatograms of reference substances and samples |
|
|
表 4 样品测定结果(n=3,μg·g-1) Table 4 Determination results of samples |
研究结果表明9种核苷类成分在半夏样品中均可检出,但由于药材的产地与来源不同,其含量差异较大。其中尿嘧啶含量最低,为5.879~19.19μg·g-1,个别药材(2号、6号样品)尿嘧啶含量低于定量限;次黄嘌呤含量亦较低,为19.51~77.42μg·g-1。尿苷和鸟苷的含量较高,分别为134.9~303.4 μg·g-1和126.8~296.2 μg·g-1。不同产地半夏以山东产半夏(7号样品)品质较好,核苷总量为960.6 μg·g-1。各批次半夏样品核苷总量在626.7~1 063 μg·g-1之间,分析原因可能是不同地区的土壤、气候、水分、矿物质分布情况、药材的采收期、采收年限及药材种源等,对药材成分含量产生了一定的影响。
掌叶半夏中9种核苷类成分均可以检测到,平均核苷总量与半夏基本无差别。水半夏9种核苷类成分亦均可以检测到,但是与半夏相比,在含量上有明显差异。水半夏中次黄嘌呤和尿嘧啶的含量明显高于半夏以及掌叶半夏。天南星中9种成分含量测定结果与半夏差异较大,胸苷在天南星中未检出,尿嘧啶,次黄嘌呤核苷和腺苷的含量低于检测限。
由于采集样品数量有限,各核苷类成分含量与产地、来源、气候等因素之间的关联性,有待进一步研究。
3.2 提取方法的选择本实验在吕爱娟等[11]测定半夏核苷类成分含量的基础上考察了甲醇–水、乙醇–水、纯水3种提取溶剂的9种不同比例的溶剂(即100%甲醇、75%甲醇、30%甲醇、10%甲醇水溶液,以及95%乙醇、75%乙醇、30%乙醇、10%乙醇水溶液、纯水),结果甲醇以及高浓度乙醇提取效率极低,核苷类成分几乎没有提取出来,纯水提取核苷类成分的效果明显优于其他。同时考察了超声提取、回流提取以及冷浸提取3种方法,结果超声提取效果较好。并进一步在以上优化的基础上对超声时间(30、60、90、120 min),次数(1、2、3、4次)以及溶剂量(10倍、50倍、100倍、200倍)做了考察,最终结果为50倍量水超声提取1次,每次1 h,提取核苷类成分效果最优,故本实验选用此法作为制备供试液的方法。
3.3 色谱条件优化比较了流动相对峰形的影响,考察了甲醇-水、乙腈-水、甲醇-甲酸水、甲醇-三乙胺水4种流动相,其中甲醇-水结果优于乙腈-水,使用甲酸时峰型较乱,加入三乙胺时对峰形的改善较之甲醇-水时并不明显,故采用较常见且色谱柱耐受性好的甲醇-水作为流动相。本实验在流动相为甲醇-水条件下采用Diamonsil C18分析柱进行条件优化,最终确定了本文所述色谱条件。此外,本文利用二极管阵列检测器(DAD)对混合对照品溶液行了全波长扫描,其在262 nm波长下各检测成分在本文色谱条件下有最优吸收,峰形较好,基线平稳,故最终选取262 nm作为检测波长。
3.4 小结本实验首次对半夏中9种核苷类成分同时进行测定,建立的方法方便、快速,对选育半夏优良品种以及半夏的药效物质基础、质量评价与控制具有指导意义。
| [1] |
中国药典2015年版. 一部[S]. 2015: 119. ChP 2015. Vol Ⅰ[S]. 2015:119 |
| [2] |
张之昊, 戴忠, 胡晓茹, 等. 半夏化学成分的分离与鉴定[J]. 中药材, 2013, 36(10): 1620. ZHANG ZH, DAl Z, HU XR, et al. lsolation and structure elucidation of chemical constituents from Pinellia ternata[J]. J Chin Med Mater, 2013, 36(10): 1620. |
| [3] |
JI X, HUANG BK, WANG GW, et al. The ethnobotanical, phytochemical and pharmacological profile of the genus Pinellia[J]. Fitoterapia, 2014, 93(4): 1. |
| [4] |
徐剑锟, 张天龙, 易国卿, 等. 半夏化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2010, 27(6): 429. XU JK, ZHANG TL, YI GQ, et al. Isolation and identification of chemical constituents from bulk of Pinellia ternata[J]. J Shenyang Pharm Univ, 2010, 27(6): 429. |
| [5] |
KINAHAN JJ, KOWAL EP, GRINDEY GB. Biochemical and antitumor effects of the combination of thymidine and 1-beta-Darabinofuranosylcytosine against leukemia L1210[J]. Cancer Res, 1981, 41(2): 445. |
| [6] |
SCHNEIDER B, SARFATI R, DEVILLE-BONNE D, et al. Role of nucleoside diphosphate kinase in the activation of anti-HIV nucleoside analogs[J]. J Bioenerg Biomembr, 2000, 32(3): 317. DOI:10.1023/A:1005501432684 |
| [7] |
SUN Q, LI XJ, GONG SS, et al. A novel synthesis of antiviral nucleoside phosphoramidate and thiophosphoramidate prodrugs via nucleoside H-phosphonamidates[J]. Nucleosides Nucleotides Nucleic Acids, 2013, 32(11): 617. DOI:10.1080/15257770.2013.838262 |
| [8] |
LEE J, CHUANG TH, REDECKE V, et al. Molecular basis for the immunostimulatory activity of guanine nucleoside analogs:activation of Toll-like receptor 7[J]. Proc Nat Acad Sci, 2003, 100(11): 6646. DOI:10.1073/pnas.0631696100 |
| [9] |
赵同玉, 吕广萍, 王兰英, 等. 高效液相色谱法测定北虫草中6个核苷含量[J]. 药物分析杂志, 2015, 35(6): 1078. ZHAO TY, LÜ GP, WANG LY, et al. HPLC determination of six nucleosides in Cordyceps militaris[J]. Chin J Pharm Anal, 2015, 35(6): 1078. |
| [10] |
张科卫, 吴皓, 李伟. HPLC同时测定半夏药材中次黄嘌呤核苷、鸟嘌呤核苷的含量[J]. 药物分析杂志, 2005, 25(5): 487. ZHANG KW, WU H, LI W. Determination of inosine and guanosine in rhizoma Pinellia ternate[J]. Chin J Pharm Anal, 2005, 25(5): 487. |
| [11] |
吕爱娟, 张志澄, 张科卫, 等. RP-HPLC法同时测定半夏中5种核苷含量的研究[J]. 药物分析杂志, 2007, 27(7): 1051. LÜ AJ, ZHANG ZC, ZHANG KW, et al. RP-HPLC determination of five nucleosides in Rhizoma Pinelliae[J]. Chin J Pharm Anal, 2007, 27(7): 1051. |
| [12] |
阮洪根, 何禄仁, 宋平顺, 等. 不同产地与规格半夏中4种核苷(或碱基)的含量测定及统计分析[J]. 中国药业, 2014, 23(18): 40. RUAN HG, HE LR, SONG PS, et al. Content determination and statistical analysis of four nucleosides or bases in different habitats and specifications of Rhizoma Pinellia ternate[J]. China Pharm, 2014, 23(18): 40. |
| [13] |
黄鲛, 易进海, 刘玉红, 等. 天南星、半夏、白附子中8种核苷成分的含量测定[J]. 中国实验方剂学杂志, 2013, 19(16): 59. HUANG J, YI JH, LIU YH, et al. Determination of eightnucleosides in Rhizoma Arisaema, Rhizoma Pinelliae and Rhizoma Typhonii[J]. Chin J Exp Tradit Med Form, 2013, 19(16): 59. |
| [14] |
LIU Y, LIANG Z, ZHANG Y. Induction and in vitro alkaloid yield of calluses and protocorm-like bodies(PLBs)from Pinellia ternata[J]. In Vitro Cell Develop Biol-Plant, 2010, 46(3): 239. DOI:10.1007/s11627-009-9268-9 |
| [15] |
NⅡJIMA A, KUBO M, HASHIMOTO K, et al. Effect of oral administration of Pinellia ternata, Zingiberis rhizoma and their mixture on the efferent activity of the gastric branch of the vagus nerve in the rat[J]. Neurosci Lett, 1998, 258(1): 5. DOI:10.1016/S0304-3940(98)00830-1 |
| [16] |
HE LY, DING Z, JIANG F, et al. Induction and identification of hexadecaploid of Pinellia ternata[J]. Euphytica, 2012, 186(2): 479. DOI:10.1007/s10681-012-0642-z |
| [17] |
YE SF, WANG M, LIU LQ, et al. Quality grading of artificial tuber seed of Pinellia ternata[J]. China J Chin Mater Med, 2010, 35(11): 1382. |
 2017, Vol. 37
2017, Vol. 37 
