2. 中南大学药学院, 长沙 410013
2. School of Pharmaceutical Sciences, Central South University, Changsha 410013, China
阿胶为马科动物驴Equus asinm L.的干燥皮或鲜皮经煎煮、浓缩制成的固体胶[1]。其药用历史悠久,始载于《神农本草经》,被列为“补血圣药”,是药食同源的重要物种,尤其在治未病方面功效显著。现代研究表明阿胶具有显著的抗贫血作用[2-3],调节身体机能,增强免疫力[4-5],在肿瘤辅助治疗[6]、哮喘病[7]等疾病防治上,其治疗优势也正逐步凸显。仅中国药典2015年版收载的含阿胶的成药即多达34个。随着人们对健康的日益重视,阿胶及其相关产品越来越成为大众与媒体关注的焦点。作为“中药三宝”之一,阿胶在我国保健食品市场占据重要地位[8],近年来阿胶也开始进入国外市场[9]。据不完全统计,目前全国各类阿胶企业达30余家,驴皮产值达近50亿元,但是,目前却出现了“有市无货”的尴尬局面[10]。由于驴养殖业发展比较滞后,驴的存栏数呈逐年下滑之势,以致近年制胶原料驴皮短缺,原料价格上涨,掺杂掺假时有发生。主要掺假成分包括猪皮、牛皮胶、马皮胶甚至皮革下脚料等。传统的阿胶鉴别采用外观性状和分析氨基酸理化性质等方法,需要极为丰富的个人经验和深厚的专业知识,由于氨基酸为动物共性成分,难以保证鉴别方法专属性,此外杂皮胶的制备工艺与正品相似,故其外观极为相似,而更增加了鉴别的难度。近来有采用近红外光谱技术[11]对阿胶真品和伪品进行快速区分的报道,但由于正品和伪品之间缺乏特征性指标,易对未知样品造成误判。
驴Equus. asinus L.和马Equus.caballus orientalis Noack为同科同属动物,骡子为马和驴的杂交种。驴皮与马皮、骡皮在毛色、性状等方面十分相近,肉眼很难区分,故市场上以马皮等作为驴皮伪品制造阿胶较为常见。传统中医认为马皮行血,而阿胶本意补血,若掺进马皮,反而起到反作用。故把好原料关对于阿胶及其制品的质量控制相当关键。不同物种的基因组不同,依据物种的特异序列,可以用引物经过聚合酶链式反应(polymerase chain reaction,PCR)扩增特异的产物,进一步辅以限制性内切酶片段长度多态性(RFLP)来鉴别物种源性[12]。本研究采用PCR-RFLP技术,建立了一种简单、快速且准确可靠的鉴定阿胶原料驴源性成分的方法,用于区分阿胶与其他动物皮胶类药材,尤其是区分驴近亲源性动物的掺杂,对于阿胶及其制品的质量控制具有重要的意义。
1 仪器与试药 1.1 仪器LabCycler梯度PCR仪(SensQuest GmbH)、Ver-iti梯度PCR仪(ABI)、T100梯度PCR仪(BIO RAD),DYY-2C电泳仪(北京六一仪器厂),G:BOX XT4全自动凝胶成像系统(Syngene),Nanodrop 2000微量紫外分光光度计(Thermo Scientific),AB 135分析天平(Mettler),FE20KpH计(Mettler),UV-TOC/UF纯水仪(Genpure)。
1.2 试剂血液/细胞/组织基因组DNA提取试剂盒[批号N2912,天根生化科技(北京)有限公司],dNTP Mixture(批号N3028,天根生化科技(北京)有限公司),普通Taq酶[批号N2520,天根生化科技(北京)有限公司]、高度保真的HS酶(普通缓冲液)(批号R010A,大连Takara公司)、高度保真的HS酶(GC缓冲液)(批号A1081C,大连Takara公司)、High Fidelity PCR Master(批号12140314001,德国Roche公司)、Phanta Super-Fidelity DNA Polymerase(批号P501-d1,南京诺唯赞生物科技公司),BamH I(批号00236830,美国Thermo Scientific公司),GelRed(批号14G0626,美国Biotium公司),琼脂糖(批号111860,西班牙BIOWEST公司)。引物(鼎国基因科技有限公司):上游5′-TTTGCCTTCCACTTTATTCTA-3′,下游5′-GTGTAGGGTAGGGATGAGTG-3′,Tris碱(批号D1021,美国Amresco公司);冰醋酸(批号20120627,国药集团化学试剂有限公司)、EDTA-Na2·2H2O(批号20130924,国药集团化学试剂有限公司)。
1.3 样品本实验所用样品来源于农家收集和企业产地收购,收集后放置于-80 ℃冰箱中保存备用。样品共40份,分别为驴皮16份,马皮6份,驴骡皮3份,马骡皮8份,牛等其他物种7份;均保存于湖南省食品药品检验研究院,均经湖南省药品检验研究院中药室主任丁野和专家杨友良老师鉴定,样品信息详见表 1。
|
|
表 1 样品信息 Table 1 Sample information |
从GenBank数据库下载的序列信息见表 2。
|
|
表 2 从GenBank下载相关物种Cytb序列信息 Table 2 Information of the Cytb sequences of related species downloaded from GenBank |
以DNAMAN V6对表 2序列进行多序列比对分析,在此基础上以软件Oligo 6设计仅能对驴、马获得目的扩增的特异引物,并经由NEB Cutter针对驴与其他物种DNA序列的差异选择合适的DNA限制性内切酶切位点。
2.3 样品处理取本品除去表面毛发,以灭菌超纯水清洗,取约0.1 g,再依次以75%乙醇5 mL及灭菌超纯水反复清洗至无醇味,吸干表面水分,剪细成直径约0.5 mm的小碎块,备用。
2.4 DNA提取用天根生化科技有限公司的血液/细胞/组织基因组DNA提取试剂盒提取总DNA。另取等量灭菌ddH2O,同模板DNA提取法制成提取空白对照溶液。采用琼脂糖凝胶电泳和微量紫外-分光光度仪(Thermo Nanodrop 2000)检测DNA质量、浓度及纯度。
2.5 PCR扩增在ABI Veriti PCR仪上进行。
优化的PCR扩增反应体系:总体积25 μL,其中引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)2 μL,10×PCR Buffer(Mg2+ plus)2.5 μL,Taq酶(2.5 U·μL-1)0.5 μL,模板DNA 1 μL,其余以灭菌ddH2O补充至25 μL。另取无菌超纯水1 μL代替DNA模板,同法上述PCR反应操作,作为空白对照。
PCR扩增程序:95 ℃预变性5 min后经过35个循环,每个循环包括95 ℃ 30 s,53 ℃退火30 s,72 ℃延伸45 s,最后72 ℃延伸7 min。
2.6 PCR质量控制及模板可靠性验证为了防止污染和误差的产生,同时建立阳性对照和阴性对照,阳性对照采用预实验扩增良好的马、马骡、驴、驴骡,阴性对照分别设置了环境对照、提取空白对照、阴性提取对照(本实验室的自行提取的石菖蒲DNA)、PCR阴性对照,同“2.5”项下扩增。
采用通用引物LCO1490/LCO2198[13]对QT01-07及马、马骡、驴、驴骡各2批进行PCR扩增,验证样本模板的可靠性。
2.7 BamHⅠ酶切反应反应体系30 μL,其中PCR产物10 μL,加入10×PCR缓冲液3 μL,限制性内切酶BamH Ⅰ 1 μL,去离子水补齐至30 μL,将反应液置37 ℃酶切反应1 h,反应结束后置于65 ℃水浴20 min,使酶失活。
2.8 琼脂糖凝胶电泳及凝胶成像使用2.5%琼脂糖凝胶检测PCR产物及酶切产物,75 V电压下电泳1.5 h,在紫外光灯下观察,并用凝胶电泳图像分析系统SYNGENE拍照并保存结果。
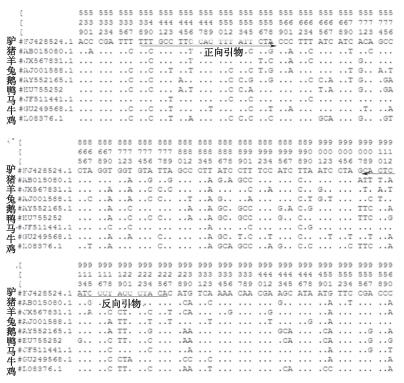
3 结果与分析 3.1 引物与酶切位点的获得经比对驴与其他8种动物的Cytb序列,设计了驴、马特异性的引物(图 1),再经酶切位点分析,在614 bp处仅驴、猪和羊有BamH I酶切点(图 2),故最终仅有驴能被酶切。
|
图 1 引物设计 Figure 1 Primer design |

|
图 2 BamH I酶切位点分析 Figure 2 Analysis of BamH I recognition sites |
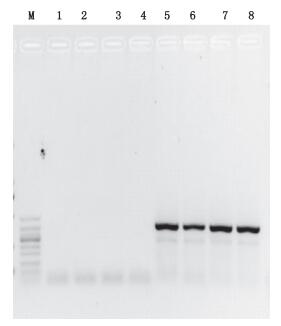
同“2.5”项下对各对照进行扩增,结果显示阳性对照均获得了约390 bp的目的条带,而各阴性对照均未获得目的条带(见图 3),表明已有效排除其他实验情况对结果产生的影响。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1.环境对照(environment control)2.提取空白对照(extraction blank)3.石菖蒲(Acorus tatarinowii)4.空白对照(blank)5.马(horse)6.马骡(mule)7.驴(donkey)8.驴骡(hinny) 图 3 PCR质量控制结果 Figure 3 Quality control of PCR |
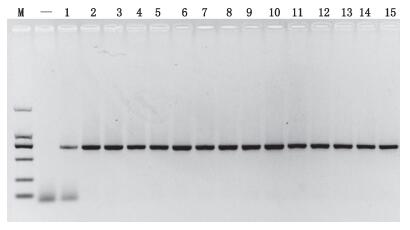
通用引物LCO1490/LCO2198对QT01-07及马、马骡、驴、驴骡各2批进行PCR扩增,结果均获得约710 bp的目的产物(见图 4),表明样本模板可靠。
|
M.凝胶电泳DNA分子标记(DL 2000),从上至下依次为(from top to bottom):2 000 bp、1 000 bp、750 bp、500 bp、250 bp、100 bp 1.鹅(goose)2.鸭(duck)3.羊(goat)4.鸡(brood)5.猪(pig)6.兔(rabbit)7.牛(cattle)8、9.马(horse)10、11.马骡(mule)12、13.驴(donkey)14、15.驴骡(hinny)“-”为空白(blank) 图 4 模板可靠性验证结果 Figure 4 Validation of the template reliability |
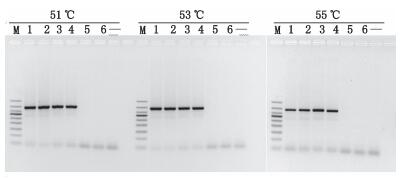
分别设置退火温度为51、53及55 ℃,考察不同退火温度对扩增的影响,筛选最佳退火温度。结果表明退火温度在51~55 ℃时,驴、驴骡、马、马骡均可扩增出约为390 bp的特异性片段,猪、牛均为阴性(见图 5)。综合考虑到不同实验室PCR仪及操作可能具有差异性,本研究选择退火温度为53 ℃。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1.马(horse)2.马骡(mule)3.驴(donkey)4.驴骡(hinny)5.猪(pig)6.牛(cattle)“-”为空白(blank) 图 5 退火温度对鉴别结果的影响 Figure 5 Effect of annealing temperature on the PCR result |
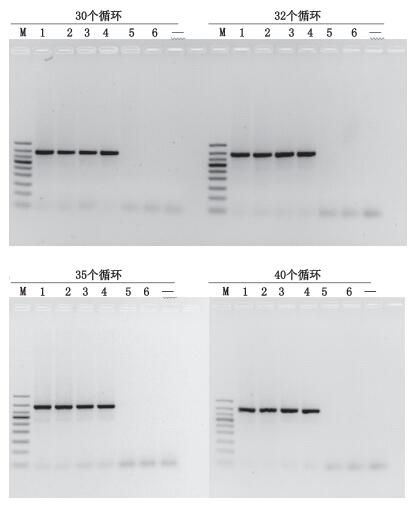
分别选用30、32、35和40个循环进行考察,筛选最适扩增循环次数,结果表明30个循环时就能扩增出目的条带(见图 6),为保证结果的准确性,避免扩增循环数过多导致可能的非特异性条带的扩增,同时考虑到不同实验室操作可能具有差异性,故循环次数选择为35个循环进行PCR反应。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1.马(horse)2.马骡(mule)3.驴(donkey)4.驴骡(hinny)5.猪(pig)6.牛(cattle)“-”为空白(blank) 图 6 不同循环数PCR扩增的结果 Figure 6 The PCR products amplified with different cycle numbers |
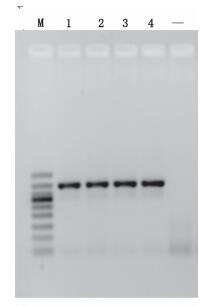
对25 μL PCR体系中的模板DNA用量进行了考察,调整DNA质量浓度约20 ng·μL-1,分别设置0.5 μL(相当于10 ng)、1 μL(相当于20 ng)、2.5 μL(相当于50 ng)以及4 μL(相当于80 ng)量的DNA模板,结果表明0.5~4 μL(相当于10~80 ng总DNA)均能扩增,并且,在循环数足够(30个循环)的情况下,随着DNA浓度的增加,扩增条带亮度呈逐渐增加的趋势,但浓度变化不影响鉴别结果的判读(见图 7)。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1. 10 ng 2. 20 ng;3. 50 ng 4. 100 ng “-”为空白(blank) 图 7 不同模板量的PCR扩增结果 Figure 7 The PCR products amplified using different template amounts. |
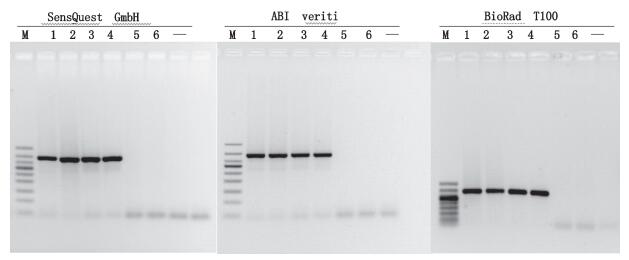
分别用SensQuest GmbH、ABI Veriti以及BIO RAD T100型基因扩增仪进行PCR扩增,结果表明在不同品牌PCR仪上的扩增条带基本一致,均不影响PCR鉴别结果的判定(见图 8)。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1.马(horse)2.马骡(mule)3.驴(donkey)4.驴骡(hinny)5.猪(pig)6.牛(cattle)“-”为空白(blank) 图 8 不同PCR仪的PCR扩增 Figure 8 The PCR products amplified on different PCR systems |
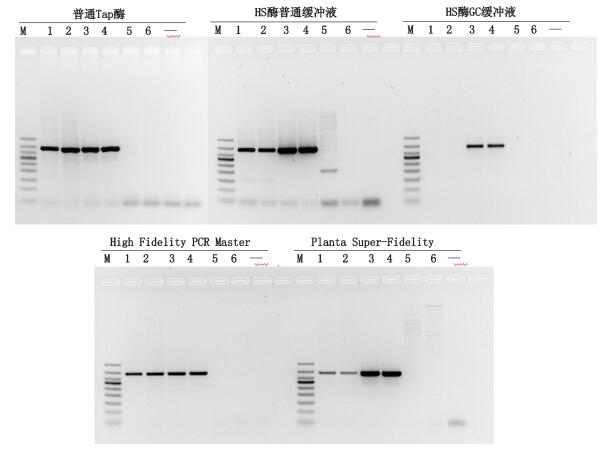
为考察不同保真度的酶对鉴别结果的影响,分别使用普通Taq酶(TIANGEN公司)、高度保真的HS酶普通缓冲液(Takara公司)、高度保真的HS酶GC缓冲液(Takara公司)、High Fid-elity PCR Master(Roche公司)和Phanta Super-Fid-elity DNA Polymerase(Vazyme公司)进行试验,结果表明同一种酶由于缓冲液的不同而扩增条带的亮度有明显的差异,除使用高度保真的HS酶GC缓冲液时不太理想外,其他酶都能获得有效扩增(见图 9),但以普通国产Taq酶的结果较稳定。为了确保结果的准确性,并兼顾经济适用性,故选择普通国产Taq酶进行实验。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1.马(horse)2.马骡(mule)3.驴(donkey)4.驴骡(hinny)5.猪(pig)6.牛(cattle)“-”为空白(blank) 图 9 不同酶的PCR扩增 Figure 9 The PCR products amplified using different enzymes |
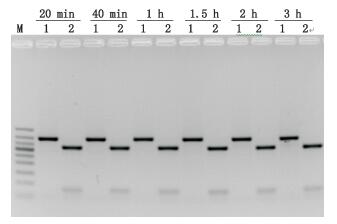
参考BamH I内切酶说明书,反应体系30 μL,其中PCR产物10 μL,加入10×PCR缓冲液2 μL,限制性内切酶BamH I1 μL,去离子水补齐至30 μL,对LP 01、MP 01的PCR产物37 ℃分别酶切20、40、60、90、120、180 min后,置65 ℃水浴20 min,使酶失活。结果表明6个时间点的酶切产物较为一致(见图 10),即对可酶切的驴皮PCR产物均已酶切完全。为了确保结果的准确性,故选择酶切时间为1 h进行实验。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp 1. MP01 2. LP01 图 10 不同酶切时间的酶切结果 Figure 10 Agarose gel electrophoresis of samples with different enzyme digestion time |
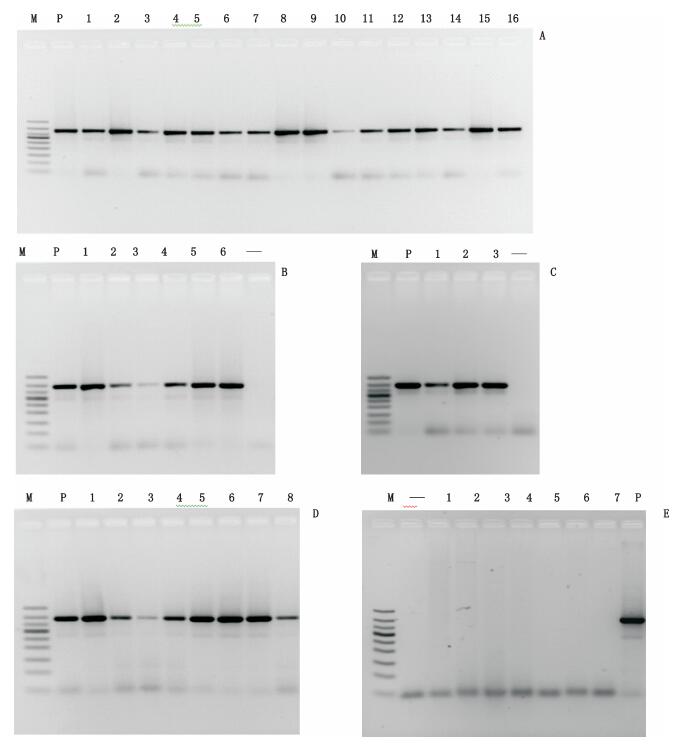
采用上述所确定的最佳反应体系和反应参数,总体积25 μL,其中包括引物(10 μmol·L-1)0.5 μL,dNTPs(2.5 mmol·L-1)2 μL,10×PCR Buffer(Mg2+ plus)2.5 μL,Taq酶(TIANGEN公司,2.5 U·μL-1)0.5 μL,模板DNA 20 ng,其余以灭菌ddH2O补充至25 μL。PCR反应参数:95 ℃预变性5 min后经过35个循环,每个循环包括95℃30 s,53 ℃退火30 s,72 ℃延伸45 s,最后72 ℃延伸7 min,4 ℃保存。使用收集的40批样品对所建立的PCR鉴别体系进行特异性考察和验证,结果表明,所有驴、驴骡、马、马骡均可扩增出约为390 bp的特异性片段(见图 11-A、B、C、D),在所研究的猪、牛等7个物种均为阴性扩增(见图 11-E)。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp;“-”为空白(blank) A. P. MP01 1~16. LP 01~16 B. P. LP 01 1~6.MP 01~06 C. P. MP 011~3. LL 01~03 D. P. LP 01 1~8. ML 01~08 E. 1~7. QT 01~07 P.LP 01 图 11 特异性引物对所有样本的PCR扩增结果 Figure 11 Agarose gel electrophoresis of PCR amplification for all samples |
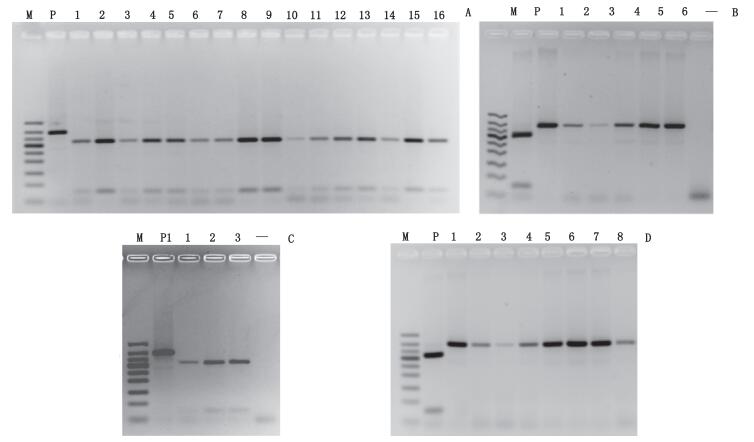
采用30 μL酶切反应体系,其中PCR产物10 μL,加入10×PCR缓冲液2 μL,限制性内切酶BamH I 1μL,去离子水补齐至30 μL,37 ℃分别酶切1 h后,置于65 ℃水浴20 min。对“3.6.1”项下33份阳性PCR产物进行酶切。结果表明,酶切之后,所有驴、驴骡样品在凝胶图上均在50~350 bp出现2个片段(约76 bp和314 bp)(见图 12-A、C),马、马骡样品的条带大小和数量在酶切前后没有改变,即不能被BamH I切割(见图 12-B、D),结果均与预期一致。
|
M.凝胶电泳DNA分子标记(DNA ladder 50 bp),从上至下依次为(from top to bottom):500 bp、400 bp、350 bp、300 bp、250 bp、200 bp、150 bp、100 bp、50 bp “-”为空白(blank); A. P. MP 01 1~16. LP 01~16 B. P. LP 01 1~6. MP 01~06 C. P. MP 011~3. LL 01~03 D. P. LP 01 1~8. ML 01~08 图 12 所有阳性PCR产物的BamH I酶切结果 Figure 12 Agarose gel electrophoresis of the results of BamH I incubation with the positive PCR products |
作为阿胶原料的驴皮商品来源复杂,质量参差不齐,以传统方法鉴别非常困难。把好原料关对于提高阿胶及其制品质量,规范药品的市场竞争行为,都具有积极深远的意义。本研究将现代分子生物技术应用于传统中药材的鉴定,通过运用PCR-RFLP法成功地将阿胶原料驴源性成分加以鉴别。方法简便、准确、稳定,可快速检测大量样品。为控制阿胶产品原料质量提供可靠方法,有利于保证用药安全。
马和驴在正反交中,受精卵的核基因相同,由马的32条染色体和驴的31条染色体提供;受精卵的质基因不同,马骡主要由母马卵细胞的线粒体提供,驴骡主要由母驴卵细胞的线粒体提供[14]。故本文以Cytb基因为目标基因的研究可鉴别源性成分,可成功排除掺杂马皮、马骡的风险。本研究中,驴骡与驴的鉴定结果一致。目前尚未见能对二者有效鉴别的报道。驴骡由于个头小,商品市场驴骡皮较为少见,作为阿胶原料应用的可能性较小。但为确保原料来源的唯一性,下一步课题组拟针对核基因进行研究,结合本文研究结果,能同时检测到马的核基因者为驴骡,反之则为驴,以进一步将驴骡与驴加以鉴别。
| [1] |
中国药典2015年版. 一部[S]. 2015: 189. ChP 2015. Vol Ⅰ[S]. 2015:189 |
| [2] |
宋怡敏, 毛跟年, 黄晓双, 等. 阿胶泡腾颗粒对小鼠造血功能及抗疲劳作用的影响[J]. 动物医学进展, 2011, 32(10): 83. SONG YM, MAO GN, HUANG XS, et al. Study on hemopoiesis and anti-fatigue effects of Ejiao effervescent granules in mice[J]. Prog Vet Med, 2011, 32(10): 83. DOI:10.3969/j.issn.1007-5038.2011.10.021 |
| [3] |
吴宏忠, 杨帆, 崔书亚, 等. 阿胶酶解成分对贫血小鼠造血系统的保护机制[J]. 华东理工大学学报(自然科学版), 2008, 34(1): 47. WU HZ, YANG F, CUI SY, et al. Fractions prepared from digested Colla Corii Asini and its hematopoietic mechanism on the anemic mice[J]. J East China Univ Sci Technol(Nat Sci Ed), 2008, 34(1): 47. |
| [4] |
张珣, 王静凤, 李冰, 等. 阿胶对小鼠免疫功能的影响[J]. 食品工业科技, 2011, 32(11): 400. ZHANG X, WANG JF, LI B, et al. Effect of Ejiao on immune function in mice[J]. Sci Technol Food Ind, 2011, 32(11): 400. |
| [5] |
路承彪, 童秋声, 吴钧. 中药阿胶对正常小鼠细胞免疫学功能的影晌[J]. 中药药理与临床, 1991, 7(4): 25. LU CB, TONG QS, WU J. The effect of Ejiao on cellular immunological function of normal mice[J]. Pharmacol Clin Chin Mater Med, 1991, 7(4): 25. |
| [6] |
刘培民, 蔡宝昌, 解锡军, 等. 阿胶含药血清对白血病K562细胞P53基因表达的影响[J]. 中药药理与临床, 2005, 21(6): 33. LIU PM, CAI BC, XIE XJ, et al. Effect of medicine serum of Ejiao on P53 gene expression of the leukemia K562 cells[J]. Pharmacol Clin Chin Mater Med, 2005, 21(6): 33. |
| [7] |
赵福东, 董竞成, 崔焱, 等. 阿胶对哮喘大鼠气道炎症及外周血Ⅰ型/Ⅱ型T辅助细胞因子的影响[J]. 中国实验方剂学杂志, 2006, 12(6): 59. ZHAO FD, DONG JC, CUI Y, et al. The effect of Ejiao on airway inflammation and Th1/Th2 Cytokines in serum of asthmatic rats[J]. Chin J Exp Tradit Med Form, 2006, 12(6): 59. |
| [8] |
佟艳霞. 浅议中药阿胶的临床应用及药理作用[J]. 中国卫生产业, 2013, 10(3): 178. TONG YX. Clinical application and pharmacological effects of Colla Corii Asini[J]. China Health Ind, 2013, 10(3): 178. |
| [9] |
吴长虹, 王若光. 阿胶的历史沿革, 研究现状及相关思考[J]. 湖南中医药大学学报, 2009, 28(6): 77. WU CH, WANG RG. Review on history, chemical compositions and pharmacological actions of Ejiao[J]. J TCM Univ Hunan, 2009, 28(6): 77. |
| [10] |
许兆君, 廖想想, 杨章平, 等. 我国家驴遗传资源现状分析[J]. 中国草食动物科学, 2012, 32(4): 70. XU ZJ, LIAO XX, YANG ZP, et al. Analysis on present genetic resources of Chinese ass[J]. China Herbivore Sci, 2012, 32(4): 70. |
| [11] |
瞿海斌, 杨海雷, 程翼宇. 近红外漫反射光谱法快速无损鉴别阿胶真伪[J]. 光谱学与光谱分析, 2006, 26(1): 60. QU HB, YANG HL, CHENG YY. Fast and nondestructive discrimination of donkeyhide glue by near-infrared spectroscopy[J]. Spectrosc Spect Anal, 2006, 26(1): 60. |
| [12] |
李丽娟, 袁晓龙. 源性成分鉴别检测技术研究进展[J]. 动物医学进展, 2015, 36(5): 107. LI LJ, YUAN XL. Research progress of dentification techniques for animal-derived materials[J]. Prog Vet Med, 2015, 36(5): 107. |
| [13] |
FOLMER O, BLACK M, HOEH W, et al. DNA primers for amplification of mitochondrial cytochrome coxidase subunit I from diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294. |
| [14] |
蒋军. 浅析骡子的遗传特征和繁育能力[J]. 科学教育, 2008, 14(1): 76. JIANG J. Analysis of genetic characteristics and breeding ability of mule[J]. Sci Educ, 2008, 14(1): 76. |
 2017, Vol. 37
2017, Vol. 37 
