苦瓜(Momordica charantia L.)是葫芦科(Cucur-bitaceae)苦瓜属植物[1]。苦瓜性寒味苦,具有降糖、减脂、抗突变、抗肿瘤以及提高人体自身免疫力抗癌等功效。已知的苦瓜有效成分有蛋白类化合物、甾体类化合物、氨基酸类化合物、三萜类化合物、烯烃类化合物以及其他一些皂苷类化合物,其中主要的α-苦瓜素和β-苦瓜素都是单链糖蛋白,且都不含凝集素,相对分子质量为29 000和28 000。N-末端残基都为Asp以及Glu,唯独没有Cys残基。不同的是β-苦瓜素不含有Met残基,因此在抗肿瘤时可以发挥不同的功效。其他的有效成分也多多少少存在着抗肿瘤活性[2]。并且苦瓜全身都是宝,根、茎、叶、花、果实、种子的提取物都含有丰富的生理活性。有效成分与抗肿瘤作用见表 1。目前,国内外对苦瓜降糖减脂的功效已经广为人知,现将苦瓜抗肿瘤药理机制的研究进展综述如下。
|
|
表 1 有效成分与抗肿瘤作用 Table 1 Active constituents and anti-tumor effects |
当今时代,肿瘤转移是影响肿瘤患者生存、生活最重要的原因,超过90%的肿瘤患者死于原发肿瘤的向外转移。只有更好地控制肿瘤转移,才能更有效地降低因肿瘤转移而引起的死亡。
在细胞的转移过程中细胞的趋化性变强[3],这个过程会涉及到许多调控因子,而其中的生长因子在一定条件下则会诱导细胞迁移[4]。肿瘤细胞转移的过程涉及上皮间质化和细胞粘附等过程[5]。其中,整联蛋白家族起到了至关重要的作用[6-8]。肿瘤细胞的转移过程如图 1所示。
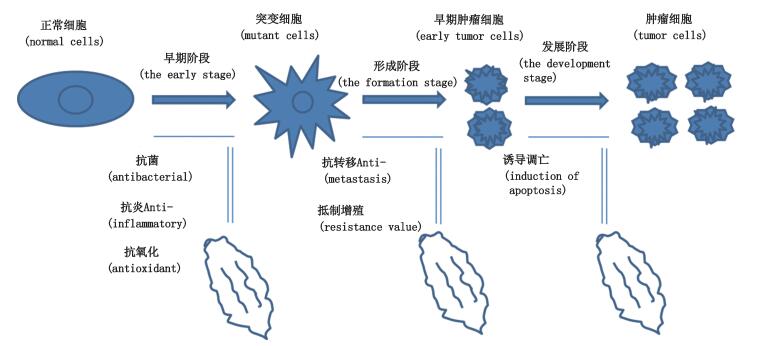
|
图 1 苦瓜中有效成分抗癌机制过程 Figure 1 Active component of balsam pear in the process of Anticancer mechanism |
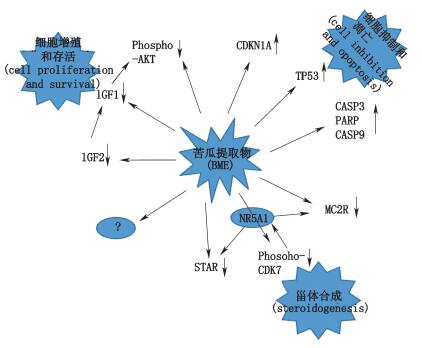
|
图 2 苦瓜素药理机制信号 Figure 2 Pharmacological mechanisms of Momordica charantia signal |
侵犯是指此时癌上皮细胞会松开癌细胞之间的连接,使之“重获自由”而能移动到其他地方。
侵犯最直接的表现则是细胞产生轻微炎症,而产生炎症的原因有很大程度来源于菌体。Zhang等[9]研究发现苦瓜液对革兰氏阳性球菌、革兰氏阳性杆菌和阴性杆菌都具有抗菌作用。其最低抑菌浓度(MIC)和最低杀菌浓度(MBC)均在1 250~2 500 mg·mL-1范围,证明了苦瓜可作为天然抗菌剂。Law 等[10]用肉类食品进行防腐研究发现,苦瓜原液和苦瓜提取液都能有效地延迟肉类食品的腐败变质和降低其细菌总数,说明苦瓜对肉类食品有一定的防腐作用,从而对细胞也有一定的抗菌作用。Kikuchi等[11]研究表明苦瓜叶提取物具有很强的杀菌作用,可以抑制和减少黑色素的含量,减少酪氨酸酶的表达,抑制MITF基因的表达。对于肿瘤转移前的微环境,了解得越多,对靶向定位治疗肿瘤就越有利,为临床治疗提供了基础。比如,整连蛋白家族的2个亚基如何结合在一起,苦瓜中有效成分能否减少黏附的必要条件(Ca2+或Mg2+)的多少呢,又能否影响蛋白和基质的信号识别来控制肿瘤细胞的转移,还有待于进一步研究。
1.2 内渗(vascular access)内渗是指癌细胞侵犯之后穿过血管或淋巴管的内皮进入循环系统。
在癌细胞进入循环系统时,有大量研究表明具有抗氧化作用和清除自由基作用的物质均对其有抑制作用。苦瓜的维生素C含量居瓜类榜首,而维生素C又是一种强力抗氧化剂,并且苦瓜子中的β-胡萝卜素和番茄红素也具有抗氧化作用。王先远等[12]研究发现苦瓜皂苷具有良好的抗氧化能力,可显著增强过氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-Px)活力。Okada等[13]认为苦瓜子中的多酚类物质总含量高于南瓜和黄瓜种子大约2倍,但是清除自由基的能力和多酚类物质的含量并不是呈正相关。比如,绿色大豆的提取物酚类物质含量较高,但是抗氧化性却很低。说明苦瓜的清除自由基的能力普遍强于其他瓜类(南瓜和黄瓜)。至于苦瓜能不能提高miR-335的表达水平,抑制肿瘤转移活性,以及如何调控起始肿瘤细胞运动(ECM)的水平还有待于进一步研究。
1.3 外渗(cancer metastasis)外渗是指此时癌细胞内渗之后经过循环系统之旅而不被抑制或消灭的幸存者会穿过微血管的内皮细胞到达其他组织,最后就是这些癌细胞的“移民新大陆”,在其他组织当中繁衍形成转移的恶性肿瘤。
当转移到另一个地方时,这时不但有炎症,更严重的是癌细胞无限增殖,无法控制。Tsao等[14]报道α-苦瓜素能选择性地杀伤绒毛膜癌细胞和黑色素瘤细胞。而对肝癌细胞的作用不明显,它对肿瘤细胞的毒性作用方式和干扰DNA代谢的一些抗癌药剂作用方式不同。在天花粉蛋白蛋白剂量50 μg·mL-1的前提下,再用α-苦瓜素2.5和25 μg·mL-1处理后,绒毛膜癌细胞里面绒毛膜促性腺激素和黄体酮的分泌显著减少,主要是由于癌细胞的减少。Ng TB等[15]研究发现α-苦瓜素能较强抑制S-180实体瘤生长和人胃癌细胞(NKM)细胞的DNA、RNA及其蛋白质合成活性,抑制肿瘤率分别为71.2%和68.6%。α-苦瓜素和β-苦瓜素对人胃癌NKM细胞的DNA、RNA和蛋白质合成也有明显的抑制作用,α-苦瓜素在0~50 μg·mL-1处理后,随着浓度的提高,抗肿瘤效果越明显。然而缺陷是,对荷瘤小鼠和正常小鼠免疫器官和免疫功能有损伤。沈等[16]证明α-苦瓜素(α-MMC)可明显抑制人乳腺癌细胞MCF-7移植瘤的生长,α-MMC的注射剂量在0.8~1.2 mg·kg-1时抗肿瘤效果显著。Deng等[17]用苦瓜在老鼠模型上试验发现苦瓜对乳腺癌肿瘤活性的抑制作用呈剂量依赖性,α-苦瓜素剂量增加,肿瘤活性越低,但是对模型的毒性增加,因此控制好α-苦瓜素的毒性,用3.0 mg·kg-1的α-MMC加上聚乙二醇的修饰便能起到比较好的效果。这种优化将是一种良好的抗癌药物搭配方法。Matsui等[18]研究出包含2个亚麻酸的甘油二酯是一种良好的抑制剂针对于DNA聚合酶,从而抑制肿瘤细胞的增殖。不仅如此,有日本科学家还发现维生素B17在苦瓜中含量丰富,对癌细胞有较强的抑制作用且对正常细胞无毒性。目前有学者认为苦瓜中的苦味来源于一种叫葫芦素的物质,而导致苦味的化学物质是Momordiside K、Momordiside L、Momordicine Ⅰ和Momordicine Ⅱ[29]。如能更好地将这些导致苦味的化学物质提取出来,将会为苦瓜作为药食同源抗肿瘤铺平道路。但是,如今特殊成分的分离鉴定还技术还有待于进一步提高。而且它的根、茎、叶、花、果实和种子均可药用[30],尤其果实中含有一种奎宁蛋白可以提高免疫细胞活性,其种子中更是含有抑制侵袭和转移的成分,为药用和膳食提供了更广泛的来源,相比于其他抗癌药降低了成本,让更多人可以防癌抗癌。
2 细胞凋亡细胞凋亡与肿瘤的发生密不可分,细胞凋亡受到抑制,打破了正常细胞更替的平衡,致使细胞不断增加,为肿瘤形成提供了基础[19]。细胞凋亡基本分为内质网途径、线粒体途径、死亡受体途径等。
2.1 内质网途径α-MMC通过磷脂肌醇信号途经/丝裂原活化蛋白激酶/cAMP应答元件结合蛋白磷酸化途径(PKC/MAPK/CREB信号途径)来抑制人子宫颈癌(HeLa)细胞的增殖[20],通过下调Notch信号通路来抑制人鼻咽癌细胞(CNE2)细胞增殖[21]。Chao等[22]研究发现,苦瓜果实的水提物能够作用于过氧化物酶体增殖物激活受体(PPAR)信号通路,并可以抑制鼠肝癌细胞系-H4IIEC3。Kobori等[23]证明苦瓜提取物能显著抑制转录因子核转录因子κB(NFκB)的活性,通过信号途径促使DNA活性部位磷酸化,然后诱导肿瘤细胞进行凋亡。总而言之,苦瓜不但可以抑制蛋白激酶AKT信号通路,还能抑制人乳腺癌细胞MCF-7以及其他一些肿瘤细胞的耐药性和转移侵袭能力。p53、NFκB、PI3K/AKT都是信号通路中的关键因子,或许苦瓜的某种有效成分与这些因子存在某种关系,继续探索这些关系可能会是未来的一个新方向。
2.2 线粒体途径沈富林等[15]认为体外培养的不同肿瘤细胞系都用2种苦瓜素作用后,结果显示不管是α-MMC还是β-MMC都能增加含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase 3)和含半胱氨酸的天冬氨酸蛋白水解酶9(Caspase 9)的活性及细胞色素C的释放,诱导细胞凋亡。Xiong等[24]研究表明苦瓜中的MAP30可以抑制蛋白HDAC-1的活性和促进蛋白3和蛋白4的乙酰化,并且可以诱导Akt磷酸化,抑制外因子(Wnt)的活动减少β-链蛋白(β-catenin)的积累;降低c-myc基因和cyclin D1细胞周期调节因子的水平;对细胞瘤、乳腺癌、肝癌、黑色素瘤、骨髓瘤等都有抑制作用,体内最佳剂量为0.5 mg·kg-1,一周注射2次效果明显。Grossmann等[25]研究发现苦瓜中的脂肪酸(A-ESA)能够造成线粒体膜电位的易位,还能阻滞细胞周期;苦瓜种子中有一种核糖体失活蛋白(RIPS)对绒毛癌上皮细胞,卵巢癌细胞等蛋白质合成等都有抑制作用并且诱导K562细胞凋亡;脂肪酸(A-ESA)抑制乳腺癌细胞增殖依赖于氧化机制对于机械应激反应,HSP70的表达和p53的激活与苦瓜有什么联系还有待于进一步研究。
2.3 死亡受体途径Bao等[26]认为众所周知苦瓜可以减肥,却不知苦瓜还可以减轻脂肪组织炎症引起的肥胖。通过降低炎性细胞因子、单核细胞趋化蛋白-1、白介素6和肿瘤坏死因子(tnf-α)的表达。Babish等[27]研究表明苦瓜不但具有很强的抗炎活性,更可以通过抗炎活性刺激肿瘤坏死因子(TNFa),文中以10 ng·mL-1通过与细胞表面的受体结合,达到诱导肿瘤细胞凋亡的作用。至于CD95配体还有待于进一步研究。
2.4 其他途径熊术道等[28]认为苦瓜诱导细胞B淋巴细胞瘤-2(Bcl-2)凋亡的机制是作用28SrRNA中A-4324部位糖苷键的断裂,是蛋白质合成受到抑制,或者是核小体DNA断裂,从而使基因蛋白表达下调。至于能否作用于DNA TOP Ⅰ和TOP Ⅱ,还有待于进一步研究。苦瓜通过PI3K/AKT信号途径诱导肿瘤细胞凋亡的实验目前尚不可知。
3 展望苦瓜中的有效成分有利有弊,如何把有害的成分控制、降低、转变是合理利用苦瓜的关键。如苦瓜中唯一的抗生育作用来源于α-苦瓜籽蛋白和核糖体失活蛋白2种蛋白[31],不管是培育出新品苦瓜使得这2种蛋白不表达,还是将这2种蛋白提取出来用作防虫药,都是未来研究苦瓜不错的选择,唯一不足的是尚未从苦瓜中分离出蛋白酶抑制剂基因。另外,苦瓜素在临床最大的缺陷在于免疫原性强,血浆半衰期短[32]。而聚乙二醇可以增强α-苦瓜素的抗肿瘤活性,降低药物的毒性,这就为药物中有效成分的联用作了一个表率。并且苦瓜素的毒性主要取决于它们会抑制蛋白质的合成,如果克服了苦瓜抑制正常蛋白的合成,比如用一种药物使得苦瓜的抑制作用大大降低,不影响正常蛋白的合成,那么苦瓜则会成为一种特效的抗癌药物。目前,已有纳米技术应用于靶向治疗肿瘤,而正好可以避免苦瓜对其他组织器官的毒性,这不是可以很好地证明苦瓜的药效吗?研究还发现柠檬酸有很好的增效作用,那么是不是其他的酸对苦瓜的效用都有增效呢?还有研究人员发现苦瓜可以调控免疫细胞,激活巨噬细胞,控制癌细胞的增值。可是,苦瓜是如何启动免疫调节的还需要进一步研究。酶活性与酶种类对于抗癌一直是抗癌机制中一重大研究方向,生物系统转化酶的活性和苦瓜究竟存在哪些必然的联系?苦瓜虽然能在食品方面被广泛应用,但是这些食品在加工的过程中难免会对其中的有效成分造成流失,比如苦瓜中的维生素C便不耐高温,在加工的过程中很可能就挥发了,更有甚者许多有效成分通过高温失活。因此,在制作苦瓜食品的时候,一定要考虑周全。如今国内外对苦瓜的研究大部分还处于体外水平,体内机制还需进一步研究。如何筛选苦瓜的有效部位来抗肿瘤以及用什么方法提取,提取部位的很多化合物是一种作用还是几种联合作用都应作进一步研究。最后,苦瓜的吸收部位是否是小肠,吸收是否和浓度呈正比,胃肠道内是否有相应载体又或许依赖某种物质,都需要进一步研究。
| [1] |
RAMAN A, LAU C. Anti-diabetic properties and phytochemistry of Momordica charantia L.(Cucurbitaceae)[J]. Phytomedicine, 1996, 2(4): 349. DOI:10.1016/S0944-7113(96)80080-8 |
| [2] |
汤琴, 邓媛元, 张雁, 等. 苦瓜对肿瘤细胞的抑制作用及其活性成分研究进展[J]. 广东农业科学, 2014, 41(13): 104. TANG Q, DENG YY, ZHANG Y, et al. Research progress on the active composition and mechanism for anti-tumor effects of Momordica charantia L[J]. Guangdong Agric Sci, 2014, 41(13): 104. DOI:10.3969/j.issn.1004-874X.2014.13.023 |
| [3] |
MENSING H, ALBINI A, KRIEG T, et al. Enhanced chemotaxis of tumor-derived and virus-transformed cells to fibronectin and fibroblast-conditioned medium[J]. Int J Cancer, 1984, 33(1): 43. DOI:10.1002/(ISSN)1097-0215 |
| [4] |
ALBINI A, BENELLI R. The chemoinvasion assay:a method to assess tumor and endothelial cell invasion and its modulation[J]. Nat Protoc, 2007, 2(3): 504. DOI:10.1038/nprot.2006.466 |
| [5] |
WANG H, ZHANG H, TANG L, et al. Resveratrol inhibits TGF-β1-induced epithelial to mesenchymal transition and suppresses lung cancer invasion and metastasis[J]. Toxicology, 2013, 303: 139. DOI:10.1016/j.tox.2012.09.017 |
| [6] |
GUPTA GP, MASSAGUÉ J. Cancer metastasis:building a framework[J]. Cell, 2006, 127(4): 679. DOI:10.1016/j.cell.2006.11.001 |
| [7] |
LI F, LIU Y, KAN X, et al. Elevated expression of integrin αv and β5 subunit in laryngeal squamous-cell carcinoma associated with lymphatic metastasis and angiogenesis[J]. Pathol Res Pract, 2013, 209(2): 105. DOI:10.1016/j.prp.2012.11.001 |
| [8] |
SALVO E, GARASA S, DOTOR J, et al. Combined targeting of TGF-beta1 and integrinbeta3 impairs lymph node metastasis in a mouse model of non-small-cell lung cancer[J]. Mol Cancer, 2014, 13: 112. |
| [9] |
张绪忠, 陈青山, 程光文. 苦瓜抗菌作用的研究[J]. 中草药, 1995, 26(10): 556. ZHANG XZ, CHEN QS, CENG GW. Studies on antibacterial functions of Momordica charantia[J]. Chin Tradit Herb Drugs, 1995, 26(10): 556. DOI:10.3321/j.issn:0253-2670.1995.10.003 |
| [10] |
LAW LK, TAM PP, YEUNG HW. Effects of alpha-trichosanthin and alpha-momorcharin on the development of peri-implantation mouse embryos[J]. J Reprod Fertil, 1983, 69(2): 597. DOI:10.1530/jrf.0.0690597 |
| [11] |
KIKUCHI T, ZHANG J, HUANG Y, et al. Glycosidic inhibitors of melanogenesis from leaves of Momordica charantia[J]. Chem Biodivers, 2012, 9(7): 1221. DOI:10.1002/cbdv.v9.7 |
| [12] |
王先远, 蒋与刚. 苦瓜皂甙的抗氧化作用初探[J]. 解放军预防医学杂志, 2001, 19(5): 317. WANG XY, JIANG YG. Study on anti-oxidant effects of Momordica saponin[J]. J Prev Med Chin PLA, 2001, 19(5): 317. |
| [13] |
OKADA Y, OKADA M, SAGESAKA Y. Screening of dried plant seed extracts for adiponectin production activity and tumor necrosis factor-alpha inhibitory activity on 3T3-L1 adipocytes[J]. Plant Foods Hum Nutr, 2010, 65(3): 225. DOI:10.1007/s11130-010-0184-2 |
| [14] |
TSAO SW, NG TB, YEUNG HW. Toxicities of trichosanthin and alpha-momorcharin, abortifacient proteins from Chinese medicinal plants, on cultured tumor cell lines[J]. Toxicon, 1990, 28(1): 1183. |
| [15] |
NG TB, LIU WK, SZE SF, et al. Action of α-momorcharin, a ribosome inactivating protein, on cultured tumor cell lines[J]. Gen Pharmacol, 1994, 25(1): 75. DOI:10.1016/0306-3623(94)90012-4 |
| [16] |
沈富林, 曹东亮, 邓斐, 等. α-苦瓜素体内抗人乳腺癌MCF-7移植瘤实验[J]. 成都医学院学报, 2014, 9(6): 686. SHEN FL, CAO DL, DENG F, et al. The Anti-tumor experiments of alpha-momorcharin on human breast cancer MCF-7 xenograft in vivo[J]. J Chengdu Med Coll, 2014, 9(6): 686. |
| [17] |
DENG NH, WANG L, HE QC, et al. PEGylation alleviates the nonspecific toxicities of alpha-momorcharin and preserves its antitumor efficacy in vivo[J]. Drug Deliv, 2016, 23(1): 95. DOI:10.3109/10717544.2014.905652 |
| [18] |
MATSUI Y, HADA T, MAEDA N, et al. Structure and activity relationship of monogalactosyl diacylglycerols, which selectively inhibited in vitro mammalian replicative DNA polymerase activity and human cancer cell growth[J]. Cancer Lett, 2009, 283(1): 101. DOI:10.1016/j.canlet.2009.03.029 |
| [19] |
SCHULTE-HERMANN R, BURSCH W, GRASL-KRAUPP B, et al. Apoptosis and multistage carcinogenesis in rat liver[J]. Mutat Res, 1995, 333(1-2): 81. DOI:10.1016/0027-5107(95)00134-4 |
| [20] |
WANG P, HUANG S, WANG F, et al. Cyclic AMP-response element regulated cell cycle arrestsin cancer cells[J]. PLoS One, 2013, 8(6). |
| [21] |
LIU F, WANG B, WANG Z, et al. Trichosanthin down-regulates Notch signaling and inhibits proliferation of the nasopharyngeal carcinoma cell line CNE2 in vitro[J]. Fitoterapia, 2012, 83(5): 838. DOI:10.1016/j.fitote.2012.02.011 |
| [22] |
CHAO CY, HUANG CJ. Bitter gourd (Momordica charantia)extract activates peroxisome proliferator-activated receptors and upregulates the expression of the acyl CoA oxidase gene in H4ⅡEC3 hepatoma cells[J]. J Biomed Sci, 2003, 10(6 Pt 2): 782. |
| [23] |
KOBORI M, NAKAYAMA H, FUKUSHIMA K, et al. Bitter gourd suppresses lipopolysaccharide-induced inflammatory responses[J]. J Agric Food Chem, 2008, 56(11): 4004. DOI:10.1021/jf800052y |
| [24] |
XIONG SD, YU K, LIU XH, et al. Ribosome-inactivating proteins isolated from dietary bitter melon induce apoptosis and inhibit histone deacetylase-1 selectively in premalignant and malignant prostate cancer cells[J]. Int J Cancer, 2009, 125(4): 774. DOI:10.1002/ijc.v125:4 |
| [25] |
GROSSMANN ME, MIZUNO NK, DAMMEN ML, et al. Eleostearic acid inhibits breast cancer proliferation by means of an oxidationdependent mechanism[J]. Cancer Prev Res(Phila), 2009, 2(10): 879. DOI:10.1158/1940-6207.CAPR-09-0088 |
| [26] |
BAO B, CHEN YG, ZHANG L, et al. Momordica charantia (Bitter Melon)reduces obesity-associated macrophage and mast cell infiltration as well as inflammatory cytokine expression in adipose tissues[J]. PLoS One, 2013, 8(12): e84075. DOI:10.1371/journal.pone.0084075 |
| [27] |
BABISH JG, PACIORETTY LM, BLAND JS, et al. Antidiabetic screening of commercial botanical products in 3T3-L1 adipocytes and db/db mice[J]. J Med Food, 2010, 13(3): 535. DOI:10.1089/jmf.2009.0110 |
| [28] |
熊术道, 尹丽慧, 李景荣, 等. 苦瓜籽核糖体失活蛋白对肝癌H22细胞的抑制作用及其机制[J]. 山东医药, 2007, 47(17): 21. XIONG SD, YIN LH, LI JR, et al. Inhibitory action and mechanisms of RIP from Momordica charantia seeds on H22 hepatoma[J]. Shandong Med J, 2007, 47(17): 21. |
| [29] |
程霜, 崔庆新, 王勇. 水溶性苦瓜多糖的提取与测定[J]. 郑州粮食学院学报, 2000, 21(2): 53. CHENG S, CUI QX, WANG Y. Extraction and determination of water-soluble polysaccharide of Momordica charantia L[J]. J Zhengzhou Grain Coll, 2000, 21(2): 53. |
| [30] |
张瑜, 崔炯谟, 赵余庆. 苦瓜抗肿瘤研究进展[J]. 中国现代中药, 2009, 11(1): 4. ZHANG Y, CUI JM, ZHAO YQ. Progress on anti-tumorof Momordica charantia L[J]. Mod Chin Med, 2009, 11(1): 4. |
| [31] |
CHAN WY, TAM PP, CHOI HL, et al. Effects of momorcharins on the mouse embryo at the early organogenesis stage[J]. Contraception, 1986, 34(5): 537. DOI:10.1016/0010-7824(86)90062-4 |
| [32] |
BIAN X, SHEN F, CHEN Y, et al. PEGylation of alphamomorcharin:synthesis and characterization of novel anti-tumor conjugates with therapeutic potential[J]. Biotechnol Lett, 2010, 32(7): 883. DOI:10.1007/s10529-010-0242-8 |
 2017, Vol. 37
2017, Vol. 37 
