2. 首都医科大学附属北京朝阳医院麻醉科, 北京 100016
2. The Anesthesia department, Affiliated Beijing Chaoyang Hospital of Capital Medical University, Beijing 100016, China
氯胺酮属苯环己哌啶类麻醉药,临床上采用消旋体给药。氯胺酮是兴奋性氨基酸NMDA受体非竞争性拮抗剂,此受体广泛存在于中枢和外周神经系统中,在痛觉的传递和痛觉的产生中发挥重要作用。随着医学的深入发展和对不良反应的重视,氯胺酮的光学成分之一,右旋氯胺酮(S-氯胺酮)的相关研究和临床使用逐渐广泛[1-3],但国内对针对氯胺酮对映异构体的临床研究仍然是空白。对于中国人使用氯胺酮后对映异构体的人体代谢动力学特别是病人人群的代谢动力学未见报道。
国内曾有文献报道采用HPLC-UV法[4]和毛细管电泳法[5]定量测定血浆中的氯胺酮对映异构体,还有报道采用手性固定相和手性流动相的双向识别法拆分氯胺酮对映异构体[6],但是这些方法在分离度和检测灵敏度等方面不符合临床研究的需要,且对于重要的代谢物去甲基氯胺酮没有进行分析研究。
本研究采用高灵敏度和选择性的串联质谱进行检测,使用硅胶表面共价键合有α1-酸性糖蛋白的手性分离,同时对血浆中氯胺酮和去甲基氯胺酮进行定量分析。经验证,本法适用于氯胺酮临床药代动力学研究,可为国人临床使用氯胺酮提供重要依据。
1 仪器与试药 1.1 仪器岛津公司UFLC prominence高效液相色谱仪-API5500电喷雾串联四极杆质谱仪(AB Sciex公司);Analyst 5.1软件;Diacel Chiralpak AGP色谱柱(100 mm×4mm,5 μm;填料:硅胶表面共价键合α1-酸性糖蛋白),Waters OASIS HLB固相萃取小柱(1 mL,30 mg;填料为二乙烯苯和N-乙烯基吡咯烷酮聚合物);MicroCL 21R高速离心机(Thermo Electron Corporation);Allegra X-22R低速离心机(Beckman Coulter);TARGIN BT-Ⅱ混合器(踏锦科技);Milli-Q纯水机(Millipore号);LIBROR AEG-45S分析天平(岛津)。
1.2 药品与试剂对照品R-氯胺酮对甲基二苯甲酰酒石酸(D-DTTA)盐(批号12060701,纯度99.79%,D-DTTA:对甲基二苯甲酰酒石酸),盐酸右氯胺酮(即S-氯胺酮,批号12100331RS,纯度100%),R-去甲级氯胺酮D-DTTA盐(批号120605,纯度99.85%)和S-去甲基氯胺酮D-DTTA盐(批号120606,纯度99.85%)由江苏恒瑞医药有限公司提供。甲氧苄氨嘧啶(批号031-8501)由中国食品药品检定研究院提供。盐酸氯胺酮注射液,批号12030733,规格2 mL:100 mg,福建古田药业有限公司;盐酸右氯胺酮注射液,批号P02060212030731,规格2 mL:50 mg,江苏恒瑞医药有限公司提供。分析物及内标结构式见图 1。醋酸铵、异丙醇为色谱纯,氨水为LC-MS适用。方法学研究所用健康人空白血浆及空白尿液由健康志愿者提供。

|
图 1 氯胺酮、N-去甲基氯胺酮和甲氧氨苄嘧啶结构式 Figure 1 Structures of ketamine, N-norketamine and trimethoprim |
采用Chiralpak AGP色谱柱(100 mm×4mm,5 μm),以异丙醇-10 mmol·L-1醋酸胺(氨水调pH至7.6~7.7)(6:94,v/v)为流动相,流速0.5 mL·min-1,柱温28 ℃,自动进样器温度4 ℃,进样量l0 μL。
2.2 质谱条件采用电喷雾离子源(electrospray ionization,ESI),正离子电离,多反应监测(multiple reaction monitoring,MRM)的质谱扫描方式进行检测,选择检测离子反应对为m/z 238→m/z 207(R-/S-氯胺酮),m/z 224→m/z 207(R-/S-去甲基氯胺酮),m/z 291→m/z 230(内标甲氧氨苄嘧啶)[7]。喷雾电压(ion spray voltage)5.0 kV;载气(nebulizer gas)80 units;喷雾气(turbo ionspray gas):70 units;气帘气(curtain gas)4 units;碰撞气(collision gas)4 units;离子源温度550 ℃。
2.3 对照品储备液和内标储备液的配制分别精密称取R-氯胺酮D-DTTA盐131.4 mg(相当于R-氯胺酮50 mg),S-氯胺酮D-DTTA盐57.6 mg(相当于S-氯胺酮50 mg),R-去甲基氯胺酮D-DTTA盐136.4 mg和S-去甲基氯胺酮D-DTTA盐136.4 mg(相当于去甲基氯胺酮50 mg),置于各自的50 mL量瓶中,用纯水10 mL溶解,以甲醇定容至刻度,盖塞混匀,即得各分析物质量浓度均为1 mg·mL-1的储备液,4 ℃冰箱保存。精密称取甲氧氨苄嘧啶10 mg于一100 mL量瓶中,以乙腈溶解并定容至刻度,盖塞混匀,即得质量浓度为0.1 mg·mL-1的内标储备液,4 ℃冰箱保存。
2.4 样本预处理采用固相萃取法(SPE)进行样本预处理。固相萃取小柱(Water Oasis HLB)先用甲醇后用纯水各1 mL活化;将冻存管中的血浆样品室温充分溶解,混匀;准确吸取血浆样品200 μL,加入内标溶液(以乙腈稀释内标储备液至300 ng·mL-1,即得)300 μL,涡旋混匀;高速离心(13 000 r·min-1)5 min,取上清液0.3 mL,加水0.9 mL,混合均匀,加入固相萃取小柱中,400~700 r·min-1低速离心2~4 min;在固相萃取小柱中加入初级洗脱液[甲醇-纯水(1:4)]1 mL,400~700 r·min-1低速离心2~4 min;在固相萃取小柱中加入甲醇0.5 mL,400~700 r·min-1低速离心2~4 min,收集最终洗脱液,转移至进样小瓶中。
2.5 药动学研究临床试验经首都医科大学附属北京朝阳医院伦理委员会批准后进行,遵循GCP原则。所有受试者均签署知情同意书,受试者经筛查符合入选标准后入选,采用平行对照方法,筛选48例择期全麻腹腔镜手术的患者,依照实验方案和流程,推注盐酸右氯胺酮0.5 mg·kg-1或盐酸氯胺酮1 mg·kg-1,于给药前、推注给药结束即刻以及推注结束后2、4、6、8、10、20、30 min和1、1.5、2、4、6、8、12、24 h采集血样3 mL,肝素抗凝,3 000 r·min-1离心8 min,分取血浆,-20 ℃保存待测。
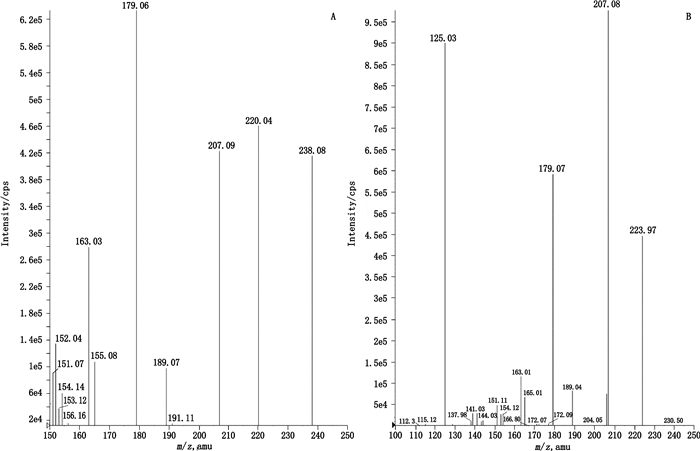
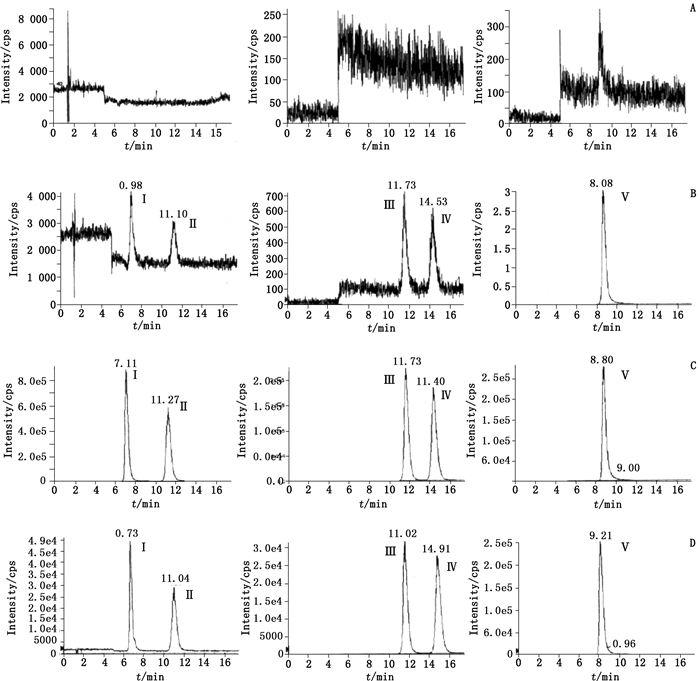
3 结果 3.1 特异性氯胺酮和代谢物去甲基氯胺酮的质谱图见图 2。在本试验所采用的色谱条件下,R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮、S-N-去甲基氯胺酮和甲氧氨苄嘧啶(内标)保留时间分别为14.5、11.7、11.2、7.1和8.7 min,血浆中的内源性物质不干扰测定(图 3)。
|
图 2 氯胺酮(A)和N-去甲基氯胺酮(B)二级碎片全扫描质谱图 Figure 2 Full scan production spectra of the secondary fragments of ketamine(A) and N-norketamine |
|
A.空白血浆样本(plasma blank)B.LLOQ血浆样本(LLOQ plasma sample)C.ULOQ血浆样本(ULOQ plasma sample)D.受试者静脉推注氯胺酮后血浆样本(sample from a volunteer 8 min after administrated with ketamine injection) Ⅰ.R-氯胺酮(R-ketamine)Ⅱ.S-氯胺酮(S-ketamine)Ⅲ.R-N-去甲基氯胺酮(R-N-norketamine)Ⅳ.S-N-去甲基氯胺酮(S-N-norketamine)Ⅴ.甲氧氨苄嘧啶(内标)[trimethoprim(IS)] 图 3 液相色谱质谱法测定血浆中R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮的色谱图 Figure 3 Chromatograms of R-ketamine, S-ketamine, R-N-norketamine and S-N-norketamine in plasma by LC-MS/MS |
移取氯胺酮各对映异构体储备液10 mL和去甲基氯胺酮各对映异构体储备液5 mL至100 mL量瓶中,用纯水稀释并定容至刻度,获得氯胺酮及去甲基氯胺酮混合稀释液(氯胺酮对映异构体100 μg·mL-1,去甲基氯胺酮对映异构体50 μg·mL-1)。用空白血浆梯度稀释氯胺酮及去甲基氯胺酮混合稀释液制备标准曲线血浆,分别对应R-氯胺酮和S-氯胺酮血浆药物质量浓度0、5、10、50、100、500、1 000和2 000 ng·mL-1,R-N-去甲基氯胺酮和S-N-去甲基氯胺酮血浆药物质量浓度0、2.5、5、25、50、250、500和1 000 ng·mL-1。按照“2.4”项下方法操作,依法测定,分别以待测物R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮的质量浓度为横坐标,以待测物与内标物的峰面积比值为纵坐标,用加权最小二乘法进行线性回归。测定血浆中R-氯胺酮和S-氯胺酮浓度的线性范围均为5~2 000 ng·mL-1,最低定量浓度为5 ng·mL-1,R-N-去甲基氯胺酮和S-N-去甲基氯胺酮浓度的线性范围均为2.5~1 000 ng·mL-1,最低定量浓度为2.5 ng·mL-1。R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮典型的标准曲线线性方程:
Y=4.13×10-4X-2.39×10-4 r=0.997 9
Y=4.15×10-4X-1.70×10-5 r=0.998 1
Y=2.31×10-3X-8.40×10-5 r=0.998 9
Y=2.56×10-3X-5.15×10-4 r=0.997 8
3.3 准确度及精密度按照“3.2”项下方法制备低、中、高(R-氯胺酮和S-氯胺酮质量浓度为10、100和1 000 ng·mL-1,R-N-去甲基氯胺酮、S-N-去甲基氯胺酮质量浓度为5、50、500 ng·mL-1)3个浓度的质控样品(QC样品)各5份,连续测定3 d,并做随行标准曲线,计算QC样品的测得浓度,与配制浓度对照,求得本法的精密度与准确度,以RSD和相对误差(RE)表示。结果见表 1。本法的精密度与准确度符合目前生物分析方法指导原则的要求。
|
|
表 1 血浆中氯胺酮对映异构体和N-去甲基对映异构体的回收率、基质效应、准确度、精密度和稀释效应(n=5) Table 1 Recovery, matrix effect, accuracy, precision and dilution effect of R-/S-ketamine and R-/S-N-norketamine in plasma |
取5份来源于不同受试者的空白血浆,分别按照R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮酸的样品预处理方法进行处理,比较空白血浆经样品处理后加入待测物和内标的峰面积(R-氯胺酮、S-氯胺酮酸质量浓度为10和1 000 ng·mL-1,R-N-去甲基氯胺酮、S-N-去甲基氯胺酮质量浓度为5和500 ng·mL-1)与直接进样相同浓度对照品溶液的待测物和内标的峰面积比值。结果表明,测定R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮、S-N-去甲基氯胺酮时,血浆基质质谱信号基本无影响,对内标基本无影响,不同受试者血浆样品的质谱信号响应无显著性差异,结果见表 1。
3.5 稀释效应按照“3.2”项下方法配制浓度超出线性范围的血浆样本(R-/S-氯胺酮5 μg·mL-1和10 μg·mL-1,R-/S-N-去甲基氯胺酮2.5 μg·mL-1和5 μg·mL-1)各5份,分别用空白血浆按比例稀释后,按照“2.4”项下方法操作,以测得结果乘以稀释倍数计算样本浓度。结果表明,含R-/S-氯胺酮和R-/S-N-去甲基氯胺酮血浆样本经空白血浆稀释4倍或6倍,测定结果准确度良好,结果见表 1。
3.6 回收率取含R-/S-氯胺酮(浓度为10、100和1 000 ng·mL-1)、R-/S-N-去甲基氯胺酮(浓度为5,50和500 ng·mL-1)的质控样品,每浓度5个样本,比较血浆样品经处理后加入内标的待测物与内标的峰面积比值与空白血浆经处理后直接加入待测物和内标的峰面积比值,求得本法回收率,结果见表 1。
3.7 稳定性考察按照“3.2”项下方法制备低、中、高(R-氯胺酮和S-氯胺酮质量浓度为10、100和1 000 ng·mL-1,R-N-去甲基氯胺酮、S-N-去甲基氯胺酮质量浓度为5、50和500 ng·mL-1)3个浓度的QC样品若干,分别于4 ℃放置24 h,室温放置14 h,样品预处理后室温放置24 h,反复冻融3次,-20 ℃冷冻保存50 d,与新鲜配制的标准曲线同时处理和测定,考察血浆样本在不同条件下的稳定性。结果表明,血浆样本中的分析物R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮酸血浆样品在所考察的试验条件下稳定,满足试验要求,结果见表 2。
|
|
表 2 R-氯胺酮、S-氯胺酮、R-N-去甲基氯胺酮和S-N-去甲基氯胺酮稳定性研究结果(ng·mL-1) Table 2 Stability of R-ketamine, S-ketamine, R-N-norketamine and S-N-norketamine |
氯胺酮组(完成21例)单次静脉注射消旋体氯胺酮后,血浆中氯胺酮对映异构体和N-去甲基氯胺酮对映异构体平均浓度-时间曲线见图 4。R-氯胺酮半衰期(4.06±1.75)h,S-氯胺酮半衰期(3.33±2.23)h;R-氯胺酮停药后即刻浓度C0为(3 427±2 866)ng·mL-1,S-氯胺酮停药后即刻浓度C0为(3 331±2 797)ng·mL-1;R-氯胺酮24 h曲线下面积AUC0~24 h为(407±91)h·ng·mL-1;S-氯胺酮24 h曲线下面积AUC0~24 h为(361±87)h·ng·mL-1。R-N-去甲基氯胺酮半衰期(8.63±2.57)h,S-N-去甲基氯胺酮半衰期(8.73±2.93)h;R-N-去甲基氯胺酮达峰浓度Cmax为(100±22)ng·mL-1,S-N-去甲基氯胺酮达峰浓度Cmax为(91±20)ng·mL-1,R-N-去甲基氯胺酮24 h曲线下面积AUC0~24 h为(557±211)h·ng·mL-1,S-N-去甲基氯胺酮24 h曲线下面积AUC0~24 h为(515±167)h·ng·mL-1。

|
图 4 受试者静脉注射氯胺酮(1 mg·kg-1)后氯胺酮对映异构体和N-去甲基氯胺酮对映异构体的平均血药浓度-时间曲线(n=21) Figure 4 Mean plasma concentration-time profiles of ketamine enantiomers and N-norketamine enantiomers after ketamine injection(1 mg·kg-1) in 21 subjects |
患者于术中注射氯胺酮后,体内氯胺酮及其代谢产物对映异构体的浓度较低,采用串联质谱法检测相对于紫外检测法在检测专属性和灵敏度上有强大的优势,但同时受限于质谱对于溶剂系统的苛刻要求,可使用的手性拆分条件有限。本实验采用α1-酸性糖蛋白固定相手性柱拆分,在中性或者偏碱性的流动相条件下,分离度良好,而在酸性条件下无法拆分。考虑到手性柱的使用寿命和稳定性,最终调节pH至7.6,本实验方法开发验证和样本测试量大于1 000,全部于同一根手性柱上完成。异丙酮作为有机改性剂有利于拆分,甲醇和乙腈几乎没有改善分离度的效果,但由于异丙醇的粘度大,对柱压影响较大,比例不宜过高。柱温对对映异构体的拆分没有显著影响,适当升高柱温可以降低样本运行时间。由于进样的溶剂是纯甲醇,和流动相组成差别较大,进样量不宜过大,进样量大于20 μL时,可以看到色谱峰形明显变差。本法对映体拆分良好,灵敏度高,专属性好,回收率高,无基质效应影响,方法学验证表明符合生物样品分析方法指导原则要求,并且能够满足氯胺酮人体药代动力学研究要求。
| [1] |
Stessel B, Ovink JK, Theunissen HM, et al. Is S-ketamine with or without magnesium sulphate an alternative for postoperative pain treatment? Randomised study[J]. Eur J Anaesthesiol, 2013, 30(2): 91. DOI:10.1097/EJA.0b013e32835aa558 |
| [2] |
Jud R, Picek S, Makara MA, et al. Comparison of racemic ketamine and S-ketamine as agents for the induction of anaesthesia in goats[J]. Vet Anaesth Analg, 2010, 37(6): 511. DOI:10.1111/j.1467-2995.2010.00570.x |
| [3] |
杨永明, 马伟根. 右氯胺酮在小儿临床麻醉中的应用[J]. 医学综述, 2008, 14(7): 1084. YANG YM, MA WG. Application of S(+)-ketamine in pediatric anesthesia[J]. Med Recapit, 2008, 14(7): 1084. |
| [4] |
单丽娜, 施宪宝, 郭斌, 等. 高效液相色谱法测定血浆中氯胺酮对映体的浓度[J]. 中国药房, 2010, 21(8): 1670. SHAN LN, SHI XB, GUO B, et al. Detemination of ketamine enantiomers in plasma by HPLC[J]. China Pharm, 2010, 21(8): 1670. |
| [5] |
程庆春, 李学仁, 胡汉芳, 等. 高效毛细管电泳研究氯胺酮对映体血药浓度测定方法[J]. 中国药学杂志, 1999, 34(3): 189. CHENG QC, LI XR, HU HF, et al. Study on the determination of ketamine enantiomers in plasma by high-performance capillary electrophoresis[J]. Chin Pharm J, 1999, 34(3): 189. |
| [6] |
李乃瑄, 肖如亭. HPLC双相识别拆分氯胺酮对映异构体[J]. 药物分析杂志, 2005, 25(11): 1339. LI NX, XIAO RT. Resolution of ketamine enantiomers by HPLC with two-phases discrimination[J]. Chin J Pharm Anal, 2005, 25(11): 1339. |
| [7] |
余建新, 胡小钟, 林雁飞, 等. 尿样及动物组织中甲氧苄氨嘧啶残留量的高效液相色谱-串联质谱测定法[J]. 分析测试学报, 2005, 24(3): 107. YU JX, HU XZ, LIN YF, et al. High performance liquid chromatography-tandem mass spectrometry determination of trimethoprim in urine and animal tissue[J]. J Instrum Anal, 2005, 24(3): 107. |
 2017, Vol. 37
2017, Vol. 37 