壳寡糖是以壳聚糖为原料,经酶法降解成具有一定聚合度和一定结构的系列低聚合度寡糖。壳聚糖具有广泛的生物学作用,特别是具有提高机体免疫功能,抗肿瘤,抗感染等作用[1-3],有文献报道抗肿瘤效果最好的是低聚合度寡糖,特别是壳寡糖[4-5]。目前壳寡糖产品质量控制的关键是聚合度分析,从而获得高活性壳寡糖[6]。壳寡糖的分析有采用薄层色谱法,但该方法准确度不好;还有高效液相色谱法[7]、毛细管电泳法[8-9]、分光光度法[10]及费时的衍生荧光法。离子色谱积分脉冲安培检测法是报道的检测糖类最好的方法[11],但此方法需要使用标准物质进行验证,壳寡糖的标准物质不但价格昂贵,且供应商极少因而较难购全,这给壳寡糖的聚合度的验证带来很大的困难。
根据气相色谱保留值规律可知,同系物的调整保留时间或保留因子(k′)的对数与碳数的n值存在线性关系,即lnk′=A1n+B1,式中A1为碳数规律常数,
文章建立壳寡糖的保留因子与聚合度的关系,利用该相关关系对未知的壳寡糖进行定性,并用质谱进行验证,结论是可靠的。可克服目前壳寡糖利用薄层色谱法、高效液相色谱法、气相色谱法等需要使用标准物质进行验证的困难。也可利用该保留因子规律进行定性并指导实际生产,是非常有意义的工作。
1 材料与方法 1.1 仪器和试剂戴安ICS5000离子色谱仪,配电化学检测器;分析柱系统:DIONEX CarboPac® PA10(4.0 mm×250 mm),其填料为苯乙烯与二乙烯基苯单体共聚而合成的高分子聚合物骨架团聚季胺盐离子;保护柱:DIONEX CarboPac® PA10(4.0 mm×50 mm),填料与分析柱相同。氢氧化钠、无水乙酸钠(纯度 > 99%)为优级纯,壳二糖、壳三糖、壳四糖、壳五糖、壳六糖标准物质(大连中科格莱克生物科技有限公司,含量90%~98%不等)。实验用水为超纯水由Milli-Q纯水仪纯化(电阻率18.2 MΩ·cm)。壳寡糖试样,浙江省金壳生物科技有限公司提供。
1.2 溶液制备分别称取壳二糖、壳三糖、壳四糖、壳五糖、壳六糖的标准物质各10.00 mg,用超纯水分别溶解于10 mL量瓶中定容,配成质量浓度为1.00 g·L-1的标准储备液;将储备液分别用超纯水稀释至10 mg·L-1,即得壳寡糖标准混合液;称取壳寡糖样品1.0 g,用超纯水溶解后定容至10 mL,用0.45 μm水性滤膜过滤,滤液作为储备液备用,使用时用超纯水稀释至10 mg·L-1。
1.3 色谱条件色谱柱系统:DIONEX CarboPac® PA10保护柱(4.0 mm×50 mm)+DIONEX CarboPac® PA10分析柱(4.0 mm×250 mm)。淋洗液1:32.5 mmol·L-1氢氧化钠溶液-超纯水(30:70),等度洗脱;淋洗液2:32.5 mmol·L-1氢氧化钠溶液-超纯水(20:80),等度洗脱;淋洗液3:32.5 mmol·L-1氢氧化钠溶液-超纯水(40:60),等度洗脱。流速:0.40 mL·min-1;色谱柱温度:35 ℃;检测池温度30 ℃;进样量25 μL;ED40A电化学检测器配Au工作电极及Ag-AgCl参比电极,积分脉冲安培法检测。
2 实验结果与讨论 2.1 壳寡糖的分离和保留因子的计算直链壳寡糖是一类均一性寡糖,一般由2~10个氨基葡萄糖单体通过1,4-糖苷键缩合而成,离子色谱的检测中发现,壳寡糖洗脱规律与一般寡糖不一致。一般寡糖在离子色谱上的洗脱规律大多是从低聚糖到高聚糖,但壳寡糖由于氨基的存在,从而使它从高聚糖到低聚糖进行洗脱[9]。
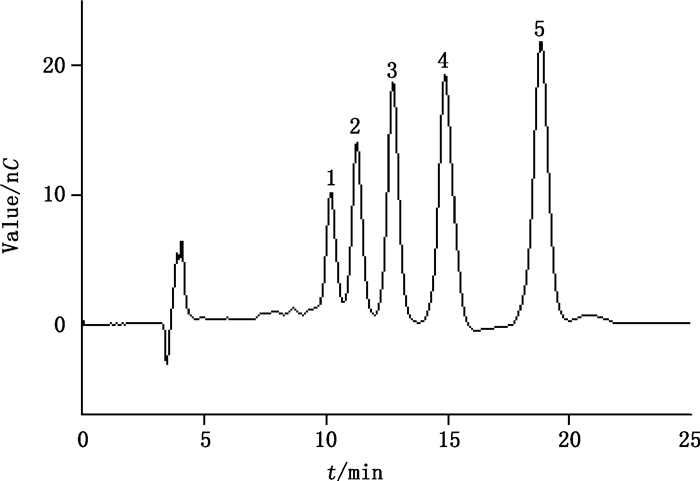
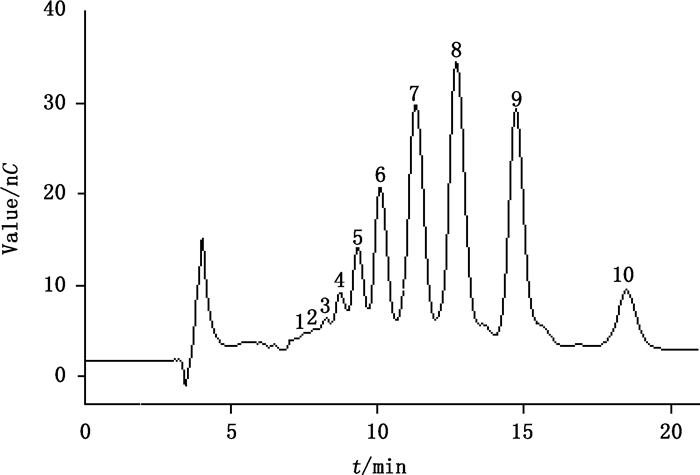
分别取各壳寡糖质量浓度均为10 mg·L-1的标准混合液及质量浓度为10 mg·L-1的壳寡糖样品溶液,进样分析,用淋洗液1进行淋洗,得到如图 1及图 2的色谱图。其中,图 1所示1-5号峰分别为壳六糖、壳五糖、壳四糖、壳三糖和壳二糖标准物质所对应的色谱峰;图 2所示6-10号峰已使用标准物质进行定性确证,分别为壳六糖、壳五糖、壳四糖、壳三糖和壳二糖。计算保留指数时以图 2数据为基准计算各相关参数,图 2中6-10号峰的相关参数见表 1。
|
1.壳六糖(chitohexaose)2.壳五糖(chitopentaose)3.壳四糖(chitotetraose)4.壳三糖(chitotriose)5.壳二糖(chitobiose) 图 1 用淋洗液1淋洗的5种壳寡糖标准物质色谱图 Figure 1 Chromatogram of 5 kinds of chitosan oligosaccharide standard solution using elution 1 |
|
1.未知峰(unknown peak)2.未知峰(unknown peak)3.未知峰(unknown peak)4.未知峰(unknown peak)5.未知峰(unknown peak)6.壳六糖(chitohexaose)7.壳五糖(chitopentaose)8.壳四糖(chitotetraose)9.壳三糖(chitotriose)10.壳二糖(chitobiose) 图 2 用淋洗液1淋洗的壳寡糖样品色谱图 Figure 2 Chromatogram of chitosan oligosaccharide sample using elution 1 |
|
|
表 1 淋洗液1淋洗后计算的壳寡糖样品聚合度(DP)与保留因子(k′)数据 Table 1 Data calculation of degree of polymerization(DP)and retention factor(k′)for chitosan oligosaccharide sample using elution 1 |
通过对壳寡糖聚合度DP与保留因子k′相关关系进行回归,发现聚合度与保留因子对数logk′具有指数相关关系,根据此关系对壳寡糖产品的未知峰组成进行判断,再根据回归方程计算出壳寡糖聚合度。为了使壳寡糖定性公式推导过程的简单明了,公式推导过程采用线性方程计算,即分别由壳寡糖聚合度的对数值(log DP)与对应壳寡糖的logk′建立回归方程进行推导计算。计算过程如表 2,先由表 1的数据建立由聚合度为2~6的壳寡糖样品(图 2中6~10号峰)的log DP与logk′相关关系,再将图 2中5号未知峰(经推算为壳七糖)的logk′值数据代入上述方程,计算其“log DP”值,并由此“log DP”值计算其“DP”值及误差值。完成对该未知峰的定性后,再以该未知峰为最低聚合度,顺序向下再取5个聚合度的壳寡糖数据(本例中为5~9聚合度)建立新的回归方程,按以上方法对下一个未知峰(本例为图 2中4号未知峰)进行定性计算,直至完成所有未知峰的定性,这样可减少定性的误差。
|
|
表 2 用淋洗液1淋洗计算的壳寡糖样品聚合度(DP)与误差 Table 2 Calculation of degree of polymerization(DP)and deviation for chitosan oligosaccharide sample with elution 1 |
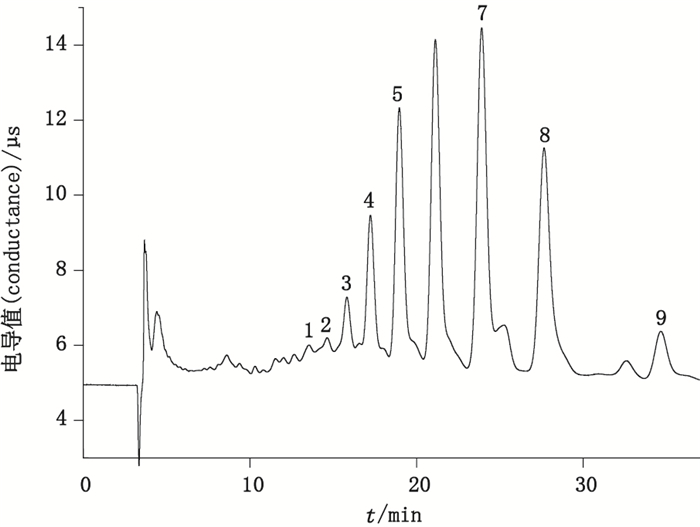
改用淋洗液2对壳寡糖标准混合液及壳寡糖样品液进行等度洗脱,由于淋洗液中氢氧化钠浓度降低,样品分离出9个峰,图谱见图 3。分离后的各项参数见表 3和表 4。从表 3和表 4可知,改变淋洗条件对规律没有影响。
|
1.未知峰(unknown peak)2.未知峰(unknown peak)3.未知峰(unknown peak)4.未知峰(unknown peak)5.壳六糖(chitohexaose)6.壳五糖(chitopentaose)7.壳四糖(chitotetraose)8.壳三糖(chitotriose)9.壳二糖(chitobiose) 图 3 用淋洗液2淋洗的壳寡糖样品色谱图 Figure 3 Chromatogram of chitosan oligosaccharide sample using elution 2 |
|
|
表 3 用淋洗液2淋洗计算的壳寡糖样品聚合度(DP)与保留因子(k′) Table 3 Data calculation of degree of polymerization(DP)and retention factor(k′)for chitosan oligosaccharide sample using elution 2 |
|
|
表 4 用淋洗液2淋洗计算的壳寡糖样品聚合度(DP)及其误差 Table 4 Calculation of degree of polymerization(DP)and deviation for chitosan oligosaccharide sample using elution 2 |
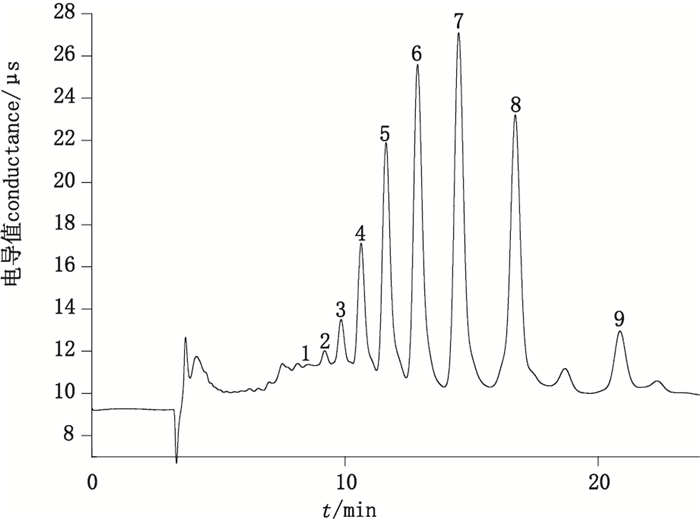
改用淋洗液3对壳寡糖标准混合液及壳寡糖样品液进行等度洗脱,由于淋洗液中氢氧化钠浓度增加,样品分离出9个峰,图谱见图 4。分离后的各项参数见表 5和表 6。从表 5和表 6可知,改变淋洗条件对规律没有影响。
|
1.未知峰(unknown peak)2.未知峰(unknown peak)3.未知峰(unknown peak)4.未知峰(unknown peak)5.壳六糖(chitohexaose)6.壳五糖(chitopentaose)7.壳四糖(chitotetraose)8.壳三糖(chitotriose)9.壳二糖(chitobiose) 图 4 用淋洗液3淋洗的壳寡糖样品色谱图 Figure 4 Chromatogram of chitosan oligosaccharide sample using elution 3 |
|
|
表 5 用淋洗液3淋洗计算壳寡糖样品聚合度(DP)与保留因子(k′)数据 Table 5 Data calculation of degree of polymerization(DP)and retention factor(k′) for chitosan oligosaccharide sample using elution 3 |
|
|
表 6 用淋洗液3淋洗计算的聚合度确定及其误差 Table 6 Calculation of degree of polymerization(DP)and deviation for chitosan oligosaccharide sample using elution 3 |
将色谱柱温度改为30 ℃,用淋洗液1淋洗,流速0.4 mL·min-1,对壳寡糖标准混合液及壳寡糖样品液进行等度洗脱,分离后的各项参数见表 7和表 8。从表 7和表 8可知,改变柱温对规律没有影响。
|
|
表 7 柱温为30 ℃壳寡糖样品聚合度(DP)与保留因子(k′)数据计算 Table 7 Data calculation of degree of polymerization(DP)and retention factor(k′)for chitosan oligosaccharide sample with 30 ℃ column temperature |
|
|
表 8 聚合度确定及其误差计算 Table 8 Calculation of degree of polymerization(DP)and deviation for chitosan oligosaccharide sample with 30 ℃ column temperature |
淋洗液1,柱温为35 ℃,将流速改为0.6 mL·min-1对壳寡糖标准混合液及壳寡糖样品溶液进行等度洗脱,分离后的各项参数见表 9和表 10,改变流速对规律也没有影响。
|
|
表 9 流速为0.6 mL·min-1壳寡糖样品聚合度(DP)与保留因子(k′)数据计算 Table 9 Data calculation of degree of polymerization(DP)and retention factor(k′) for chitosan oligosaccharide sample with 0.6 mL·min-1 flow rate |
|
|
表 10 流速为0.6 mL·min-1壳寡糖样品聚合度(DP)确定及其误差计算 Table 10 Calculation of degree of polymerization(DP)and deviation for chitosan oligosaccharide sample with 0.6 mL·min-1 flow rate |
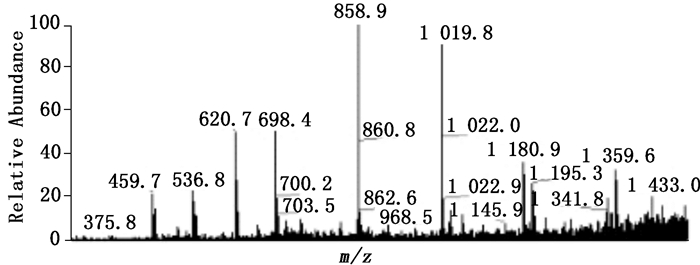
为进一步验证该规律的可靠性,对上述样品进行质谱数据的验证。实验采用Thermo-Finnigan离子阱电喷雾质谱仪,采用正离子模式,扫描范围为m/z 200~1 500,喷雾电压-4.5 kV,壳气为氮气,辅助气体为氦气,离子传输管温度为250 ℃,电压为+55 V;样品配成10 μg·L-1的溶液,以300 μL·h-1引进离子源室。结果见图 5。
|
图 5 壳寡糖样品的质谱图 Figure 5 Mass spectrum of chitosan oligosaccharide sample |
如图 5所示,壳二糖、壳三糖、壳四糖、壳五糖、壳六糖、壳七糖、壳八糖的相对分子质量分别是340、501、662、823、984、1 145、1 306,其氯离子加合物[M+Cl]-的相对分子质量分别是375、536、697、858、1 019、1 180、1 341,其他以此类推。图中相对分子质量出现大约0.5的偏差可能与分析所用的三维离子阱质谱有关。
经比对认为,图 5中459和620的质量数应为杂质,从质谱可看出样品中存在壳二糖、壳三糖、壳四糖、壳五糖、壳六糖、壳七糖,从色谱图可明显看出存在10种糖,分别是壳二糖、壳三糖、壳四糖、壳五糖、壳六糖、壳七糖、壳八糖、壳九糖。聚合度大于8的寡糖含量相对较少。由以上结果可知,本法结果与质谱数据能够较好地吻合。
3 结论本文建立了低聚壳寡糖的聚合度与它们的保留因子关系,即:保留因子的对数与聚合度的对数具有线性关系(logk′=a log DP+b),且相关关系都在0.999以上。根据建立的关系对壳寡糖样品进行聚合度的定性,误差不大于5.66%。可见该法只需少数几种标准物质即可完成对系列化合物定性,可广泛应用于食品安全、生物医药等产业中壳寡糖产品的质量评价,也可应用于生产优质寡糖过程控制。
| [1] |
KIM SK, RAJAPAKS EN. Enzymatic production and biological activities of chitosan oligosaccharides(COS):a review[J]. Carbohydr Res, 2005, 62(4): 357. DOI:10.1016/j.carbpol.2005.08.012 |
| [2] |
NAM KS, CHOR YR, SHON YH. Evaluation of the antimutagenic potential of chitosan oligosaccharide:Rec, Ames and Umu tests[J]. Biotechnol Lett, 2001, 23(12): 971. DOI:10.1023/A:1010519224254 |
| [3] |
NO HK, PARK NY, LEE SH, et al. Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J]. Int J Food Microbiol, 2002, 74(1-2): 65. DOI:10.1016/S0168-1605(01)00717-6 |
| [4] |
SUZUKI K, MIKAMI T, OKAWA Y, et al. Antitumor effect of hexa-N-acetylchitohexaose and chitohexaose[J]. Carbohydr Res, 1986, 151: 403. DOI:10.1016/S0008-6215(00)90359-8 |
| [5] |
TOKORO A, TATEWAKI N, SUZUKI K, et al. Growth-inhibitory effect of hexa-N-acetylchitohexaose and chitohexaose against meth-A solid tumor[J]. Chem Pharm Bull, 1988, 36(2): 784. DOI:10.1248/cpb.36.784 |
| [6] |
JEON YJ, KIM SK. Bioactivities of chitosan oligosaccharides and their derivatives[J]. Adv Chitin Sci, 1998, 3(3): 28. |
| [7] |
KROKEIDE IM, SYNSTAD B, GASEIDNES S, et al. Natural substrate assay for chitinases using high-performance liquid chromatography:a comparison with existing assays[J]. Anal Biochem, 2007, 363: 128. DOI:10.1016/j.ab.2006.12.044 |
| [8] |
EL RASSI Z. Recent developments in capillary electrophoresis and capillary electrochromatography of carbohydrate species[J]. Electrophoresis, 1999, 20(15-16): 3134. DOI:10.1002/(ISSN)1522-2683 |
| [9] |
LEE KB, KIM YS, LINHARDT RJ. Capillary zone electrophoresis for the quantitation of oligosaccharides formed through the action of chitinase[J]. Electrophoresis, 1991, 12(9): 636. DOI:10.1002/(ISSN)1522-2683 |
| [10] |
陈伶俐, 宗莉, 庞瑞. 分光光度计测定壳聚糖含量[J]. 药物分析杂志, 2005, 25(5): 526. CHEN LL, ZONG L, PANG R. Determination of chitosan content by spectrophotometer[J]. Chin J Pharm Anal, 2005, 25(5): 526. |
| [11] |
牟世芬, 于泓, 蔡亚岐. 糖的高效阴离子交换色谱-脉冲安培检测法分析[J]. 色谱, 2009, 27(5): 667. MOU SF, YU H, CAI YQ. Analysis of sugar by high performance anion exchange chromatography with pulsed ampere detection[J]. Chin J Chromatogr, 2009, 27(5): 667. |
| [12] |
KOVATS E. Gas-chromatographische charakterisierung organischer verbindungen.teil 1:retentionsindices aliphatischer halogenide, alkohole, aldehyde und ketone[J]. Helv Chim Acta, 1958, 41(7): 1915. DOI:10.1002/hlca.19580410703 |
| [13] |
许国旺. 现代实用气相色谱法[M]. 北京: 化学工业出版社, 2004. XU GW. Modern Practical Gas Chromatography[M]. Beijing: Chemical Industry Press, 2004. |
| [14] |
BERTHOD A, CHANG SC, KULLMAN JP, et al. Practice and mechanism of HPLC oligosaccharide separation with a cyclodextrin bonded phase[J]. Talanta, 1998, 47(4): 1001. DOI:10.1016/S0039-9140(98)00179-9 |
| [15] |
LI K, LIU S, XING R. High-resolution separation of homogeneous chitooligomers series from 2-mers to 7-mers by ion-exchange chromatography[J]. J Sep Sci, 2013, 36(7): 1275. DOI:10.1002/jssc.201200935 |
 2017, Vol. 37
2017, Vol. 37 