2. 中国农业科学院特产研究所, 长春 130112;
3. 吉林农业大学中药材学院, 长春 130118
2. Institute of Special Wild Economic Animals and Plants, Chinese Academy of Agricultural Sciences, Changchun 130112, China;
3. College of Chinese Medicine Materials, Jilin Agricultural University, Changchun 130118, China
传统中药人参(Ginseng Radix et Rhizoma)系五加科人参属植物人参(Panax ginseng C. A. Mey.)的干燥根和根茎,历版中国药典[1]均已收载,且驰名世界。由于其在世界范围内的食品添加剂中的广泛使用和中国政府批准栽培人参为新功能性食品,人参的应用量激增。人参具有广泛的药理学活性和临床应用[2-3],已从人参根和根茎[4-8]及其炮制品红参[6, 9-10]应用色谱方法分离、谱学数据鉴定了130余个皂苷类成分,人参皂苷(ginsenoside,略写为G)几乎反映了人参的全部生物学活性[2-3]。因此,人参皂苷已作为评价人参质量的重要指标性成分[1],人参质量的评价已从感官向物质基础分析迈进,更加科学化[11]。
我国东北是人参的栽培基地,为保证人参的质量,一些基地已通过国家人参规范化种植基地认证和推广,但种植户众多,各地小气候各异且有些因素难以人工控制,导致产品质量不一致,如人参总皂苷的含量高低和各类型人参皂苷的比例是否一致等等。人参皂苷,按苷元结构类型不同[6],分为原人参二醇型人参皂苷(G),如G-Ra1、Ra2、Rb1、Rb2、Rb3、Rc和Rd;原人参三醇型人参皂苷,如G-Re、Rf、Rg1,20-O-葡萄糖基人参皂苷Rf(20-GG-Rf)、三七人参皂苷(NG)-R1和R2等;齐墩果酸型人参皂苷,如G-Ro等,生物学活性不尽相同[2-3]。为制定科学合理的人参皂苷标准,在产地收集了96批次人参根和根茎样品,分析其人参皂苷含量。关于人参皂苷含量的测定方法,文献报道有较早建立的双光束薄层色谱扫描法[12]、高效液相色谱偶联紫外检测器(HPLC-UV)[13]或偶联蒸发光散射检测器(HPLC-ELSD)法[14-15]、液质联用法(LC-MS)[16-17]等,尽管有报道建立了LC-MS法测定人参根和根茎中19个人参皂苷含量[8],但不菲的仪器成本使其在基层单位难于推广;虽然双光束薄层色谱扫描法简单,但属于半定量分析方法;ELSD虽然是一款通用型检测器,但是其较低的灵敏度和非线性的响应特性限制了其在定量分析领域的应用。Wang等[7]应用HPLC-偶联二极管阵列检测器(DAD)定量分析66批次不同产地人参根和根茎中14个人参皂苷的含量,方法有利于推广普及。本文继续报道其他30批次不同产地人参根和根茎中14个人参皂苷的含量。
1 仪器、试药与试验材料Agilent 1260系列高效液相色谱仪(Agilent Te-chnologies),配置G1311C四元梯度泵、G1329B自动进样器、G1316A柱温箱、G1315D光电二极管阵列检测器(DAD),Agilent Chemstation色谱工作站(version B.04.02);Diamonsil® ODS C18(2)色谱柱(250 mm×4.6 mm,5 μm;北京迪马欧泰科技发展中心);KQ5200超声波清洗仪(昆山市超声仪器有限公司;功率250 W,频率40 kHz);Milli-Q Advantage A10(Millipore)纯水机;Mettler XS105DU十万分之一电子天平。
对照品G-Ra1、Ra2、Rb1、Rb2、Rb3、Rc、Rd、Re、Rf、Rg1、Ro,20-GG-Rf,NG-R1、R2由本文课题组从人参根和根茎[4]中分离制备,HPLC-DAD法测定纯度均大于99.0%。甲醇、乙腈为色谱纯,磷酸为优级纯,水为超纯水,其余试剂为分析纯。
本研究所用的30批次人参根和根茎药材样品于2012年9月采集于各人参栽培地,经本文作者之一王英平研究员鉴定为人参Panax ginseng C. A. Mey.的干燥根和根茎,凭证标本存放在北京大学天然药物及仿生药物国家重点实验室,详细信息见表 1。
|
|
表 1 人参根和根茎样品采集地 Table 1 Collecting locations of ginseng root and rhizome samples |
采用Diamonsil® ODS C18(2)色谱柱(250 mm × 4.6 mm,5 μm),偶联Dikma Easy Guard C18保护柱(20 mm × 4.6 mm,5 μm)。分离G-Ra1、Ra2、Rb1、Rb2、Rb3、Rc、Rd、Rf、Ro,20-GG-Rf,NG-R1、R2的流动相A为乙腈,流动相B为乙腈-水-0.1%磷酸水溶液(5:90:8;v/v/v),线性梯度洗脱(0~20 min,10%A;20~30 min,10%→20%A;30~40 min,20%→22%A;40~75 min,22%→31%A;75~80 min,31%→33%A;80~90 min,33%→40%A;90~110 min,40%→50%A)。流速为0~32 min,0.8 mL·min-1;32.1~110 min,0.5 mL·min-1。检测波长为203 nm,柱温为35℃。分离G-Re、Rg1的流动相A为乙腈,流动相B为水,线性梯度洗脱(0~30 min,20%A;30~45 min,20%→30%A),流速为1.0 mL·min-1,检测波长为203 nm,柱温为25 ℃。色谱图见图 1。
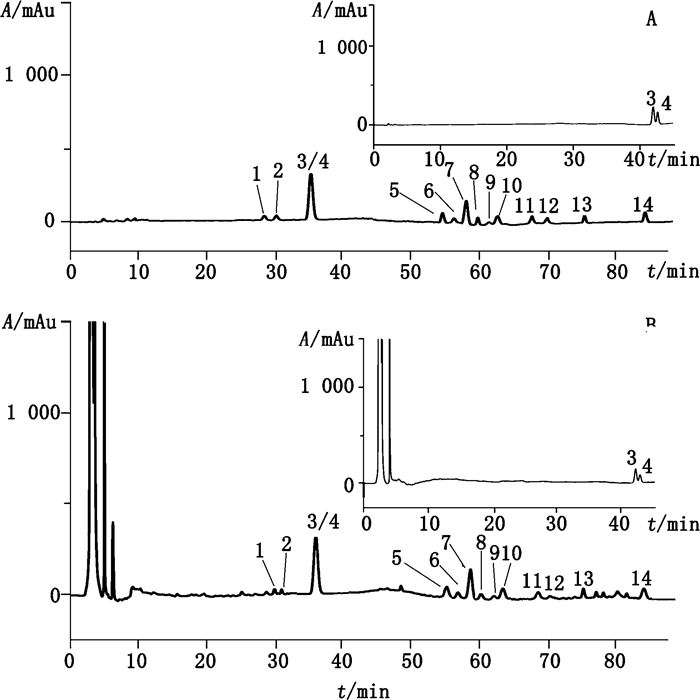
|
1. 20-GG-Rf 2. NG-R1 3. G-Rg1 4. G-Re 5. G-Rf 6. G-Ra2 7. G-Rb1 8. NG-R2 9. G-Ra1 10. G-Rc 11. G-Rb2 12:G-Rb3 13. G-Ro 14. G-Rd 图 1 人参皂苷对照品(A)和人参根和根茎样品(B)的HPLC-DAD色谱图 Figure 1 The HPLC-DAD chromatographic profiles of ginsenoside reference standards (A) and ginseng root and rhizome samples (B) |
精密称取上述14个人参皂苷适量,溶于甲醇配制成对照品储备液。由于所测定的人参皂苷分为2个色谱条件,因此将14个人参皂苷分为2组混标。第1组混标对照品储备液每1 mL含各人参皂苷质量分别为:G-Ra1,9 000 μg;G-Ra2,6 000 μg;G-Rb1,40 000 μg;G-Rb2,20 000 μg;G-Rb3,6 000 μg;G-Rc,20 000 μg;G-Rd,24 000 μg;G-Rf,12 000 μg;G-Ro,24 000 μg;20-GG-Rf,3 000 μg;NG-R1,3 000 μg;NG-R2,3 000 μg;第2组混标对照品储备液每1 mL含各人参皂苷质量数分别为:G-Re,15 000 μg;G-Rg1,20 000 μg。由储备液用甲醇逐一稀释,得到6个不同浓度的对照品溶液,G-Ra1为720、360、180、90、45、22.5 μg·mL-1,G-Ra2为480、240、120、60、30、15 μg·mL-1,G-Rb1为3 200、1 600、800、400、200、100 μg·mL-1,G-Rb2为1 600、800、400、200、100、50 μg·mL-1,G-Rb3为480、240、120、60、30、15 μg·mL-1,G-Rc为1 600、800、400、200、100、50 μg·mL-1,G-Rd为1 920、960、480、240、120、60 μg·mL-1,G-Rf为960、480、240、120、60、30 μg·mL-1,G-Ro为1 920、960、480、240、60、7.5 μg·mL-1,20-GG-Rf为240、120、60、30、15、7.5 μg·mL-1,NG-R1为240、120、60、30、15、7.5 μg·mL-1,NG-R2为240、120、60、30、15、7.5 μg·mL-1,G-Re为1 200、600、300、150、75、37.5 μg·mL-1,G-Rg1为1 600、800、400、200、100、50 μg·mL-1。所有储备液和对照品溶液分析前在4 ℃下保存。
2.2.2 供试品溶液精密称取过40目筛的人参根和根茎药材粉末1.00 g,置于具塞磨口量瓶中,精密加入70%甲醇水溶液20 mL,25 ℃超声(功率250 W,频率40 kHz)提取30 min,过滤,再重复提取2次,合并滤液,减压回收溶剂,得到的干膏用70%甲醇水溶液溶解并定容至5 mL。过0.45 μm微孔滤膜,取续滤液作为供试品溶液[7]。
2.3 方法学验证本研究建立的分析方法经方法学验证,包括特异性、线性关系考察、仪器的精密度、重复性试验、稳定性试验、加样回收率试验、检测下限和定量下限等[7],符合定量分析要求。14个人参皂苷的标准曲线在各自线性浓度范围内的相关系数为0.999 4~0.999 9;日内和日间精密度分别为0.16%~1.31%和0.22%~1.24%;重复性试验峰面积的RSD为0.44%~2.22%;稳定性试验中,样品溶液分别在制备后0、4、8、16、32、48 h按HPLC法测定,峰面积的RSD为0.13%~1.95%;加样回收率为95.93%~103.93%,RSD为0.11%~2.64%;检测下限为0.66~8.82 μg,定量下限为2.21~29.39 μg。
2.4 样品含量测定按“2.2.2”项方法制备30批次样品的供试品溶液,各进样10 μL,按“2.1”项色谱方法和条件测定,记录各分析物的色谱峰面积,以外标法计算含量,结果见表 2。
|
|
表 2 不同产地人参根和根茎样品(S1~S30)中人参皂苷的含量(μg·g-1,n=3) Table 2 Determination results of ginsenoside content of ginseng root and rhizome(S1-S30) from different regions (μg·g-1, n=3) |
人参皂苷的含量测定,较早开发的是双光束薄层色谱扫描法[12],由于属于半定量的分析方法,已趋于淘汰。随后相继开发出HPLC-UV[13]、HPLC-ELSD[14-15]等方法,但存在灵敏度低等问题,晚近开发出HPLC-DAD[7, 18]方法,灵敏度和准确度大大提高,测定的相对成本较低,有利于在基层单位推广应用。尽管LC-MS法在人参皂苷含量测定上的应用逐渐增多[8, 16-17],但仪器价格不菲,测定成本大大增高,难以在基层单位推广应用。因此,本文选择了HPLC-DAD法测定30个产地的人参根和根茎中14个人参皂苷的含量。由于人参皂苷分子结构中没有生色团,只能在末端吸收203 nm处测定。
3.2 色谱柱的选择文献报道的方法中使用的色谱柱各异,本研究应用人参皂苷对照品考察了Diamonsil® ODS C18(2)(250 mm×4.6 mm,5 μm)、Varian MicrosorbTM-MV C8(250 mm×4.6,5 μm)和Symmetry® ODS C18(250 mm×4.6 mm,5 μm)3种色谱柱的分离能力。通过比较三者的色谱图,发现用Varian MicrosorbTM-MV C8色谱柱,图 1中的色谱峰6和8、9和10没有分开,11和13未达到基线分离;用Symmetry® ODS C18色谱柱,图 1中的色谱峰9和10、12和13均未分开;而用Diamonsil色谱柱对分析目标物分离效果最好。因此最终确定使用Diamonsil为人参皂苷含量测定用色谱柱。
3.3 流动相的选择本研究考察了不同配比的乙腈-水、甲醇-水以及含有甲酸、乙酸、磷酸等含酸溶液作为流动相对人参皂苷的分离能力,并结合相关文献中人参皂苷分析方法的报道,最终确定乙腈和乙腈-水-0.1%磷酸水溶液(5:90:8;v/v/v)作为流动相,梯度洗脱。但发现图 1中的色谱峰3(G-Rg1)和4(G-Re)尚不能分离,为分离这2个人参皂苷,又建立洗脱条件,流动相A为乙腈,流动相B为水,梯度洗脱(0~30 min,20%A;30~45 min,20%A→30%A),流速为1.0 mL·min-1,柱温为25 ℃,G-Rg1和G-Re的分离度达到了定量分析要求。
3.4 含量测定成分的选择Wang等[8]采用UPLC-DAD-QTOF-MS/MS法在人参根和根茎中鉴定出至少130余个人参皂苷类成分,结合柱色谱法对人参根和根茎[4-5]及其炮制品红参[10]中人参皂苷类成分的分离鉴定结果,推断人参根和根茎中的主要人参皂苷类成分不足20个,大部分为微量成分。同时考虑文献报道原人参二醇型皂苷G-Ra1、Ra2、Rb1、Rb2、Rb3、Rc、Rd可能在人参加工为红参或口服人参在人肠内细菌的作用下产生生物活性更强的G-Rg3、Rg5、Rh2,人参皂苷C-K[3, 19]等;G-Re、Rf、Rg1,20-GG-Rf,NG-R1、R2为人参特征性成分原人参三醇型皂苷的代表,且G-Re可能在人参加工为红参或口服人参在人肠内细菌的作用下产生生物活性更强、具有良好药代动力学性质的G-Rg2[3, 19-21],G-Re、Rf、Rg1,20-GG-Rf,NG-R1、R2可能转化为生物活性更强的G-Rh1[3, 19];G-Ro为人参中齐墩果酸型皂苷的代表,且对神经内分泌细胞缺氧、氧化损伤具有保护作用[22]。因此,选择了上述14个人参皂苷作为含量测定成分。
3.5 定量分析结果讨论Wang等[7]等报道了不同产地66个批次人参根和根茎中上述14个人参皂苷的含量,并总结了它们的含量范围(μg·g-1,人参根和根茎),G-Ra1,112~5 326;G-Ra2,65~2 656;G-Rb1,888~7 723;G-Rb2,275~8 247;G-Rb3,303~1 609;G-Rc,529~6 122;G-Rd,387~4 338;G-Re,539~4 815;G-Rf,289~1 577;G-Rg1,870~6 095;G-Ro,667~6 959;20-GG-Rf,108~739;NG-R1,26~943;NG-R2,25~699[7]。本文报道另外不同产地30个批次人参根和根茎中上述14个人参皂苷的含量。由表 2结果,五年生人参根和根茎样品S1~S26上述14个人参皂苷的含量范围(μg·g-1,人参根和根茎),G-Ra1,0~2 958;G-Ra2,0~1 320;G-Rb1,1 195~7 129;G-Rb2,835~6 993;G-Rb3,178~1 812;G-Rc,414~5 569;G-Rd,393~5 529;G-Re,603~3 564;G-Rf,301~1 504;G-Rg1,738~4 710;G-Ro,893~8 569;20-GG-Rf,110~656;NG-R1,74~778;NG-R2,0~844。在这些样品中,大部分样品G-Ra1和Ra2的含量以及样品S4、S14、S19的NG-R2含量在检测线以下;NG-R1的含量亦偏低。因此,建议这4个人参皂苷不纳入人参根和根茎中人参皂苷的质量评价中。同时亦发现它们含量的变异幅度较大,与前文[7]报道结果的趋势基本一致。四年生人参根和根茎样品S27~S30的人参皂苷含量范围(μg·g-1,人参根和根茎),G-Rb1,1 614~4 457;G-Rb2,1 566~3 988;G-Rb3,461~652;G-Rc,1 524~3 260;G-Rd,387~2 040;G-Re,1 490~3 062;G-Rf,500~960;G-Rg1,1 817~2 767;G-Ro,1 388~2 366;20-GG-Rf,223~389;NG-R1,34~463;NG-R2,35~541。S27和S28为国产人参样品,G-Ra1和G-Ra2的含量在定量限以下,但在韩国锦山郡产人参样品S29和S30中可定量分析出这2个人参皂苷。同时,亦发现它们含量的变异幅度较大。总的趋势是国产比韩国产人参样品的人参皂苷含量高。无论是中国产人参还是韩国产人参,物种皆为P. ginseng,未见发生遗传变异的报道,因此,栽培环境条件和规范化栽培技术方法是影响人参皂苷含量的主要因素。本文结果为人参中人参皂苷含量测定标记物的选择、制定人参皂苷的含量范围、进一步完善“人参规范化种植技术指南”[23]提供了科学依据。
| [1] |
中国药典2015年版. 一部[S]. 2015: 8 ChP 2015.Vol Ⅰ [S].2015:8 |
| [2] |
杨秀伟, 富力. 人参中三萜类化学成分的生物学活性和药理学作用[J]. 中国现代中药, 2016, 18(1): 36. YANG XW, FU L. Biological and pharmacological activities of triterpenoids from of Panax ginseng[J]. Mod Chin Med, 2016, 18(1): 36. |
| [3] |
杨秀伟. 人参化学成分的药物代谢动力学研究[J]. 中国现代中药, 2016, 18(1): 16. YANG XW. Pharmacokinetic studies of chemical constituents of ginseng[J]. Mod Chin Med, 2016, 18(1): 16. |
| [4] |
王洪平, 杨鑫宝, 杨秀伟, 等. 吉林人参根和根茎的化学成分研究[J]. 中国中药杂志, 2013, 38(17): 2807. WANG HP, YANG XB, YANG XW, et al. Chemical constituents from roots and rhizomes of Panax ginseng cultivated in Jilin province[J]. China J Chin Mater Med, 2013, 38(17): 2807. |
| [5] |
WANG HP, YANG XB, YANG XW, et al. Ginsenjilinol, a new protopanaxatriol type saponin with inhibitory activity on LPS-activated NO production in macrophage RAW 264.7 cells from the roots and rhizomes of Panax ginseng[J]. J Asian Nat Prod Res, 2013, 15(5): 579. DOI:10.1080/10286020.2013.787992 |
| [6] |
杨秀伟. 人参中三萜类化学成分的研究[J]. 中国现代中药, 2016, 18(1): 7. YANG XW. Triterpenoids in Panax ginseng[J]. Mod Chin Med, 2016, 18(1): 7. |
| [7] |
WANG HP, ZHANG YB, YANG XW, et al. High-performance liquid chromatography with diode array detector and electrospray ionization ion trap time-of-flight tandem mass spectrometry to evaluate ginseng roots and rhizomes from different regions[J]. Molecules, 2016, 21(5): 603. DOI:10.3390/molecules21050603 |
| [8] |
WANG HP, ZHANG YB, YANG XW, et al. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS[J]. J Ginseng Res, 2016, 40(4): 382. DOI:10.1016/j.jgr.2015.12.001 |
| [9] |
ZHOU QL, YANG XW. Four new ginsenosides from red ginseng with inhibitory activity on melanogenesis in melanoma cells[J]. Bioorg Med Chem Lett, 2015, 25: 3112. DOI:10.1016/j.bmcl.2015.06.017 |
| [10] |
周琪乐, 徐嵬, 杨秀伟. 中国红参化学成分研究[J]. 中国中药杂志, 2016, 41(2): 233. ZHOU QL, XU W, YANG XW. Chemical constituents of Chinese red ginseng[J]. China J Chin Mater Med, 2016, 41(2): 233. |
| [11] |
杨秀伟. 中药物质基础研究是中药继承、发展、创新的关键科学问题[J]. 中国中药杂志, 2015, 40(17): 3429. YANG XW. Substance basis research on Chinese materia medica is one of key scientific problems of inheriting, development and innovation of Chinese materia medica[J]. China J Chin Mater Med, 2015, 40(17): 3429. |
| [12] |
CORTHOUT J, NAESSENS T, APERS S, et al. Quantitative determination of ginsenosides from Panax ginseng roots and ginseng preparations by thin layer chromatography-densitometry[J]. J Pharm Biomed Anal, 1999, 21(1): 187. DOI:10.1016/S0731-7085(99)00109-0 |
| [13] |
SHI W, WANG YT, LI J, et al. Investigation of ginsenosides in different parts and ages of Panax ginseng[J]. Food Chem, 2007, 102(3): 664. DOI:10.1016/j.foodchem.2006.05.053 |
| [14] |
SUN BS, GU LJ, FANG ZM, et al. Simultaneous quantification of 19 ginsenosides in black ginseng developed from Panax ginseng by HPLC-ELSD[J]. J Pharm Biomed Anal, 2009, 50(1): 15. DOI:10.1016/j.jpba.2009.03.025 |
| [15] |
LEE DY, CHO JG, LEE MK, et al. Discrimination of Panax ginseng roots cultivated in different areas in Korea using HPLC-ELSD and principal component analysis[J]. J Ginseng Res, 2011, 35(1): 31. DOI:10.5142/jgr.2011.35.1.031 |
| [16] |
JI QC, HARKEY MR, HENDERSON GL, et al. Quantitative determination of ginsenosides by high-performance liquid chromatography-tandem mass spectrometry[J]. Phytochem Anal, 2001, 12(5): 320. DOI:10.1002/(ISSN)1099-1565 |
| [17] |
XIE YY, LUO D, CHENG YJ, et al. Steaming induced chemical transformations and holistic quality assessment of red ginseng derived from Panax ginseng by means of HPLC-ESI-MS/MSn based multicomponent quantification fingerprint[J]. J Agric Food Chem, 2012, 60(33): 8213. DOI:10.1021/jf301116x |
| [18] |
张高菊, 沈勇, 孟珍贵, 等. HPLC法测定姜状三七5种皂苷含量[J]. 药物分析杂志, 2016, 36(3): 500. ZHANG GJ, SHEN Y, MENG ZG, et al. Determination of 5 saponins in Panax zingiberensis by HPLC[J]. Chin J Pharm Anal, 2016, 36(3): 500. |
| [19] |
杨鑫宝, 杨秀伟, 刘建勋. 人参中皂苷类化学成分的研究[J]. 中国现代中药, 2013, 15(5): 349. YANG XB, YANG XW, LIU JX. Study on ginsenoside in the roots and rhizomes of Panax ginseng[J]. Mod Chin Med, 2013, 15(5): 349. |
| [20] |
GUI FJ, YANG XW, LI LY, et al. Simultaneous enantiomer determination of 20(R)-and 20(S)-ginsenoside-Rg2 in rat plasma after intravenous administration using HPLC method[J]. J Chromatogr B, 2007, 850(1-2): 1. DOI:10.1016/j.jchromb.2006.11.008 |
| [21] |
杨秀伟, 桂方晋, 田建明, 等. 人参皂苷-Rg2在大鼠体内的药代动力学[J]. 中国药理学通报, 2009, 25(7): 967. YANG XW, GUI FJ, TIAN JM, et al. Pharmacokinetics of ginsenoside-Rg2 in rats[J]. Chin Pharmacol Bull, 2009, 25(7): 967. |
| [22] |
JIANG Z, WANG YH, ZHANG XY, et al. Protective effect of ginsenoside Ro on anoxic and oxidative[J]. Biomol Ther, 2012, 20(6): 544. DOI:10.4062/biomolther.2012.20.6.544 |
| [23] |
么厉, 程恵珍, 杨智. 中药材规范化种植(养殖)技术指南[M]. 北京: 中国农业出版社, 2006, 293. YAO L, CHENG HZ, YANG Z. Guidelines for Good Agricultural Practice of Chinese Crude Drugs[M]. Beijing: China Agriculture Press, 2006, 293. |
 2017, Vol. 37
2017, Vol. 37 