敞开式离子化质谱(ambient mass spectrometry,AMS),又名常压敞开式质谱、直接离子化质谱、原位直接电离质谱,是一类以大气压电离技术为基础,无需或仅需简单样品前处理,常温常压下即可对样品中复杂待测物直接分析的质谱技术[1]。相对于电子轰击电离等传统离子源,该离子源具有大气压电离源类的软电离特性,离子化效率高,准分子离子峰丰度高,碎片离子少;而同电喷雾电离等大气压电离源相比,该离子源又具有耐基质干扰,溶剂损耗少,高灵敏度等突出优点。
对于该技术的报道最初来自于2004年普渡大学Cooks课题组[2]。该课题组利用解吸电喷雾电离技术(desorption electrospray ionization,DESI),无需前处理即在常压下对固体表面痕量待测物直接离子化,成功获得了不同表面痕量物质的质谱图,拉开了AMS研究的序幕。该理念一经提出的即得到广泛关注并迅速发展,目前已出现多达40余种AMS技术,如萃取电喷雾电离(extractive electrospray ionization,EESI)[3]、探针电喷雾电离(probe electrospray ionization,PESI)[4]、纸喷雾电离(paper spray ionization,PSI)[5]、实时直接分析(direct analysis in real time,DART)[6]、大气压固态分析探针(atmospheric pressure solid analysis probe,ASAP)[7]、解吸大气压化学电离(desorption atmospheric pressure chemical ionization,DAPCI)[8]及低温等离子体(low-temperature plasma,LTP)[9]。目前,已有多篇综述报道了AMS的原理、特点、分类、发展历史及其在食品安全、环境监测、刑侦诊断、生物医药等领域的应用[1, 10-15]。
体内药物分析是指通过对生物样品(生物体液、器官或组织)中药物及其代谢产物或内源性生物活性物质的定量分析,评价药物体内吸收代谢过程、药效机制以及临床使用的安全性和有效性。其分析的生物样品具有种类繁多,采样量少,待测物浓度低,内源性物质干扰强等特点。目前,液质联用技术以其高分离度、高灵敏度优势成为体内药物分析的主流方法。但该技术仍存在前处理方法烦琐,样本易受污染,代谢物易在前处理及分析过程中转化降解,分析成本高等缺陷。AMS的出现,彻底改变了液质联用技术需对样品进行复杂预处理与色谱分离过程后再引入封闭体系分析的理念,可直接采集样本分析,具有原位、实时、非破坏、高通量与低损耗等优点。
本综述旨在介绍目前与体内药物分析联系最为紧密的AMS技术及其在相关生物样本分析中的应用,并展望该技术的应用前景。
1 敞开式离子化质谱目前已有多种解吸附技术与大气压电离技术相结合,形成了各具特色的AMS。对此,研究者们尝试了多种分类方法[12]:(1)按解吸附与离子化发生的先后顺序;(2)按所使用的辅助技术,比如基于喷雾和固液萃取的离子化技术、基于等离子体的离子化技术与基于热、激光或声波等物理解吸消融的离子化技术等;(3)按热解吸、激光解吸与动力解吸等多种解吸机理;(4)按分析物的激发过程。不同分类各有特点,但也存在技术间界限交叉的问题。比如热解吸与动力解吸机理几乎存在于所有敞开式离子化质谱,若仅根据解吸机理分类,则易出现技术交叉。为了便于介绍与体内药物分析联系最为紧密的离子化技术,本综述根据基本离子化方法大致将整个AMS技术分为基于电喷雾电离(ESI)、大气压化学电离(APCI)原理的两大种类:电喷雾电离机理包含了“溶剂蒸发”和“库仑爆炸”等离子形成过程,代表性离子源有DESI、EESI、PESI、PSI等;大气压化学电离机理包含了“质子转移”和“电子转移”等分子离子反应过程,代表性离子源有DART、DAPCI、ASAP、LTP等。
1.1 基于电喷雾电离机理的技术 1.1.1 DESI自Cooks课题组研发出解吸电喷雾离子源以来,该技术已成为目前研究和应用最为广泛的AMS技术之一。其典型装置由传统ESI装置与承载样品表面两部分组成,其中喷雾毛细管被移出质谱真空进样接口以留出空间放置样品,并且毛细管、承载样品表面与质谱进样孔三者呈彼此相距数毫米的V字结构。如图 1,通过在电喷雾毛细管喷嘴上施加一定高电压,喷雾溶剂(如甲醇,水等)从雾化器的内套管流出,并被外套管中喷出的高压氮气迅速雾化形成平均粒径约为3 μm,速度约为150 m·s-1的带电液滴[2]。这些负载了能量和电荷的初级液滴以一定角度(≤10°)轰击样本表面并覆盖成膜,液滴中的溶剂立即萃取溶解基质中的待测物;同时,后续液滴的不断涌入使得表面溅射出更细小的次级带电液滴(chemical sputtering),并由氮气吹扫干燥去溶剂化与电荷残留库仑裂解分析物,最终产生气态带电分析物离子[16]。在分析过程中,样品可不断移动空间位置,3D调节架与移动台可调节雾化器和样品表面的相对位置从而优化喷雾毛细管、样品表面与质谱真空进样接口三者之间的夹角,甚至可以用移动传输带或样品盘替代表面组件,从而保证高离子化效率与高通量分析[17]。DESI既可以分析小分子,又可以分析大分子,通常被分析物均为极性分子,得到的是带单电荷或多电荷的离子峰。
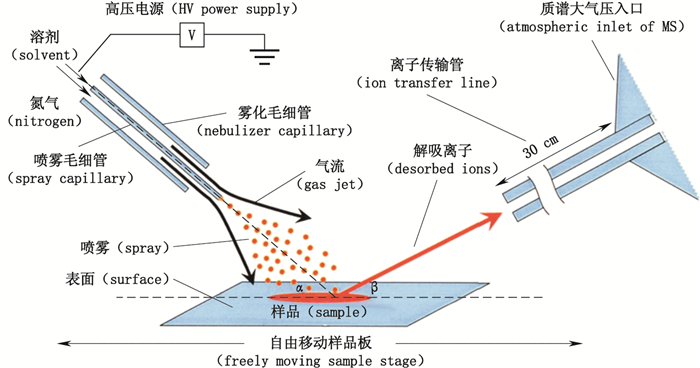
|
图 1 DESI示意图 Figure 1 A schematic diagram of DESI technique[2] |
纳升解吸电喷雾电离(nanospray desorption elec-trospray ionization,Nano-DESI)是对DESI的进一步优化。它用两根呈一定角度的毛细管组成的探针替代DESI喷雾管,此外在毛细管末端及质谱入口加载了约6 kV高压(如图 2)。当喷雾溶剂从一根毛细管喷向另一根时,会在两根之间形成“液体桥”,该液体桥与样本表面接触后可携带微萃取的带电药物液滴进入质谱进样孔。由于更多纳米级液滴涌入质谱,Nano-DESI的离子化效率更高,分析灵敏度也更好[18]。
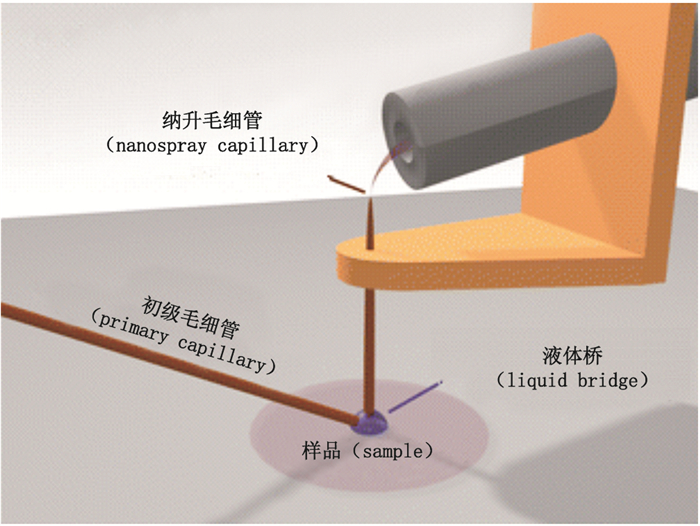
|
图 2 nano-DESI示意图 Figure 2 A schematic diagram of nano-DESI technique [18] |
EESI作为DESI的延伸,其装置主要由电喷雾通道和中性样品通道两部分以一定角度交叉组成(如图 3)。在大气压环境下,EESI一般通过电喷雾酸性甲醇水溶液制备带电液滴。带电液滴与从样品通道产生的样品液滴在空间进行碰撞融合,发生液液萃取和电荷转移作用,继而发生去溶剂作用,从而获得待测物离子供后续质谱分析。带电液滴与中性待测物的接触时间和有效空间较长,使得EESI具有较高的灵敏度和稳定性[3]。与其他技术不同,在EESI中,样品的主体与电场或带电粒子等隔离,不受有机溶剂如甲醇等干扰,因而是一种比ESI更加温和的软电离技术,能在质谱分析时最大限度地保证样品不受试剂与操作条件影响,同时更能耐受基质引起的离子抑制效应,特别有利于进行生物样品、动植物活体质谱分析,尤其是在活体代谢组学等方面具有极佳应用潜力[19]。
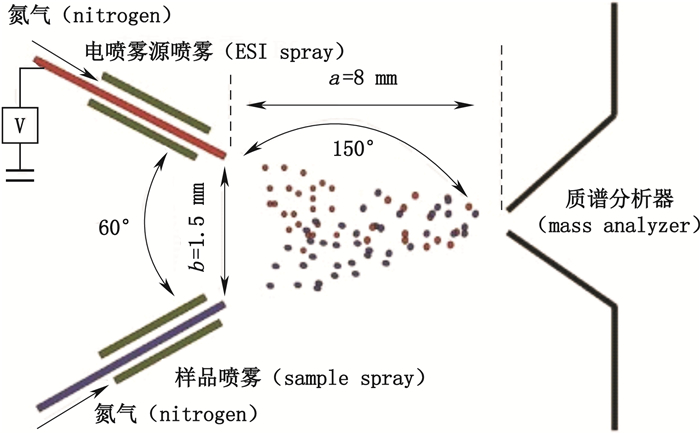
|
图 3 EESI示意图 Figure 3 A schematic diagram of EESI technique[20] |
PESI通常使用尖端直径低于1 μm的一次性针灸针或金属丝作为导电探针(如图 4)。电动马达驱动可上下垂直移动的探针先下降接触样品,可使样品表面或内部的物质粘附在探头上,从而完成采样;随后探针上升至尖端离质谱进样孔约2~5 mm位置并加载约3 kV高电压,从而在其尖端产生的电喷雾可进入质量分析器[4]。样品取样量取决于探针尺寸、穿刺深度、样本粘度与表面张力以及探针表面的疏水性。例如,对于普遍使用的直径为700 nm、尖角为60°的一次性不锈钢针灸针,当插入大鼠尿样液面下10 μm时取样量约为0.35 pL[14]。PESI比传统的ESI源更能耐受去污剂等杂质与生物基质中的盐类干扰,活体取样后无明显创口,动物仍可继续存活,但分析对象只能是溶液或者“湿的”固体样本。

|
图 4 PESI示意图 Figure 4 A schematic diagram of PESI technique[4] |
采用固相载体(如层析纸、牙签、刀片等)可有效避免传统毛细管电喷雾离子源发生的阻塞问题并提高取样便捷性。其中,PSI是由Wang等人于2010年研究出的用于分析复杂混合物中待测物的新型敞开式离子化技术[5]。如图 5,只需将样本(≤10 μL)滴加于预先用少量溶剂(如甲醇溶液)润湿的三角形层析纸或其他多孔材料上并使纸尖端对准质谱入口。仅需在纸尖端对侧加载3~5 kV电压,尖端产生的高电场即可促使带有分析物离子的带电微滴产生。层析纸特有的毛细作用与电泳过程促使待测物从基质中解吸附并向尖端迁移,而尖端泰勒锥的形成说明PSI气相中离子形成机理类似于ESI过程[21]。因此,纸张特性影响着分析物从基质中释放,在层析纸中扩散与最后的离子化等一系列过程。有研究表明,当纸尖角为30~45°时,可在相对低电压的条件下获得更强的喷雾流;甚至当使用附有碳纳米管的纸张时,仅3 V低压即可快速电离分析物[14, 22]。
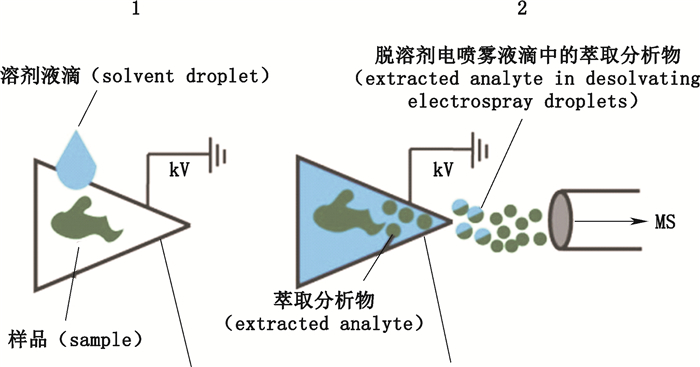
|
图 5 PSI示意图 Figure 5 A schematic diagram of PSI technique[23] |
DART技术的研究对象是相对分子质量小于1 000的小分子药物。如图 6,其装置由载气、离子发生器、加热管以及温控部分等组成,使用He或N2作为工作气,通过在放电室内部的阴极和阳极之间施加一个高达5 kV电压导致高压辉光放电,使工作气电离成含离子、电子和长寿命电子激发态原子的等离子体气流。该气流流经穿孔电极选择性移除离子成分后被加热至500 ℃,仅激发态气流喷出至样品表面,完成热辅助的解吸附过程。尖端包裹的绝缘帽可有效保护样本不受电场伤害[6]。在正离子模式下,该激发态氦原子电离环境中的水分子,形成水合离子[(H2O)n+H]+;在负离子模式下,该激发态氦原子电离空气中的氧分子,形成超氧离子[O2]-。该水合离子或超氧离子作为反应离子与脱附至气相中的化合物分子发生质子交换,最终产生加减一个质子的分子离子峰。离子化机理目前认为包含彭宁离子化(Penning ionization)、质子转移以及电荷交换等过程[24]。DART离子化时不需溶剂辅助,几乎无离子抑制现象发生,也无金属加合离子产生。另外,由于DART离子化发生于气相,在负离子操作模式下,困扰ESI的溶液pH调节将不复存在。通常在LC-MS中不够灵敏的负离子模式,在DART质谱方法中却非常出色[25]。

|
图 6 DART示意图 Figure 6 A schematic diagram of DART technique[26] |
ASAP与DAPCI均是对传统APCI离子源的简单改进,因而具有比DESI和DART更广泛的适用性,一般用于分析相对分子质量低于1 000的中等极性化合物[15]。
ASAP只需将熔融硼酸石英毛细管插入封闭APCI腔室内即可。如图 7,置于毛细管尖端的挥发性/半挥发性分析物先被来自雾化器加热至400~500 ℃的氮气解吸附气化,随后被加载6 kV电压的电晕放电针电离进入真空管[7]。
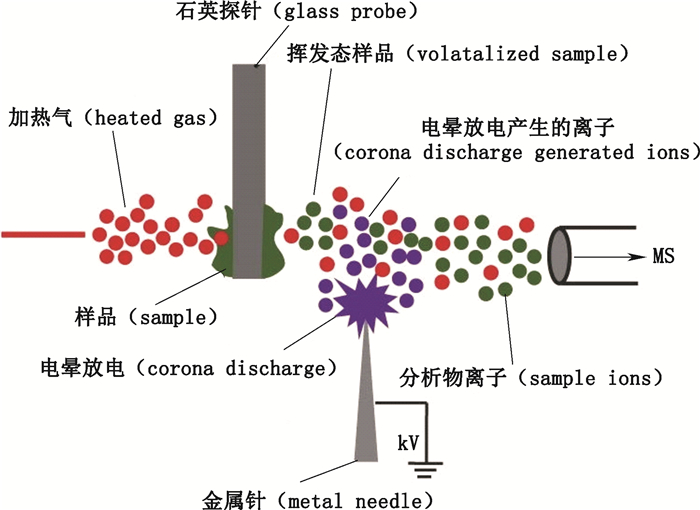
|
图 7 ASAP示意图 Figure 7 A schematic diagram of ASAP technique[23] |
DAPCI采用常压电晕放电为基本手段,在无有机溶剂和高速雾化气流的条件下工作时,利用空气中的水生成初级离子进行工作,该离子被电场加速后溅射到样本表面,直接与裸露固体表面的待测物发生电荷传递作用,完成分析物的离子化过程(如图 8)。对于同基质牢固结合的分析物,需要利用溶剂电晕放电获得高密度带电液滴,该液滴通过在固体表面溶解分析物并受热气化,完成药物离子化[8]。
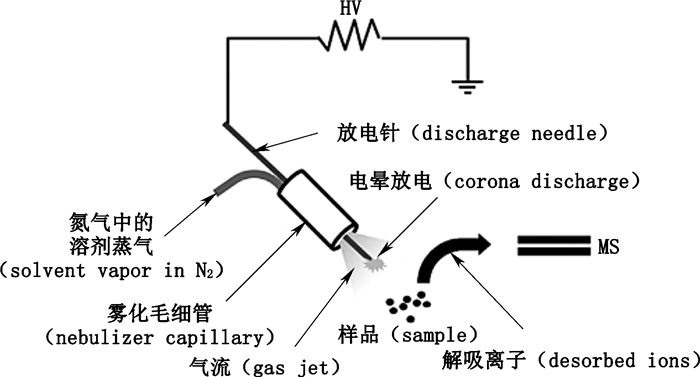
|
图 8 DAPCI示意图 Figure 8 A schematic diagram of DAPCI technique[10] |
如图 9,LTP使用玻璃管作为介电材料分割外部铜带电极与内部接地电极。通过管路的He、Ar或空气等气体在2.5~5 kV与2~5 kHz的交流电场放电作用下,产生温度约为30 ℃的等离子体,进而喷射至样品表面,使待测物解吸并离子化。解吸机制目前尚未明确,但推断与热解吸及化学溅射过程有关[9]。采用He作为放电气体,既可促进能量传递,又能电离空气的N2发挥彭宁电离作用。但由于He更易离子化,使用He存在比使用空气或N2产生更强的背景离子峰干扰的情况[12]。该技术特点在于放电电极被嵌于仪器内部因而不易损伤样品,反应温度接近有机体生理温度,产生的离子碎片少,尤其适用于皮肤表面药物分析。此外,LTP也可被应用于分析传统大气压离子源所难以分析的非极性化合物[27]。
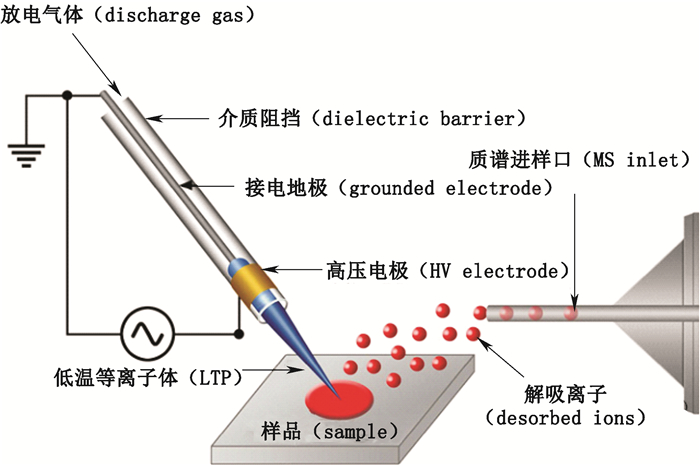
|
图 9 LTP示意图 Figure 9 A schematic diagram of LTP technique[26] |
药物的体内过程是评价药物疗效的关键过程,也是药物研发过程中关注的焦点。AMS目前在该领域应用广泛,常用于测定血液、尿液、器官组织、皮肤、毛发等多种生物基质中药物及代谢产物。
2.1 血液作为体内药物分析最为常用的基质,血液样本具有采集方便,较好体现药物浓度与治疗作用关系等特点,同时能更好地为临床用药提供参考价值。通常血液样品包括全血、血浆和血清3种,其中又以血浆最为常用。
Rossi等[28]采用DESI-LTQ-Orbitrap XL质谱测定Wistar大鼠血浆中埃索美拉唑及其代谢产物5-羟基奥美拉唑与奥美拉唑砜。血浆添加内标阿替洛尔后,经二氯甲烷液液萃取进入质谱分析。DESI采用N2作为雾化气体,并设定57°入射角,将50%乙腈以0.5 μL·min-1喷至距其2.1 mm的聚甲基丙烯酸甲酯载体表面,同时将样本与质谱入口间距离设为0.6 mm。方法验证结果检出限为60 ng·mL-1,线性范围为0.2~20 μg·mL-1(r2=0.987),精密度良好(RSD < 9%)。采用该方法同传统LC-MS/MS分别测定大鼠血药浓度并计算药动学参数,结果显示2种测定方法无显著性差异,表明DESI可代替传统LC-MS/MS进行血药浓度测定。
Song等[29]使用DART联用三重四极杆质谱测定健康志愿者同肝癌患者体内酪氨酸浓度差异。前处理过程简便,仅需将血浆、氘代硝基酪氨酸内标同80%乙腈混合即可。分析过程中,使用He作为工作气并将加热温度设定为350 ℃,并对其余仪器参数进行优化以获得最优信号强度。方法学验证结果良好,线性为2~50 μg·mL-1,日内、日间精密度与准确度符合要求(≤12.3%),每份样品分析时间可降至3 s。最后,成功测定人体内酪氨酸浓度并指出虽然肝癌患者体内酪氨酸浓度较高,但统计分析结果表明其同正常志愿者体内酪氨酸浓度无显著性差异。
对乙酰氨基酚是典型的极性小分子,传统液质联用技术中反相色谱柱难保留,极性基质极易与其共洗脱而产生明显的离子抑制现象。Swales等[30]利用激光二极管热辅助DAPCI源分析了小鼠、大鼠与犬血浆中对乙酰氨基酚浓度。样本仅需甲醇蛋白沉淀即可,方法验证结果显示,同种分析方法在3种不同种属基质中无明显差异。同传统液质联用技术相比,该技术平均样品分析时间缩短了10倍,日内与日间精密度与准确度更佳。而大鼠动物实验结果表明采用以上2种方法计算出的药动学参数基本一致,说明DAPCI基本可替代传统液质联用技术用于药动学研究。
环孢菌素A是临床上广泛用于预防器官和骨髓移植排斥反应的免疫抑制剂,但其治疗窗窄且患者体内血药浓度个体差异大。同时该药常易富集于血细胞内,为优化免疫治疗方案,需对其全血浓度进行测定。Jourdil等[31]首次使用激光二极管热DAPCI源测定全血中药物浓度。全血样本通过甲醇-0.2 mol·L-1硫酸锌(80:20,v/v)沉淀蛋白并破坏血红细胞,高速离心后氮气吹干上清并被水-乙酸乙酯复溶,从而提高方法灵敏度与重现性。随后,使用20 W激光二极管于4.5 s内将45%激光能释放至样本表面并于3 s内将离子源加热至145 ℃,即可解吸药物并减少基质残留干扰。该方法提取回收率可达92%,质控样本方法回收率为92.9%~105.3%,RSD为3.4%~13.1%,曲线相关系数为0.999,说明该方法可用于血药浓度测定。最终,Bland-Altman图显示该方法同HPLC-ESI-MS/MS分别测定120份全血样本结果的平均偏差为+0.9 ng·mL-1,表明两者适应性相当,前者可代替后者进行治疗药物检测。
干血点分析法是近来体内药物分析衍生出的新处理方法。其显著优势在于可避免血浆等液态基质中水解反应导致药物降解,同时存储与运输过程不需要冷冻,因而更便捷。Siebenhaar等[32]采用2D DESI离子源联用ExactiveTM离子阱质谱分析干血点中阿司匹林活性代谢产物——水杨酸浓度。只需指尖采血并滴于三层复合滤纸上,其中滤纸中间层预先浸泡过氘代内标溶液并挥干,此举可显著减少内标加入过程中手动操作误差。待血样室温干燥后即可使用DESI喷雾头从滤纸背面以175 μm·s-1与45°喷射角单线扫描整个样本进行分析。该定量方法检测限为8 mg·L-1,线性范围为10~2 000 mg·L-1(r=0.997)。通过该法计算出的健康志愿者口服阿司匹林后水杨酸血浆药代动力学参数同文献报道相符。
为评价PSI在干血点分析中的潜力,Manicke等[33]采用PSI定量测定干血点中的舒尼替尼、西酞普兰以及维拉帕米等15种小分子。预先将同位素内标滴至被剪成底7.2 mm、高11 mm的三角形Whatman血卡纸上,待溶剂挥干后滴加血样,等制成干血点样本后,继续滴加25 μL 90%甲醇水溶液(含0.01%甲酸)润湿样本,随后在纸上加载3.5 kV高压并将尖端对准TSQ Quantum Access Max质谱进样孔。平均每份血样制备及分析时间共需30 s左右。方法验证中,检测限约为1 ng·mL-1,相对偏差及RSD均小于10%,相对基质效应忽略不计,结果表明该方法在血药浓度检测方面具有极大潜力。在此基础上,Zhang等[34]继续考察了使用二氧化硅涂布纸替代Whatman血卡纸并使用二氯甲烷/异丙醇(9:1,v/v)作为喷雾溶剂分析干血点中的维拉帕米、西酞普兰、利多卡因与舒尼替尼。借助硅胶板色谱分离特性,定量限可进一步达到0.1 ng·mL-1,比Whatman血卡纸灵敏度提升了5~50倍。
2.2 尿液尿药测定主要用于药物物质平衡、尿清除率、体内代谢途径及代谢产物研究。同时,当药物在血中浓度过低难以准确测定时,尿药测定亦用于药物制剂生物利用度研究。
Li等[35]采用自制EESI联用LTQ-XL质谱定量测定健康志愿者尿液中肌酐浓度并用于急性肾衰竭诊断。原尿样用水稀释500倍后加入氘代内标完成前处理。电喷雾通道为加载4 kV电压的甲醇溶液,中性样品通道为处理后的尿样溶液,两者尖端夹角为60°并相距10 mm。随后电喷雾通道和中性样品通道分别以3 μL·min-1与5 μL·min-1喷出溶液并用1 MPa氮气雾化萃取电离。在0.05~10 mg·L-1定量浓度范围内,曲线线性关系良好(r2=0.986 1),肌酐同氘代内标的RSD(n=6)分别为7.1~11.8%和4.1~11.3%。最终样本测定结果同传统基于Jaffe反应的分光光度法结果相当,相对回收率为85%~111%。
Carrizo等[36]首次使用ASAP-MS-Q-TOF筛选尿液与唾液中烟草生物标记物。尿样不经处理直接注入APAS接口分析。作为离子源的关键参数,电晕电流、锥孔电压、脱溶剂温度均得到优化。检测结果发现了可替宁、反式-3’-羟基可替宁、烟碱-N-葡萄糖醛酸苷等烟碱代谢生物标记物及1-羟基芘、9-羟基菲等多种烟草相关毒性物质,该结果同UPLC-MS/MS及相关文献报道一致。这些新发现的生物标记物可被用于研究烟草暴露量及评估消费者使用风险。
美沙酮口服吸收快,约1/3以原型形式经尿液排出,故尿样常用于临床药物滥用诊断。Thunig等[37]采用DART联用飞行时间质谱直接筛选人尿样中的美沙酮,并通过DART联用四极杆线性离子阱质谱进行确证。该方法既不需昂贵的免疫试剂,也不需复杂样本前处理,仅需2 min即可分析药物浓度在250~1 500 ng·mL-1范围内的尿样。另外,Rodriguez-Lafuente等[38]则采用薄膜固相微萃取联用DART分析人尿中的美沙酮浓度。使用C18-PAN薄膜包被筛网可富集药物并除去尿液中的盐分,从而提高分析灵敏度(定量限为1 ng·mL-1)。此外,由于固相微萃取平衡时间只需10 min,故DART分析速度与通量不受影响,且薄膜厚度越低,平衡萃取时间越短,短时间内(30 s)可快速解吸大量药物。
Jackson等[39]通过LTP尿样分析判别人体苯丙胺、咖啡因、可待因与地西泮等14种药物滥用情况。外部加载有5 kV、2.8 Hz交流电的自制LTP使用He作为等离子体并以30°喷射至相距1~2 mm的样本表面,随后产生的离子可进入相距5 mm的线性离子阱质谱。使用待测物标准溶液分析,11种药物的检出限范围为10~10 000 ng·mL-1,而对样品底部通过加热枪进行辅助加热处理可解吸更多药物分子,从而进一步提高12种药物的检出限(0.5~500 ng·mL-1)。以苯酰牙子碱作为代表进行生物样本方法验证,线性动态范围在0.01~ 000 μg·mL-1(r2=0.995)。对口服咖啡因饮料的健康志愿者尿样分析结果表明,30 min内即可在尿样中发现咖啡因及其代谢产物甲基黄嘌呤,而在60 min咖啡因质谱信号达到最强,随后呈指数衰减。
2.3 组织组织药物浓度既可反映药物疗效,又关系到药物的蓄积和毒副作用等安全性问题,同时为药物靶向运输提供重要信息。常用的脏器组织包括胃、肝、肾、脑、心等。传统分析方法需将固体组织切割匀化制成水性基质匀浆溶液,随后前处理萃取药物分析。但AMS,尤其是DESI与PESI,可直接取样测定,极大降低了前处理时间。
Zaitsu等[40]采用PESI联用LCMS-8040三重四极杆质谱直接分析活体动物肝内代谢过程。PESI采用尖端直径700 nm的探针,以300 mm·s-1刺入肝下0.5 mm取样。为验证方法适用性,分别分析四氯化碳诱导急性肝损伤模型组同对照组大鼠肝内代谢物特性。主成分分析图表明,两组肝内的3-羟基丁酸、甘氨酸等26种内源性小分子代谢物存在明显差异,其中最明显的是牛磺酸差异(该结果进一步得到GC-MS/MS确证),并推测牛磺酸可能参与肝内抗氧化过程。此外,根据三羧酸循环机理,通过门静脉推注丙酮酸,PESI同时监测了活体大鼠肝内α-酮戊二酸及反丁烯二酸动态变化过程并验证了相关理论。为便于质谱采集大体积活体动物组织样本,Yoshimura等[41]在质谱离子入口处外接长度为200 mm离子取样管及抽吸速率为6 L·min-1的小型隔膜真空泵,以促使更多待测物离子与带电液滴被吸入质谱分析。小鼠尾静脉注射100 μL浓度为100 mmol·L-1 5-氟尿嘧啶溶液,1 min后质谱即检测出药物信号([M+Na]+,m/z=269.1),并于35 min信号强度降低至0.4 μmol·L-1。该结果同人体药动学相关结果范围一致(2’-去氧-5-氟尿嘧啶的半衰期为15~22 min)。
除常规的组织药物浓度测定应用外,目前新兴一种生物质谱成像技术,该技术通过将AMS电喷雾装置固定,并将组织切片放置于承载表面进行解吸电离,连续移动承载表面获得样本二维扫描信号,甚至进一步叠加各切片药物信号,从而根据特征信号强度获得目标物质在样本整体分布信息[42-43]。该技术主要用于分析病理组织脂质、多糖等多种代谢生物标记物以鉴别诊断疾病。表 1列举了近3年相关代谢组学应用实例。
|
|
表 1 近3年来敞开式离子化质谱在代谢组学中的应用 Table 1 Application of ambient mass spectrometry in metabolomics in the recent 3 years |
随着更多新的常压解吸离子化技术及相关商业化产品的出现,AMS在药物代谢动力学、组织显影、代谢组学等体内药物分析领域得到了广泛应用。虽然在该领域研发初期,研究者遇到诸如定量分析效果差,实验重现困难,检出限高等一系列难题,但随着多种氘代内标添加方法[32]、商业化自动进样器[59]、快速高效前处理联用方法[60]以及小型质谱分析仪[61]的出现,这类问题初步得到解决。
然而,常压解吸离子化技术若想在未来得到更广泛的应用,除了应在纷繁复杂的子技术中区分各自优势领域外,仍需制定合理的通用方法学控制标准,而不仅仅是同液质联用技术的简单对比。同时,更应当关注商业化仪器及自动化操作的发展。相信随着该类技术不断发展完善,将会在多种生物基质样品的高通量、实时监测方面发挥突出作用。
| [1] |
TAKYI-WILLIAMS J, LIU CF, TANG K. Ambient ionization MS for bioanalysis:recent developments and challenges[J]. Bioanalysis, 2015, 7(15): 1901. DOI:10.4155/bio.15.116 |
| [2] |
TAKATS Z, WISEMAN JM, GOLOGAN B, et al. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization[J]. Science, 2004, 306(5695): 471. DOI:10.1126/science.1104404 |
| [3] |
GU H, XU N, CHEN H. Direct analysis of biological samples using extractive electrospray ionization mass spectrometry(EESI-MS)[J]. Anal Bioanal Chem, 2012, 403(8): 2145. DOI:10.1007/s00216-012-5874-1 |
| [4] |
HIRAOKA K, NISHIDATE K, MORI K, et al. Development of probe electrospray using a solid needle[J]. Rapid Commun Mass Spectrom, 2007, 21(18): 3139. DOI:10.1002/(ISSN)1097-0231 |
| [5] |
WANG H, LIU J, GRAHAM CR, et al. Paper spray for direct analy-sis of complex mixtures using mass spectrometry[J]. Angew Chem Int Ed Engl, 2010, 49(5): 877. DOI:10.1002/anie.200906314 |
| [6] |
CODY RB, LARAMEE JA, DURST HD. Versatile new ion source for the analysis of materials in open air under ambient conditions[J]. Anal Chem, 2005, 77(8): 2297. DOI:10.1021/ac050162j |
| [7] |
PETUCCI C, DIFFENDAL J. Atmospheric solids analysis probe:a rapid ionization technique for small molecule drugs[J]. J Mass Spectrom, 2008, 43(11): 1565. DOI:10.1002/jms.v43:11 |
| [8] |
CHEN H, ZHENG J, ZHANG X, et al. Surface desorption atmos-pheric pressure chemical ionization mass spectrometry for direct ambient sample analysis without toxic chemical contamination[J]. J Mass Spectrom, 2007, 42(8): 1045. DOI:10.1002/(ISSN)1096-9888 |
| [9] |
HARPER JD, CHARIPAR NA, MULLIGAN CC, et al. Low-tem-perature plasma probe for ambient desorption ionization[J]. Anal Chem, 2008, 80(23): 9097. DOI:10.1021/ac801641a |
| [10] |
SMOLUCH M, MIELCZAREK P, SILBERRING J. Plasma-based ambient ionization mass spectrometry in bioanalytical sciences[J]. Mass Spectrom Rev, 2016, 35(1): 22. DOI:10.1002/mas.21460 |
| [11] |
LEBEDEV AT. Ambient ionization mass spectrometry[J]. Russian Chem Rev, 2015, 84(7): 665. DOI:10.1070/RCR4508 |
| [12] |
DING X, DUAN Y. Plasma-based ambient mass spectrometry techniques:The current status and future prospective[J]. Mass Spectrom Rev, 2015, 34(4): 449. DOI:10.1002/mas.v34.4 |
| [13] |
贺玖明, 李铁钢, 何菁菁, 等. 常压敞开式离子化质谱技术研究进展[J]. 分析测试学报, 2012, 31(9): 1151. HE JM, LI TG, HE JJ, et al. Advances in ambient ionization mass spectrometry[J]. J Instrum Anal, 2012, 31(9): 1151. |
| [14] |
KLAMPFL CW, HIMMELSBACH M. Direct ionization methods in mass spectrometry:an overview[J]. Anal Chim Acta, 2015, 890: 44. DOI:10.1016/j.aca.2015.07.012 |
| [15] |
陈焕文, 胡斌, 张燮. 复杂样品质谱分析技术的原理与应用[J]. 分析化学, 2010, 38(8): 1069. CHEN HW, HU B, ZHANG X. Fundamental principles and practical applications of ambient ionization mass spectrometry for direct analysis of complex samples[J]. Chin J Anal Chem, 2010, 38(8): 1069. |
| [16] |
COSTA AB, GRAHAM CR. Simulated splashes:Elucidating the mechanism of desorption electrospray ionization mass spectrometry[J]. Chem Phys Lett, 2008, 464(1-3): 1. DOI:10.1016/j.cplett.2008.08.020 |
| [17] |
MURAMOTO S, FORBES TP, STAYMATES ME, et al. Visualizing mass transport in desorption electrospray ionization using time-of-flight secondary ion mass spectrometry[J]. Analyst, 2014, 139(11): 2668. DOI:10.1039/C4AN00390J |
| [18] |
ROACH PJ, LASKIN J, LASKIN A. Nanospray desorption electros-pray ionization:an ambient method for liquid-extraction surface sampling in mass spectrometry[J]. Analyst, 2010, 135(9): 2233. DOI:10.1039/c0an00312c |
| [19] |
LU HY, ZHANG JY, ZHOU W, et al. Direct analysis of phos-pholipids in biological tissues using internal extractive electrospray ionization mass spectrometry[J]. Chin J Anal Chem, 2016, 44(3): 329. DOI:10.1016/S1872-2040(16)60910-6 |
| [20] |
LIU C, ZHANG X, XIAO S, et al. Detection of trace levels of lead in aqueous liquids using extractive electrospray ionization tandem mass spectrometry[J]. Talanta, 2012, 98: 79. DOI:10.1016/j.talanta.2012.06.048 |
| [21] |
LIU J, WANG H, MANICKE NE, et al. Development,characteriz-ation,and application of paper spray ionization[J]. Anal Chem, 2010, 82(6): 2463. DOI:10.1021/ac902854g |
| [22] |
YANG Q, WANG H, MAAS JD, et al. Paper spray ionization devices for direct,biomedical analysis using mass spectrometry[J]. Int J Mass Spectrom, 2012, 312: 201. DOI:10.1016/j.ijms.2011.05.013 |
| [23] |
ELLIS SR, BROWN SH, PANHUIS MIH, et al. Surface analysis of lipids by mass spectrometry:More than just imaging[J]. Prog Lipid Res, 2013, 52(4): 329. DOI:10.1016/j.plipres.2013.04.005 |
| [24] |
GROSS JH. Direct analysis in real time-a critical review on DART-MS[J]. Anal Bioanal Chem, 2014, 406(1): 63. DOI:10.1007/s00216-013-7316-0 |
| [25] |
SONG L, DYKSTRA AB, YAO H, et al. Ionization mechanism of negative ion-direct analysis in real time:a comparative study with negative ion-atmospheric pressure photoionization[J]. J Am Soc Mass Spectrom, 2009, 20(1): 42. DOI:10.1016/j.jasms.2008.09.016 |
| [26] |
HORVATIC V, VADLA C, FRANZKE J. Discussion of fundamental processes in dielectric barrier discharges used for soft ionization[J]. Spectrochim Acta Part B, 2014, 100: 52. DOI:10.1016/j.sab.2014.08.010 |
| [27] |
ALBERT A, ENGELHARD C. Characteristics of low-temperature plasma ionization for ambient mass spectrometry compared to electrospray ionization and atmospheric pressure chemical ionization[J]. Anal Chem, 2012, 84(24): 10657. DOI:10.1021/ac302287x |
| [28] |
ROSSI A, CASTRATI L, COLOMBO P, et al. Development and validation of a DESI-HRMS/MS method for the fast profiling of esomeprazole and its metabolites in rat plasma:a pharmacokinetic study[J]. Drug Test Anal, 2016, 8(2): 208. DOI:10.1002/dta.v8.2 |
| [29] |
SONG Y, LIAO J, ZHA C, et al. A novel approach to determine the tyrosine concentration in human plasma by DART-MS/MS[J]. Anal Methods, 2015, 7(4): 1600. DOI:10.1039/C4AY02566K |
| [30] |
SWALES JG, TEMESI DG, DENN M, et al. Determination of paracetamol in mouse,rat and dog plasma samples by laser diode thermal desorption-APCI-MS/MS[J]. Bioanalysis, 2012, 4(11): 1327. DOI:10.4155/bio.12.68 |
| [31] |
JOURDIL JF, PICARD P, MEUNIER C, et al. Ultra-fast cyclosporin A quantitation in whole blood by laser diode thermal desorption-tandem mass spectrometry;comparison with high performance liquid chromatography-tandem mass spectrometry[J]. Anal Chim Acta, 2013, 805: 80. DOI:10.1016/j.aca.2013.10.051 |
| [32] |
SIEBENHAAR M, KÜLLMER K, de BARROS FERNANDES NM, et al. Personalized monitoring of therapeutic salicylic acid in dried blood spots using a three-layer setup and desorption electrospray ionization mass spectrometry[J]. Anal Bioanal Chem, 2015, 407(23): 7229. DOI:10.1007/s00216-015-8887-8 |
| [33] |
MANICKE NE, ABU-RABIE P, SPOONER N, et al. Quantitative analysis of therapeutic drugs in dried blood spot samples by paper spray mass spectrometry:an avenue to therapeutic drug monitoring[J]. J Am Soc Mass Spectrom, 2011, 22(9): 1501. DOI:10.1007/s13361-011-0177-x |
| [34] |
ZHANG Z, XU W, MANICKE NE, et al. Silica coated paper substrate for paper-spray analysis of therapeutic drugs in dried blood spots[J]. Anal Chem, 2012, 84(2): 931. DOI:10.1021/ac202058w |
| [35] |
LI X, FANG X, YU Z, et al. Direct quantification of creatinine in human urine by using isotope dilution extractive electrospray ionization tandem mass spectrometry[J]. Anal Chim Acta, 2012, 748: 53. DOI:10.1016/j.aca.2012.08.040 |
| [36] |
CARRIZO D, NERIN I, DOMENO C, et al. Direct screening of tobacco indicators in urine and saliva by atmospheric pressure solid analysis probe coupled to quadrupole-time of flight mass spectrometry (ASAP-MS-Q-TOF-)[J]. J Pharm Biomed Anal, 2016, 124: 149. DOI:10.1016/j.jpba.2016.02.033 |
| [37] |
THUNIG J, FLO L, PEDERSEN-BJERGAARD S, et al. Liquid-phase microextraction and desorption electrospray ionization mass spectrometry for identification and quantification of basic drugs in human urine[J]. Rapid Commun Mass Spectrom, 2012, 26(2): 133. DOI:10.1002/rcm.5315 |
| [38] |
RODRIGUEZ-LAFUENTE A, MIRNAGHI FS, PAWLISZYN J. Determination of cocaine and methadone in urine samples by thin-film solid-phase microextraction and direct analysis in real time (DART) coupled with tandem mass spectrometry[J]. Anal Bioanal Chem, 2013, 405(30): 9723. DOI:10.1007/s00216-013-6993-z |
| [39] |
JACKSON AU, GARCIA-REYES JF, HARPER JD, et al. Analysis of drugs of abuse in biofluids by low temperature plasma (LTP) ionization mass spectrometry[J]. Analyst, 2010, 135(5): 927. DOI:10.1039/b920155f |
| [40] |
ZAITSU K, HAYASHI Y, MURATA T, et al. Intact endogenous metabolite analysis of mice liver by probe electrospray ionization/triple quadrupole tandem mass spectrometry and its preliminary application to in vivo real-time analysis[J]. Anal Chem, 2016, 88(7): 3556. DOI:10.1021/acs.analchem.5b04046 |
| [41] |
YOSHIMURA K, CHEN LC, JOHNO H, et al. Development of non-proximate probe electrospray ionization for real-time analysis of living animal[J]. Mass Spectrom (Tokyo), 2014, 3(Spec Iss 3): S0048. |
| [42] |
HSU CC, DORRESTEIN PC. Visualizing life with ambient mass spectrometry[J]. Curr Opin Biotechnol, 2015, 31: 24. DOI:10.1016/j.copbio.2014.07.005 |
| [43] |
NEMES P, VERTES A. Ambient mass spectrometry for in vivo local analysis and in situ molecular tissue imaging[J]. TrAC Trend Anal Chem, 2012, 34: 22. DOI:10.1016/j.trac.2011.11.006 |
| [44] |
SANTAGATA S, EBERLIN LS, NORTON I, et al. Intraoperative mass spectrometry mapping of an onco-metabolite to guide brain tumor surgery[J]. Proc Natl Acad Sci USA, 2014, 111(30): 11121. DOI:10.1073/pnas.1404724111 |
| [45] |
ABBASSI-GHADI N, VESELKOV K, KUMAR S, et al. Discrimin-ation of lymph node metastases using desorption electrospray ionisation-mass spectrometry imaging[J]. Chem Commun, 2014, 50(28): 3661. DOI:10.1039/C3CC48927B |
| [46] |
EBERLIN LS, TIBSHIRANI RJ, ZHANG J, et al. Molecular assessment of surgical-resection margins of gastric cancer by mass-spectrometric imaging[J]. Proc Natl Acad Sci USA, 2014, 111(7): 2436. DOI:10.1073/pnas.1400274111 |
| [47] |
D'ALVISE J, MORTENSEN R, HANSEN SH, et al. Detection of follicular transport of lidocaine and metabolism in adipose tissue in pig ear skin by DESI mass spectrometry imaging[J]. Anal Bioanal Chem, 2014, 406(15): 3735. DOI:10.1007/s00216-014-7802-z |
| [48] |
LIU J, GINGRAS J, GANLEY KP, et al. Whole-body tissue distri-bution study of drugs in neonate mice using desorption electrospray ionization mass spectrometry imaging[J]. Rapid Commun Mass Spectrom, 2014, 28(2): 185. DOI:10.1002/rcm.6775 |
| [49] |
CALLIGARIS D, CARAGACIANU D, LIU X, et al. Application of desorption electrospray ionization mass spectrometry imaging in breast cancer margin analysis[J]. Proc Natl Acad Sci USA, 2014, 111(42): 15184. DOI:10.1073/pnas.1408129111 |
| [50] |
OTSUKA Y, NAITO J, SATOH S, et al. Imaging mass spectrometry of a mouse brain by tapping-mode scanning probe electrospray ionization[J]. Analyst, 2014, 139(10): 2336. DOI:10.1039/C3AN02340K |
| [51] |
KERIAN KS, JARMUSCH AK, PIRRO V, et al. Differentiation of prostate cancer from normal tissue in radical prostatectomy specimens by desorption electrospray ionization and touch spray ionization mass spectrometry[J]. Analyst, 2015, 140(4): 1090. DOI:10.1039/C4AN02039A |
| [52] |
GUENTHER S, MUIRHEAD LJ, SPELLER AV, et al. Spatially resolved metabolic phenotyping of breast cancer by desorption electrospray ionization mass spectrometry[J]. Cancer Res, 2015, 75(9): 1828. DOI:10.1158/0008-5472.CAN-14-2258 |
| [53] |
CALLIGARIS D, FELDMAN DR, NORTON I, et al. Molecular typing of meningiomas by desorption electrospray ionization mass spectrometry imaging for surgical decision-making[J]. Int J Mass Spectrom, 2015, 377: 690. DOI:10.1016/j.ijms.2014.06.024 |
| [54] |
HSU CC, CHOU PT, ZARE RN. Imaging of proteins in tissue samples using nanospray desorption electrospray ionization mass spectrometry[J]. Anal Chem, 2015, 87(22): 11171. DOI:10.1021/acs.analchem.5b03389 |
| [55] |
OTSUKA Y, SATOH S, NAITO J, et al. Visualization of cancer-related chemical components in mouse pancreas tissue by tapping-mode scanning probe electrospray ionization mass spectrometry[J]. J Mass Spectrom, 2015, 50(10): 1157. DOI:10.1002/jms.3634 |
| [56] |
PAINE MR, KIM J, BENNETT RV, et al. Whole reproductive system non-negative matrix factorization mass spectrometry imaging of an early-stage ovarian cancer mouse model[J]. PLoS One, 2016, 11(5): 1. |
| [57] |
JARMUSCH AK, PIRRO V, BAIRD Z, et al. Lipid and metabolite profiles of human brain tumors by desorption electrospray ionization-MS[J]. Proc Natl Acad Sci USA, 2016, 113(6): 1486. DOI:10.1073/pnas.1523306113 |
| [58] |
TATA A, GRIBBLE A, VENTURA M, et al. Wide-field tissue pol-arimetry allows efficient localized mass spectrometry imaging of biological tissues[J]. Chem Sci, 2016, 7(3): 2162. DOI:10.1039/C5SC03782D |
| [59] |
SHEN L, ZHANG J, YANG Q, et al. High throughput paper spray mass spectrometry analysis[J]. Clin Chim Acta, 2013, 420: 28. DOI:10.1016/j.cca.2012.10.025 |
| [60] |
GOMEZ-RIOS GA, REYES-GARCES N, BOJKO B, et al. Biocom-patible solid-phase microextraction nanoelectrospray ionization:an unexploited tool in bioanalysis[J]. Anal Chem, 2016, 88(2): 1259. DOI:10.1021/acs.analchem.5b03668 |
| [61] |
SNYDER DT, PULLIAM CJ, OUYANG Z, et al. Miniature and fieldable mass spectrometers:recent advances[J]. Anal Chem, 2016, 88(1): 2. DOI:10.1021/acs.analchem.5b03070 |
 2017, Vol. 37
2017, Vol. 37 
