2. 中国科学院地球科学研究院, 北京 100029;
3. 中国科学院大学, 北京 100049;
4. CNRS and Université Grenoble Alpes, ISTerre, Grenoble 38058;
5. 中国科学院深海科学与工程研究所, 深海地质与地球化学研究室, 三亚 572000
2. Innovation Academy of Earth Science, Chinese Academy of Sciences, Beijing 100029, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. CNRS and Université Grenoble Alpes, ISTerre, Grenoble 38058, France;
5. Laboratory of Deep-sea Geology and Geochemistry, Institute of Deep-Sea Science and Engineering, Chinese Academy of Sciences, Sanya 572000, China
地壳中广泛存在与水-岩/矿物反应有关的蚀变过程,它们在元素地球化学循环中起着至关重要的作用(Klein and Philpotts, 2013)。例如,地壳中岩石的化学风化作用,是土壤产生的来源,也是地壳中作物生长所需营养元素的来源。与之相关的水岩体系也成为地球科学中最重要的体系之一,如长石-水体系在实验室已经得到了广泛的研究。不仅包括酸性至弱碱性的pH条件下的自然风化体系(Blum and Stillings, 1995;Bandstra et al., 2007),也包括少数在极端碱性条件下的非平衡体系(Liu et al., 2015, 2018, 2019;Ciceri et al., 2017)。
化学风化过程中钙质矿物(如钙长石)中释放的钙离子,将会和大气中CO2反应生成碳酸钙,这一过程将会对全球气候产生不可估量的影响(Yuan et al., 2019)。长石作为占据地壳体积近半的重要造岩矿物,对其蚀变的研究意义十分重要。自然条件下,长石的风化速率很慢。例如,1mm大小的钾长石晶体完全风化需要经过52万年(Lasaga, 1984)。然而,当长石受到外界因素的干扰,如在酸、碱性或者温度升高的条件下,风化速率显著提高。如在室温下,pH从10提高到12时,钾长石的溶解速率将会提高近2个数量级(参考Yuan et al., 2019中Fig. 9A)。为了更好地研究长石类矿物的蚀变过程及机理,一些研究者在实验室内模拟了非自然条件下的一些极端情况,例如在极酸(pH<1)、极碱(pH>12)或者高温(T>200℃)条件下的钾、钠长石的蚀变研究(Yuan et al., 2019)。不仅如此,极端条件下长石的溶解加剧,可以将长石(如钾长石)中的钾、硅、铁、钼等植物所需要的营养成分从中释放出来(Manning,2010;Ciceri and Allanore, 2015;Ciceri et al., 2017;Liu et al., 2015, 2019;Skorina and Allanore, 2015)。
综上,通过对非平衡条件下的长石水热体系研究,特别是纳米尺度下其反应界面的研究,不仅有助于理解长石的蚀变机制,也将有助于理解界面蚀变机制对长石的自然风化反应以及对元素地球化学循环过程的影响。
许多研究者在碱性流体-长石的反应体系中,都发现了层状硅酸盐矿物的形成,例如托贝莫来石(Arnold et al., 1992;Fenter et al., 2010;Schepers and Milsch, 2013;Liu et al., 2015;Ciceri et al., 2017)、高岭石、蒙脱石、伊利石等(伏万军和刘文彬,1996)。自然界中,托贝莫来石主要产于热液流体和碱性火成岩(如玄武岩)的接触带上,如日本的Okayama(Henmi and Kusachi, 1992)和英国的Skye(Livingston,1988)。实验室中,托贝莫来石也可在200℃以下的水热碱性条件下合成得到。托贝莫来石具有层状硅酸盐矿物的特征,如独特的层状结构,较高的离子可交换容量以及高比表面积等。这些特性使得托贝莫来石具有潜在的地球化学应用价值,如对重金属离子(如Cd,Pb和Cr)的吸附交换作用(Merlino et al., 2008;Churakov,2009),可应用在催化、核废物和有毒废弃物处理等领域(Komarneni and Roy, 1983;Elmes et al., 2018)。已有研究者在160℃至260℃的水热条件下,对钾长石与碱性溶液之间的反应进行了大量的研究,并合成了托贝莫来石、水钙铝榴石、无定形和结晶硅酸钙水合物等次生矿物(Liu et al., 2015;Su et al., 2015)。但多数学者侧重于对托贝莫来石形成的机制以及微米尺度下的托贝莫来石的形态结构的研究,而对于纳米尺度下的显微结构研究较少。对托贝莫来石纳米显微结构的研究,一方面有助于理解长石在碱性条件下的蚀变机制,另一方面为解释托贝莫来石所表现的催化作用和离子吸附等特性提供更多的信息。
本研究中,作者在极端碱性条件下(190℃,24h,m钾长石:mCaO=1:1,水固比=5,初始pH=12.4)对钾长石的碱性蚀变机制及其蚀变产物托贝莫来石的显微结构进行了探索。采用X射线粉末衍射(XRD)、BET测试(BET-SSA)、扫描电镜(SEM)和能谱(EDS)对反应后的蚀变产物托贝莫来石进行了表征。采用聚焦离子束(FIB)技术制备了透明样品薄切片,利用高分辨透射电子显微镜(HRTEM)可以直接在横切面上对钾长石蚀变产物进行结构的表征,并在纳米尺度上进行观测。
本研究旨在探讨钾长石在极端碱性条件下的蚀变机制及蚀变产物托贝莫来石的显微结构特征。纳米尺度的钾长石近表面结构和表面层化学研究,可以厘清界面溶解-再沉淀机制模型在长石-碱性水热体系中的应用。托贝莫来石作为一种层状硅酸盐矿物,对其显微结构的分析,可以为具有特殊结构的层状硅酸盐矿物在纳米尺度下对周围流体化学性质的影响提供新的信息,并为托贝莫来石的吸附作用和催化性能在更广泛的应用领域提供新的思路。
1 实验 1.1 样品本次实验所需的钾长石采自内蒙古自治区赤峰市巴林右旗太阳沟锡铁矿区的花岗岩中(图 1)。花岗岩呈灰白-灰红色,块状构造,中粗粒结构为主,主要矿物有微斜长石、石英、斜长石、角闪石、黑云母等。其中的微斜长石呈粉红色,呈自形-半自形晶,镜下可见微斜长石格子状双晶。利用破碎、单矿物挑选和重液分选的方法挑选出了花岗岩中的微斜长石单矿物(分子式为K0.78Na0.18Ca0.01Al1.05Si2.97O8),并粉碎至200目,作为本次研究的反应样品。以上实验均由河北省廊坊市宇能矿物分选有限公司完成。反应所用的另一种原料为分析纯生石灰(CaO),含CaO 97%,CaCO3 3%。

|
图 1 内蒙古赤峰市太阳沟矿区花岗岩手标本照片 Kfs-钾长石 Fig. 1 Photographs of granite specimen from Taiyanggou mining area in Chifeng, Inner Mongolia Kfs-K-feldspar |
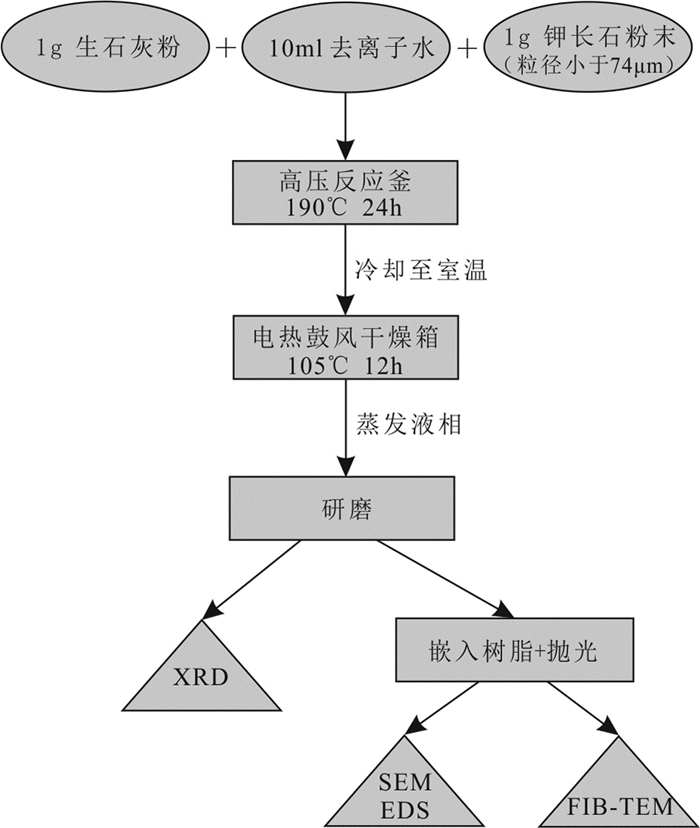
将1g钾长石粉和1g生石灰粉(CaO)分别放入高压反应釜(自制,容量约100mL)中,并将它们均匀混合。然后在高压釜中加入10mL去离子水,在室温下搅拌5分钟。将高压釜密封后,放入提前预热至190℃的电炉,并在190℃的电炉内恒温反应24小时。反应结束后,待反应釜内部完全冷却至室温,打开反应釜,放入电热鼓风干燥箱,在105℃下恒温干燥12小时,将反应釜内的水完全蒸发得到干燥后的固体反应物。将其转移至玛瑙研钵中研磨至粉末状,并过200目筛。详细的水热实验过程如图 2所示。
|
图 2 利用钾长石进行水热反应实验的处理路线及分析方法流程图 Fig. 2 Flow chart of the hydrothermal processing of K-feldspar and analytical methods |
XRD分析在法国格勒诺布尔阿尔卑斯大学地球科学研究所利用Bruker D5000粉末衍射仪完成。仪器工作条件如下:SolX-Si(Li)固态探测器,Cu靶发射器,管电压40kV,管电流40mA。步进扫描,扫描步宽0.026°。2-theta步距范围5°~90°。通过Rietveld的方法,使用Profex(Doebelin and Kleeberg, 2015)对XRD进行定量相分析和矿物精修。
SEM分析在Zeiss Ultra Plus (PISA Facility-GFZ, Potsdam, Germany)高分辨率场发射扫描电子显微镜上完成,将反应产物的粉末嵌入到液态碳基环氧树脂中,该环氧树脂可以在模具中硬化。然后用5.0μm的粒度仪对其进行抛光。仪器工作条件如下:加速电压20kV,孔径120μm。用EDS测量化学图谱和光谱。化学光谱基于元素(Si、Al、O、K、Na、Ca、C)的标准K线,并利用ZAF元素校正法对样品的EDS点分析和化学图谱校正。
TEM分析在德国波茨坦地学研究中心(GFZ, Potsdam, Germany)的FEI Tecnai G2 F20 X-twin FEG透射电镜上完成,工作电压为200kV。该透射电镜配备标准的BF(明场)、DF(暗场)和HAADF(高角环形暗场)探测器,Gatan Tridiem能量分析仪,以及EDS光谱仪。如何制取得到可用于高精度TEM观察的电子透明超薄切片(15~20μm×5~10μm×0.150μm),是开展TEM分析的关键。本次研究参照Wirth(2009)的聚焦离子束(FIB)制备方法,简述如下:在减薄之前,先在抛光晶粒表面的选定区域沉积金属铂后(图 3a),从20μm开始对样品进行等厚度的双面减薄(图 3b)。减薄至适当厚度时,将薄切片从基体上切下,原位转移至薄的铜网格上,并将其和网格柱焊接(图 3c)。随后在加速电压为30kV、离子束流强度为41Pa的条件下进行精密减薄,直至加速电压降至5kV。最终得到的电子透明超薄切片(15~20μm×5~10μm×0.150μm)可用于高精度透射电镜(TEM)的观察(图 3d)。仪器工作条件如下:采用Ga液态金属离子源,加速电压为30kV,离子束流强度为47nA。

|
图 3 利用聚焦离子束(FIB)技术制备透射电镜薄片过程 Fig. 3 Process of TEM thin section prepared by Focused Ion Beam (FIB) technique |
钾长石、钾长石与生石灰水热反应产物的粉末XRD结果分别如图 4a, b所示。分析显示水热反应产物中生成了新矿物相,即托贝莫来石(002,d=11.30Å;220,d=3.08Å;222,d=2.97Å)、水钙铝榴石(211,d=5.02Å;420,d=2.75Å;521,d=2.24Å)、方解石(104,d=3.04Å;110,d=2.50Å;113,d=2.29Å),以及少量未反应完全的微斜长石。通过Rietveld方法对蚀变产物XRD结果进行精修拟合,可得蚀变产物中各矿物相的近似质量百分比,依次为:34.08%托贝莫来石、22.73%水钙铝榴石、35.34%方解石和7.85%未反应的微斜长石。拟合后的背景显示20°~50°(2θ)之间有一个平滑的凸起,表明样品中含非晶态成分。经标定后测得样品中非晶态成分的含量为16%(Zhai et al., 2020),这与相似研究中测定的非晶态成分比例为18%(Ciceri et al., 2017)和5%~30%(Liu et al., 2019)基本吻合。由于钾长石仅含有微量的钙,可推知大量的方解石是空气中的二氧化碳溶解于CaO-H2O碱性体系的产物。另外含量较高的产物为托贝莫来石(Ca5Si6O16(OH)2·4H2O),晶体为正交晶系。[Al3++K+]可取代托贝莫来石中硅氧四面体中的Si4+形成铝代托贝莫来石。水热反应体系中还生成了约23%的水钙铝榴石。

|
图 4 钾长石碱性蚀变前后XRD图 (a)未反应钾长石;(b)钾长石碱性蚀变后所得产物(仅仅标注了标志性衍射峰的密勒指数) Fig. 4 XRD patterns of unaltered K-feldspar and alteration products (a) unaltered K-feldspar; (b) K-feldspar alteration products under alkaline conditions (only Miller indices of characteristic diffraction peaks were marked) |
在蚀变产物中,可以观察到水钙铝榴石多呈直径约1.5μm的球粒状。托贝莫来石晶体呈针状(图 5a, b)和细小纤维状(图 5b, c),针状的托贝莫来石晶体长度为2~10μm,纤维状托贝莫来石晶体长度大多小于500nm。不同形状的产物相互交织在一起,在晶体间形成微细孔隙,且不贯通。

|
图 5 钾长石碱性条件下的蚀变产物托贝莫来石扫描电镜图像及能谱 (a)针状托贝莫来石,白色圆圈为EDS分析区域;(b)针状和纤维状托贝莫来石,中间白色球粒状矿物为水钙铝榴石;(c)细小纤维状托贝莫来石晶体的放大;(d)图(a)中白色圆圈的EDS Fig. 5 SEM images and EDS pattern of tobermorite generated from K-feldspar alkaline alteration (a) needle-like tobermorite crystals; The white cycle refers to the EDS spot analysis area; (b) needle-like tobermorite and fibrous tobermorite; the white spherical mineral is hydrogrossular; (c) enlargement of the tiny fibrous tobermorite crystals; (d) EDS pattern of the selected area in Fig. 5a |
能谱分析显示(图 5d),这些针状或者纤维状的托贝莫来石晶体富Si、Ca,贫Al、K。由此可知Al3+和K+取代了托贝莫来石硅氧四面体中的Si4+,生成了铝代托贝莫来石,这与能谱面扫图的结果一致(图 6)。图 6显示水钙铝榴石除富含Si、Ca、Al外,也含少量K,且K在蚀变产物中都有分布。

|
图 6 钾长石碱性条件下的蚀变产物能谱扫面图 Fig. 6 EDS maps of alteration products of K-feldspar under alkaline conditions |
HRTEM结果显示,次生矿物相由纳米晶体矿物组成,微斜长石和蚀变产物之间出现了截然的接触界面,其尺度在纳米级别(图 7A)。界面处含有非晶质层,非晶质层和次生矿物相都是多孔的,可以通过界面传输物质。图 7A-a中蚀变产物区域出现的较大的白色气孔,可能为捕获的水充填其中而形成,图像中的深灰色部分是具衍射图案的微斜长石晶体。在微斜长石晶体的下部,细小的颗粒相互交织,在浅灰色区域形成长条状、棒状和球粒状的蚀变产物。蚀变产物的高角度环形暗场扫描透射电镜(HAADF-STEM)图像显示它们具有较大的孔隙。在微斜长石和蚀变次生矿物相之间的界面区,HRTEM图像显示出一个清晰可见且相对线性的界面,即在微斜长石与蚀变的次生矿物相之间形成了纳米厚度的非晶质层(图 7白色箭头示意),其特征是微斜长石的晶格条纹突然终止于非晶态沉积层。该非晶质层厚度范围不一,较厚的可达一百纳米(图 7B),较薄的仅有十几纳米(图 7A)。在图中非晶质层由于厚度较小并不是很明显,但对其接触界面处的放大图(白色虚线方框,图 7A-b)可明显的看出非晶质层的存在。晶质的微斜长石与非晶质层存在明显的界线(图 7A-b),其快速傅里叶变换图(FFT)可以看出微斜长石具有规则的衍射条纹而非晶质层不具有衍射条纹(图 7B-e)。非晶质层的存在证实次生矿物相中含有非晶态物质,这一结果与作者以前的工作(Zhai et al., 2020)中测得非晶态物质含量约16%的结论相符。

|
图 7 钾长石和次生矿物相界面HRTEM图像 A-(a)微斜长石与次生矿物相之间的界面,白色箭头表示界面中非晶质层介于微斜长石和次生矿物相之间;A-(b)为A-(a)白色虚线框的放大图,即晶质的微斜长石与非晶质层存在明显的界线,右下角为微斜长石的快速傅里叶变换图(FFT). B-(a)微斜长石与次生矿物相之间的界面,非晶质层介于二者之间,见图中白色箭头示意;B-(b、c)次生矿物相的TEM和FFT;B-(d、e)非晶质层的TEM和FFT;B-(f、g)微斜长石与非晶质层界面的TEM和FFT Fig. 7 HRTEM images of the sharp interface between K-feldspar and secondary phases A-(a) image of the contacted zone between the microcline and secondary phases. The white arrows indicate the boundary of amorphous layer, which occurs between microcline and secondary phases; A-(b) enlargement of white dotted box in A-(b), i.e., the boundary of the crystalline microcline and amorphous layer. The Fast Fourier Transform is showed in the right-bottom of A-(b). B-(a) image of the contacted zone between the microcline and secondary phases. White arrows indicate the amorphous layer between the microcline and secondary phase; B-(b, c) HRTEM image of secondary phases and corresponding Fast Fourier Transform image (FFT); B-(d, e) HRTEM and FFT of amorphous layer; B-(f, g) HRTEM image and FFT of the interface between microcline and amorphous layer |
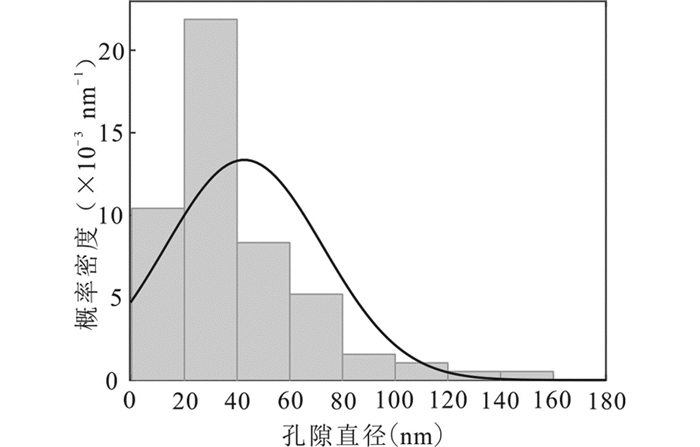
如果在二维空间上将托贝莫来石形成的孔隙近似看作圆形,可以对其孔径进行统计估算。选择托贝莫来石的SEM图像作为统计基础,利用Fiji/ImageJ软件将图像中的孔隙面积进行统计(本次共统计95个孔隙),并利用圆面积公式得出单个孔隙的直径,从而作出这些孔径的概率分布直方图及拟合曲线(图 8)。从图中可以看出,这些孔隙的尺寸在0~160nm,并且平均孔径约为40nm。这些孔隙为托贝莫来石纤维晶体交叉形成的二次孔道,没有微孔存在。
|
图 8 蚀变产物中托贝莫来石孔隙直径统计直方图 Fig. 8 Statistical histogram of tobermorite pore diameter in alteration products |
碱性条件下长石的蚀变研究较少,尤其是在高于100℃的温度下(Hellmann et al., 1989;Hellmann, 1994, 1995;Liu et al., 2015, 2018, 2019;Ciceri et al., 2017)。一般认为在碱性条件下,长石按照化学计量比一致地溶解,而不会形成任何表面蚀变层(Arnold et al., 1992;Fenter et al., 2010)。然而,它们在酸性和中性pH条件下化学计量比不一致地溶解,很容易形成这种表面蚀变层(Hellmann et al., 2003, 2012)。
在本研究中,作者利用HRTEM技术,在纳米尺度对钾长石在极端碱性条件下的蚀变过程进行了研究,却发现在钾长石与次生矿物相的界面上出现了表面蚀变层――即非晶质层(图 7)。作者认为,钾长石在碱性条件下的蚀变过程可以用界面溶解-再沉淀机制(CIDR)进行解释,而不是离子选择性释放所形成的化学扩散机制。这是由于CIDR所形成的界面与离子选择性释放所形成的化学界面截然不同。对于前者,反应过程中流体与钾长石接触,会立即在钾长石表面形成一层薄流体膜(thin fluid film)。随着反应的开始,钾长石释放的不溶性元素通过薄流体膜,在界面处立即重新沉淀,而不首先进入主体溶液(bulk fluid),可溶性元素则迁移至主体溶液中。薄流体膜具有不同于主体流体的物理化学和流变特性(Fenter and Sturchio, 2004;Marry et al., 2008;Knight et al., 2019)。因此,即使在主体溶液相对于次生矿物相不饱和的情况下,次生矿物相的再沉淀也是可能的(Hellmann et al., 2003, 2012, 2015;Ruiz-Agudo et al., 2012)。在本研究中,作者认为CIDR同样适用于极端碱性条件下钾长石的蚀变过程,主要基于下述三点:
(1) 纳米尺度下界面化学成分的突变与界面结构的突变(晶质-非晶质边界)在空间上存在一致性(界面的化学成分研究可见作者先前的工作Zhai et al., 2020)。
(2) 在较短的反应时间内(24h)快速形成的表面蚀变层即非晶质层,厚则可达一百纳米,而这与极其缓慢的固体体积扩散速率是不相符的。
(3) 非晶质层与次生矿物相沉淀时伴有较大的孔隙,对于次生矿物相孔隙的形成过程可参考(Putnis,2009;Pollok et al., 2011)。
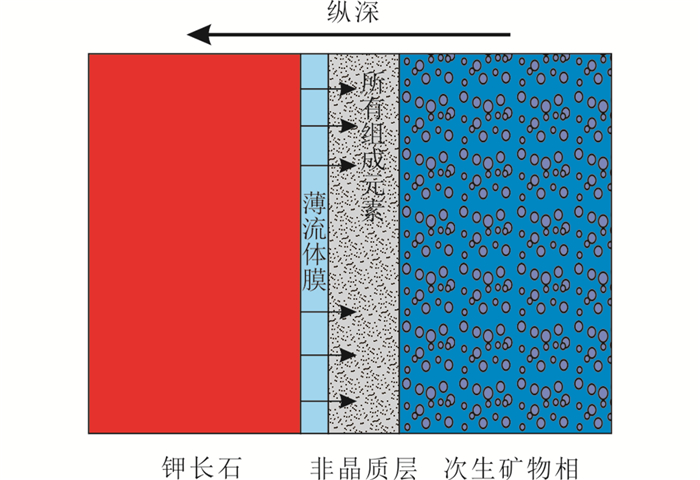
CIDR的过程如图 9所示:
|
图 9 界面溶解-再沉淀机制(CIDR) 红色-原生钾长石; 浅蓝色-薄流体膜; 灰色-非晶质层; 蓝色-次生矿物相 Fig. 9 Coupled interface dissolution-reprecipitation mechanism Red-K-feldspar; light blue-thin fluid film; light grey-amorphous surface layer; blue-secondary mineral phases |
(1) 在薄流体膜与原生矿物钾长石接触时溶解作用就立即开始。所有组成原子以相同化学计量速率释放至薄流体膜内,与pH无关,不受扩散和优先淋滤的控制。
(2) 表面蚀变层形成,即多孔的非晶质的沉淀。孔隙的形成保证薄流体膜与钾长石反应界面的接触,从而在内外界面之间传输化学反应物和产物。
(3) 次生矿物相的沉淀是相对独立的。形成的非晶质沉淀是次生矿物相的前驱体,即非晶质态先沉淀,随之次生矿物相从非晶质物质中沉淀。即使主体溶液相对于次生矿物相不饱和,也不影响沉淀相的生成,这是由于与原生钾长石矿物直接接触的薄流体膜具有不同于主体流体的物理化学和流变特性。
(4) 随着反应进程的加快,由于液固比的不断降低,次生矿物相相对于主体溶液饱和时,开始大量结晶沉淀,随后冷却,最终形成托贝莫来石、水钙铝榴石、方解石等。
CIDR首次解释了作者在本研究中观察到的许多显著特征(图 9)。CIDR中溶解和沉淀的同时性是指原生矿物的溶解和非晶质层的再沉淀同时发生。次生矿物相的形成相对独立,一般认为由非晶质沉淀结晶而来。以上的这几个特征将CIDR与当前化学风化的概念尤其是“淋滤层模型”区分开来。O'Neil and Taylor(1967)首次用CIDR来解释钾-钠长石的交代作用。后来越来越多的实验室以及自然环境下矿物交代作用的研究都表明,CIDR是一种控制所有水-矿物反应的普遍的现象,可以用来解释实验室条件下简单的蚀变反应以及自然界复杂的风化过程(Fiebig and Hoefs, 2002;Harlov et al., 2002, 2005;Putnis, 2002, 2009;Harlov and Förster,2003;Hellmann et al., 2003, 2012, 2015;Labotka et al., 2004;Putnis and Mezger, 2004;Putnis,2005;Geisler et al., 2007;Hövelmann et al., 2010)。
3.2 次生矿物相——托贝莫来石的显微结构与其特性基于CIDR,托贝莫来石形成于钾长石碱性蚀变的后期,即次生矿物相的结晶沉淀阶段。由于非晶质层和次生矿物相的多孔性,为流体和物质的运移提供了通道,使得反应得以持续进行,同时这种多孔性也使蚀变产物托贝莫来石具有特殊的显微结构和物理化学特性。
研究表明托贝莫来石作为层状铝硅酸盐,离子交换容量约为0.7meq·g-1(Komarneni and Roy, 1983;Komarneni et al., 1987;Galvánková et al., 2016),比表面积约为24m2/g(张盼和马鸿文,2005)。较大的比表面积和良好的离子交换容量使得托贝莫来石具有良好的吸附性。因此,托贝莫来石不仅可以作为吸附材料(Merlino et al., 2008;Churakov,2009;Guo and Shi, 2017;Zou et al., 2018),还可作为催化剂参与有机物的合成及聚合反应(Elmes et al., 2018)。
本实验通过钾长石碱性蚀变合成的托贝莫来石,呈典型的放射状-纤维状结构,并呈无规则的交织排列。这些纤维状结构使其较反应前同体积钾长石的比表面积相比显著增大。通过测试,蚀变产物(包括托贝莫来石和水钙铝榴石等)整体比表面积比反应前的钾长石比表面积增大了近3倍(BETN2(m2/g)(未反应的钾长石),4.0;BETN2(m2/g)(蚀变产物),11.0)。然而实际上与原生钾长石相比,托贝莫来石比表面积增大值不止3倍。如果将单个托贝莫来石晶体看作圆柱状(图 5c中纤维状的托贝莫来石晶体长约266nm,直径约32nm),那么通过计算可以得出其表面积是同等体积立方体硅酸盐的8倍,比表面积显著增大。具体的计算公式如下:
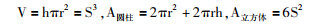
|
蚀变产物比表面积的增加不仅与托贝莫来石自身较大的比表面积有关,也和托贝莫来石互相交织形成无规则形状的纳米孔隙有关。这些孔隙可能是水岩反应过程中由于流体的迁移和生成含水矿物体积增大形成的(Tutolo et al., 2016)。具体而言,水化硅酸钙凝胶(C-S-H gel)向结晶度较高的晶体转化导致体积收缩而形成托贝莫来石晶体间的孔隙结构。由于水化硅酸钙凝胶的普遍密度为2g/cm3,有的甚至为1g/cm3,而托贝莫来石的密度为2.4g/cm3,因此水化硅酸钙凝胶向托贝莫来石转化时体积至少收缩16%(雷永胜等,2014)。因此温度越高,反应时间越长收缩越明显,晶体相越致密,孔隙也就越大。这些孔隙不仅是流体发生化学反应并发生演变的重要场所,还可以为其中的离子、气体和其他固体颗粒提供储存空间(Anovitz and Cole, 2015)。本研究中托贝莫来石孔隙直径的统计结果(图 8)与张盼和马鸿文(2005)所测得的结果(20~100nm)稍有不同。
3.3 钾长石蚀变作用对流体性质的影响在气体-水-岩石/矿物蚀变系统中,孔隙和通道是流体形成、迁移和变化的重要场所(Anovitz and Cole, 2015)。前人对纳米孔隙以及纳米通道对流体的物理化学性质进行了研究,提出在一些尺寸小于100nm的孔隙中,纳米空间限域效应(nanoconfinement)会使其中气体(如CO2,CH4等)以及离子的溶解度增加(Turner et al., 2002;Ferreira et al., 2012)。不仅如此,一些实验表明纳米孔隙可以影响流体中的化学平衡和矿物的离子吸附性(Santiso and Firoozabadi, 2006;Abbas et al., 2008)。
长石蚀变受多种因素的影响,除受自身晶体结构的影响外,也受到外界因素的影响,如温度、周围流体的pH、流体中的离子种类及酸的种类等。研究表面,在相同温度、压力、溶液pH及离子强度相等的条件下,钾长石分别和不同的碱液Ca(OH)2、NaOH、KOH反应,长石表面蚀变程度差异较大(Liu et al., 2015)。其中经Ca(OH)2蚀变的钾长石表面产生了大量的次生矿物,而经NaOH和KOH蚀变的钾长石表面无明显变化。EDS能谱结果显示经NaOH和KOH蚀变的钾长石表面原子成分比例和原生钾长石接近。本研究中次生矿物特别是托贝莫来石中大量纳米级孔隙通道的存在,使得钾长石周围溶液中Ca2+能够快速达到反应界面,和界面处溶解的K、Al、Si元素沉淀生成硅(铝)酸盐水合物。因此,蚀变产物中孔隙的存在,显著增加了产物的比表面积,使得矿物-流体具有更大的接触面积,单位体积矿物参与流体化学反应的机率也相应增加。同时,也正是这些孔隙结构的存在,使得CIDR过程得以持续进行,并在反应后期形成大量次生矿物相。
然而,钾长石蚀变过程也会对周围的流体产生影响。例如,溶出实验数据表明,和原生钾长石相比,蚀变后水溶液中的K、Al、Si离子浓度明显提高。尽管并没有对钾长石蚀变后的微量元素进行溶出测试,但可以推断经CIDR控制的水热蚀变过程后,一些微量元素从钾长石的晶体结构释放迁出后并没有再次沉淀结晶,而是进入溶液中并随之迁移。这些元素的迁出、迁移过程和自然界水岩蚀变作用及元素迁移规律是十分相似的。
4 结论(1) 在极端碱性条件下(190℃,24小时,m钾长石:mCaO=1:1,水固比为5,初始pH值为12.4),钾长石的水热蚀变产物具有复杂的矿物学和化学性质。其产物组成主要为托贝莫来石、水钙铝榴石和碳酸钙的混合物。其中托贝莫来石为铝代产物。
(2) 高分辨透射电镜研究结果表明,次生矿物相与钾长石之间形成了截然的晶质-非晶质界面,非晶物质为纳米级的多孔非晶质层。非晶质层的微观特征反映了钾长石碱性蚀变过程受界面溶解-再沉淀机制(CIDR)的控制。
(3) 蚀变产物托贝莫来石的孔隙结构研究结果表明,托贝莫来石的孔隙直径为0~160nm,平均孔隙直径约为40nm。托贝莫来石中的纳米孔隙和纳米通道,可能会影响其周围流体的化学平衡。正是这些孔隙结构的存在,使得界面溶解-再沉淀(CIDR)过程得以持续进行,并在反应后期形成大量次生矿物相。此外,基于其特殊的孔隙结构,托贝莫来石可以吸附和交换离子,通过对钾长石蚀变机制的研究,可以更好地控制反应条件,提高其蚀变产物托贝莫来石的性能,使其作为吸附材料和催化剂更好的应用于相关领域。同时也为自然界中长石蚀变形成的层状铝硅酸盐对周围流体性质的影响提供了重要依据。
致谢 XRD测试得到了法国格勒诺布尔大学地球科学研究所(ISTerre)B. Lanson的帮助;德国亥姆霍兹波茨坦中心(GFZ)提供了FIB、FESEM和TEM测试时间;两位匿名审稿专家对本文提出了宝贵的修改意见;在此一并表示感谢!
Abbas M, Nadeem R, Zafar MN and Arshad M. 2008. Biosorption of chromium (Ⅲ) and chromium (Ⅵ) by untreated and pretreated Cassia fistula biomass from aqueous solutions. Water, Air, and Soil Pollution, 191(1-4): 139-48 DOI:10.1007/s11270-007-9613-8 |
Anovitz LM and Cole DR. 2015. Characterization and analysis of porosity and pore structures. Reviews in Mineralogy and Geochemistry, 80(1): 61-164 DOI:10.2138/rmg.2015.80.04 |
Arnold GW, Westrich HR and Casey WH. 1992. Application of ion beam analysis (RBS and ERD) to the surface chemistry study of leached minerals. Nuclear Instruments and Methods in Physics Research Section B:Beam Interactions with Materials and Atoms, 64(1-4): 542-546 DOI:10.1016/0168-583X(92)95530-5 |
Bandstra JZ, Buss HL, Campen RK, Liermann LJ, Moore J, Hausrath EM, Navarre-Sitchler AK, Jang JH and Brantley SL. 2007. Appendix: Compilation of mineral dissolution rates. In: Brantley SL, Kubicki JD and White AF (eds.). Kinetics of Water Rock Interactions. New York: Springer, 737-823
|
Blum AE and Stillings LL. 1995. Feldspar dissolution kinetics. Reviews in Mineralogy and Geochemistry, 31(1): 291-351 |
Churakov SV. 2009. Structure of the interlayer in normal 11Å tobermorite from an Ab initio study. European Journal of Mineralogy, 21(1): 261-271 DOI:10.1127/0935-1221/2009/0021-1865 |
Ciceri D and Allanore A. 2015. Microfluidic leaching of soil minerals:Release of K+ from K Feldspar. PLoS One, 10(10): e0139979 DOI:10.1371/journal.pone.0139979 |
Ciceri D, De Oliveira M and Allanore A. 2017. Potassium fertilizer via hydrothermal alteration of K-feldspar ore. Green Chemistry, 19(21): 5187-5202 DOI:10.1039/C7GC02633A |
Doebelin N and Kleeberg R. 2015. Profex:A graphical user interface for the Rietveld refinement program BGMN. Journal of Applied Crystallography, 48(5): 1573-1580 DOI:10.1107/S1600576715014685 |
Elmes VK, Edgar BN, Mendham AP and Coleman NJ. 2018. Basic metallosilicate catalysts from waste green container glass. Ceramics International, 44(14): 17069-17073 DOI:10.1016/j.ceramint.2018.06.151 |
Fenter P and Sturchio NC. 2004. Mineral-water interfacial structures revealed by synchrotron X-ray scattering. Progress in Surface Science, 77(5-8): 171-258 DOI:10.1016/j.progsurf.2004.12.001 |
Fenter P, Lee SS, Park C, Catalano JG, Zhang Z and Sturchio NC. 2010. Probing interfacial reactions with X-ray reflectivity and X-ray reflection interface microscopy:Influence of NaCl on the dissolution of orthoclase at POH2 and 85℃. Geochimica et Cosmochimica Acta, 74(12): 3396-3411 DOI:10.1016/j.gca.2010.03.027 |
Ferreira DR, Schulthess CP and Giotto MV. 2012. An investigation of strong sodium retention mechanisms in nanopore environments using nuclear magnetic resonance spectroscopy. Environmental Science & Technology, 46(1): 300-306 |
Fiebig J and Hoefs J. 2002. Hydrothermal alteration of biotite and plagioclase as inferred from intragranular oxygen isotope-and cation-distribution patterns. European Journal of Mineralogy, 14(1): 49-60 DOI:10.1127/0935-1221/2002/0014-0049 |
Fu WJ and Liu WB. 1996. Study on the alteration of feldspar from clastic rock in Tarim Basin. Acta Sedimentologica Sinica, 14(Suppl.1): 84-89 (in Chinese) |
Galvánková L, Másilko J, Solny T and Štěpánková E. 2016. Tobermorite synthesis under hydrothermal conditions. Procedia Engineering, 151: 100-107 DOI:10.1016/j.proeng.2016.07.394 |
Geisler T, Schaltegger U and Tomaschek F. 2007. Re-equilibration of zircon in aqueous fluids and melts. Elements, 3(1): 43-50 DOI:10.2113/gselements.3.1.43 |
Guo XL and Shi HS. 2017. Microstructure and heavy metal adsorption mechanisms of hydrothermally synthesized Al-substituted tobermorite. Materials and Structures, 50(6): 245 DOI:10.1617/s11527-017-1100-0 |
Harlov DE, Förster HJ and Nijland TG. 2002. Fluid-induced nucleation of (Y+REE)-phosphate minerals within apatite:Nature and experiment. Part Ⅰ:Chlorapatite. American Mineralogist, 87(2-3): 245-261 DOI:10.2138/am-2002-2-306 |
Harlov DE and Förster HJ. 2003. Fluid-induced nucleation of (Y+REE)-phosphate minerals within apatite:Nature and experiment. Part Ⅱ:Fluorapatite. American Mineralogist, 88(8-9): 1209-1229 |
Harlov DE, Wirth R and Förster HJ. 2005. An experimental study of dissolution-reprecipitation in fluorapatite:Fluid infiltration and the formation of monazite. Contributions to Mineralogy and Petrology, 150(3): 268-286 DOI:10.1007/s00410-005-0017-8 |
Hellmann R, Crepar DA and Zhang RH. 1989. Albite feldspar hydrolysis to 300℃. Solid State Ionics, 32-33: 314-329 DOI:10.1016/0167-2738(89)90236-1 |
Hellmann R. 1994. The albite-water system:Part Ⅰ. The kinetics of dissolution as a function of pH at 100, 200 and 300℃. Geochimica et Cosmochimica Acta, 58(2): 595-611 DOI:10.1016/0016-7037(94)90491-X |
Hellmann R. 1995. The albite-water system:Part Ⅱ. The time-evolution of the stoichiometry of dissolution as a function of pH at 100, 200, and 300℃. Geochimica et Cosmochimica Acta, 59(9): 1669-1697 DOI:10.1016/0016-7037(95)00075-B |
Hellmann R, Penisson JM, Hervig RL, Thomassin JH and Abrioux MF. 2003. An EFTEM/HRTEM high-resolution study of the near surface of labradorite feldspar altered at acid pH:Evidence for interfacial dissolution-reprecipitation. Physics and Chemistry of Minerals, 30(4): 192-197 DOI:10.1007/s00269-003-0308-4 |
Hellmann R, Wirth R, Daval D, Barnes JP, Penisson JM, Tisserand D, Epicier T, Florin B and Hervig RL. 2012. Unifying natural and laboratory chemical weathering with interfacial dissolution-reprecipitation:A study based on the nanometer-scale chemistry of fluid-silicate interfaces. Chemical Geology, 294-295: 203-216 DOI:10.1016/j.chemgeo.2011.12.002 |
Hellmann R, Cotte S, Cadel E, Malladi S, Karlsson LS, Lozano-Perez S, Cabié M and Seyeux A. 2015. Nanometre-scale evidence for interfacial dissolution-reprecipitation control of silicate glass corrosion. Nature Materials, 14(3): 307-311 DOI:10.1038/nmat4172 |
Henmi C and Kusachi I. 1992. Clinotobermorite, Ca5Si6(O, OH)18·5H2O:A new mineral from Fuka, Okayama prefecture, Japan. Mineralogical Magazine, 56(384): 353-358 DOI:10.1180/minmag.1992.056.384.07 |
Hövelmann J, Putnis A, Geisler T and Schmid BC and Golla-Schindler U. 2010. The replacement of plagioclase feldspars by albite:Observations from hydrothermal experiments. Contributions to Mineralogy and Petrology, 159(1): 43-59 DOI:10.1007/s00410-009-0415-4 |
Klein C and Philpotts AR. 2013. Earth materials: Introduction to mineralogy and petrology. In: Klein C and Philpotts AR (eds.). Earth Materials. New York: Cambridge University Press
|
Knight AW, Kalugin NG, Coker E and Ilgen AG. 2019. Water properties under nano-scale confinement. Scientific Reports, 9(1): 8246 DOI:10.1038/s41598-019-44651-z |
Komarneni S and Roy DM. 1983. Tobermorites:A new family of cation exchangers. Science, 221(4611): 647-648 DOI:10.1126/science.221.4611.647 |
Komarneni S, Miyake M and Roy R. 1987. Cation-exchange properties of (Al+Na)-substituted synthetic tobermorites. Clays and Clay Minerals, 35(5): 385-390 DOI:10.1346/CCMN.1987.0350509 |
Labotka TC, Cole DR, Fayek M, Riciputi LR and Stadermann FJ. 2004. Coupled cation and oxygen-isotope exchange between alkali feldspar and aqueous chloride solution. American Mineralogist, 89(11-12): 1822-1825 DOI:10.2138/am-2004-11-1229 |
Lasaga AC. 1984. Chemical kinetics of water-rock interactions. Journal of Geophysical Research:Solid Earth, 89(B6): 4009-4025 DOI:10.1029/JB089iB06p04009 |
Lei YS, Han T, Wang HQ, Jin XZ, Yang F, Cao HH and Cheng FQ. 2014. Preparation and characterization of Calcium Silicate Hydrate (C-S-H) synthesized by the hydrothermal method. Bulletin of the Chinese Ceramic Society, 33(3): 465-469 (in Chinese with English abstract) |
Liu J and Qin S. 2001. The role of layer silicates in preventing and controlling environmental heavy metal pollution. Acta Petrologica et Mineralogica, 20(4): 461-466 (in Chinese with English abstract) |
Liu SK, Han C, Liu JM and Li H. 2015. Hydrothermal decomposition of potassium feldspar under alkaline conditions. RSC Advances, 5(113): 93301-93309 DOI:10.1039/C5RA17212H |
Liu SK, Han C and Liu JM. 2018. Study of K-feldspar and lime hydrothermal reaction at 190℃:Phase, kinetics and mechanism with reaction time. ChemistrySelect, 3(46): 13010-13016 DOI:10.1002/slct.201802763 |
Liu SK, Han C and Liu JM. 2019. Study of K-Feldspar and lime hydrothermal reaction:Phase and mechanism with reaction temperature and increasing Ca/Si ratio. Minerals, 9(1): 46 |
Livingstone A. 1988. Reyerite, tobermorite, calcian analcime and bytownite from amygdales in a Skye basalt. Mineralogical Magazine, 52(368): 711-713 DOI:10.1180/minmag.1988.052.368.18 |
Manning DAC. 2010. Mineral sources of potassium for plant nutrition. Agronomy for Sustainable Development, 30(2): 281-294 DOI:10.1051/agro/2009023 |
Marry V, Rotenberg B and Turq P. 2008. Structure and dynamics of water at a clay surface from molecular dynamics simulation. Physical Chemistry Chemical Physics, 10(32): 4802-4813 DOI:10.1039/b807288d |
Merlino S, Bonaccorsi E, Merlini M, Marchetti F and Garra W. 2008. Tobermorite 11Å and its synthetic counterparts: Structural relationships and thermal behavior. In: Krivovichev SV (ed.). Minerals as Advanced Materials I. Berlin: Springer: 37-44
|
O'Neil JR and Taylor Jr HP. 1967. The oxygen isotope and cation exchange chemistry of feldspars. American Mineralogist, 52(9-10): 1414-1437 |
Pollok K, Putnis CV and Putnis A. 2011. Mineral replacement reactions in solid solution-aqueous solution systems:Volume changes, reactions paths and end-points using the example of model salt systems. American Journal of Science, 311(3): 211-236 DOI:10.2475/03.2011.02 |
Putnis A. 2002. Mineral replacement reactions:From macroscopic observations to microscopic mechanisms. Mineralogical Magazine, 66(5): 689-708 DOI:10.1180/0026461026650056 |
Putnis A. 2009. Mineral replacement reactions. Reviews in Mineralogy and Geochemistry, 70(1): 87-124 DOI:10.2138/rmg.2009.70.3 |
Putnis CV and Mezger K. 2004. A mechanism of mineral replacement:Isotope tracing in the model system KCl-KBr-H2O. Geochimica et Cosmochimica Acta, 68(13): 2839-2848 DOI:10.1016/j.gca.2003.12.009 |
Putnis CV, Tsukamoto K and Nishimura Y. 2005. Direct observations of pseudomorphism:Compositional and textural evolution at a fluid-solid interface. American Mineralogist, 90(11-12): 1909-1912 DOI:10.2138/am.2005.1990 |
Ruiz-Agudo E, Putnis CV, Rodriguez-Navarro C and Putnis A. 2012. Mechanism of leached layer formation during chemical weathering of silicate minerals. Geology, 40(10): 947-950 DOI:10.1130/G33339.1 |
Santiso E and Firoozabadi A. 2006. Curvature dependency of surface tension in multicomponent systems. AIChE Journal, 52(1): 311-322 DOI:10.1002/aic.10588 |
Schepers A and Milsch H. 2013. Dissolution-precipitation reactions in hydrothermal experiments with quartz-feldspar aggregates. Contributions to Mineralogy and Petrology, 165(1): 83-101 |
Skorina T and Allanore A. 2015. Aqueous alteration of potassium-bearing aluminosilicate minerals:From mechanism to processing. Green Chemistry, 17(4): 2123-2136 DOI:10.1039/C4GC02084G |
Su SQ, Ma HW and Chuan XY. 2015. Hydrothermal decomposition of K-feldspar in KOH-NaOH-H2O medium. Hydrometallurgy, 156: 47-52 DOI:10.1016/j.hydromet.2015.05.014 |
Turner DD, Ferrare RA, Brasseur LAH, Feltz WF and Tooman TP. 2002. Automated retrievals of water vapor and aerosol profiles from an operational Raman lidar. Journal of Atmospheric and Oceanic Technology, 19(1): 37-50 DOI:10.1175/1520-0426(2002)019<0037:AROWVA>2.0.CO;2 |
Tutolo BM, Mildner DFR, Gagnon CVL, Saar MO and Seyfried Jr WE. 2016. Nanoscale constraints on porosity generation and fluid flow during serpentinization. Geology, 44(2): 103-106 |
Wirth R. 2009. Focused Ion Beam (FIB) combined with SEM and TEM:Advanced analytical tools for studies of chemical composition, microstructure and crystal structure in geomaterials on a nanometre scale. Chemical Geology, 261(3-4): 217-229 DOI:10.1016/j.chemgeo.2008.05.019 |
Yuan GH, Cao YC, Schulz HM, Hao F, Gluyas J, Liu KY, Yang T, Wang YZ, Xi KL and Li FL. 2019. A review of feldspar alteration and its geological significance in sedimentary basins:From shallow aquifers to deep hydrocarbon reservoirs. Earth-Science Reviews, 191: 114-140 DOI:10.1016/j.earscirev.2019.02.004 |
Zhai YY, Hellmann R, Robin E, Findling N, Mayanna S, Wirth R, Schreiber A, Cabié M, Zeng QD, Liu SK and Liu JM. 2020. The nanometer-scale mechanism of hydrothermal alkaline alteration of feldspar to produce potassium fertilizer. Chemical Geology, under review
|
Zhang P and Ma HW. 2005. The synthesis of tobermorite from potassium feldspar powder:An experimental study. Acta Petrologica et Mineralogica, 24(4): 333-338 (in Chinese with English abstract) |
Zou JJ, Guo CB, Zhou XQ, Sun YJ and Yang Z. 2018. Sorption capacity and mechanism of Cr3+ on tobermorite derived from fly ash acid residue and carbide slag. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 538: 825-833 DOI:10.1016/j.colsurfa.2017.11.073 |
伏万军, 刘文彬. 1996. 塔里木盆地碎屑岩中钾长石的蚀变作用. 沉积学报, 14(增1): 84-89. |
雷永胜, 韩涛, 王慧奇, 靳秀芝, 杨芳, 曹红红, 程芳琴. 2014. 水热合成水化硅酸钙(C-S-H)的制备与表征. 硅酸盐通报, 33(3): 465-469. |
张盼, 马鸿文. 2005. 利用钾长石粉体合成雪硅钙石的实验研究. 岩石矿物学杂志, 24(4): 333-338. |
 2020, Vol. 36
2020, Vol. 36


