文章信息
- 张武君, 刘保财, 陈菁瑛, 赵云青, 黄颖桢, 程远航
- ZHANG Wujun, LIU Baocai, CHEN Jingying, ZHAO Yunqing, HUANG Yingzhen, CHENG Yuanhang
- 生境对书峰乡马蓝叶片生理指标及药效成分的影响
- Effects of cultivation habitat on leaf physiology and medicinal components of Baphicacanthus cusia in Shufeng Township
- 亚热带农业研究, 2021, 17(2): 108-114
- Subtropical Agriculture Research, 2021, 17(2): 108-114.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2021.02.007
-
文章历史
- 收稿日期: 2021-04-22
2. 福建省农业科学院药用植物研究中心, 福建 福州 350003
2. Research Center for Medicinal Plant, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China
马蓝[Baphicacanthus cusia (Nees) Bremek.]为爵床科多年生草本植物,广泛分布于我国华东、华南及西南地区,其叶干燥后可做南大青叶使用;茎、叶加工炮制成中药材青黛,具有清热解毒、凉血消斑和泻火定惊的功效;根茎和根可作为南板蓝根入药[1]。马蓝叶的主要药效成分为靛玉红、靛蓝、吲哚苷、靛红等吲哚类生物碱和色胺酮等喹唑啉类生物碱。靛玉红临床可用于治疗慢性粒细胞白血病[2];靛蓝既可作染料又具有抗紫外线、抗氧化、抗菌消炎等作用[3];色胺酮具有较强的抑菌作用,也有一定的抗炎作用[4]。当前对马蓝的研究主要集中在药效成分形成与积累的分子机制上[5-6],有关栽培生境的研究较少。宁书菊等[7]比较了3种光照强度对马蓝光合特性的影响,发现30%自然光照下的间作套种或林下栽培有利其生长。覃军等[8]比较了全阴、半阴、露地条件下马蓝的生长和靛玉红含量,发现全阴及半阴条件更适宜马蓝的种植。
福建省仙游县书峰乡为高品质青黛的道地产区,马蓝栽培和青黛加工已有800多年历史,所产青黛质量居同类产品之冠,素有“建青黛”美称,为福建省大宗道地药材之一[9]。本调查发现,该地区主要在山间田地或林下套种马蓝,以阳生和半阴生为主,少量种植于坡底或密林下形成的阴生生境中。栽培生境中的光照强度以及当地农民的种植方式是影响马蓝栽培和青黛品质的主要因素。陈文其[10]认为,“建青黛”品质优良有赖于其植物基原爵床科马蓝独特的栽培生境及近千年的人工驯化栽培。有关仙游县书峰乡不同栽培生境下马蓝植株的生理及药效成分差异尚未见报道。因此,本研究比较了书峰乡3种栽培生境下马蓝叶片形态、生理与药效成分等的差异,探究影响其生理及药效成分含量的因素,旨在为书峰乡马蓝的生态栽培和青黛产量品质的提升提供依据。
1 材料与方法 1.1 试验设计供试马蓝为2018年越冬的植株在2019年生发的新枝,种植于仙游县书峰乡四黄村(118°39′79″E, 25°26′51″N),海拔400 m左右。该地属亚热带海洋性季风气候,全年无霜期340 d,年平均气温16~28 ℃,年平均降雨量1 700~2 400 mm,土层深厚,土壤肥沃,水源清澈、无污染。本试验设3个生境,每个生境种植3个小区,小区面积10 m2,每小区种植100株,株行距30 cm×30 cm,种植和田间管理按当地常规进行。3个栽培生境如下。①阳生:种植在山间田地,上午100%自然光照,午后有高山阴影遮盖,幼苗期或采收后用稻草在距畦面约30 cm高处搭盖遮阴,随着植株长高,稻草自然干枯掉落,采样时已无遮阴;②半阴生,种植在桉树林下,40%左右自然光照;③阴生:种植在背阴坡林下,3%~5%自然光照。参照陈宗樑等[11]的采收要求,于2019年7月30日进行第1次采样;9月30日即当年最后一次收割时进行第2次采样。
1.2 测定项目及方法 1.2.1 形态与生理指标各生境每小区随机选取40株,每株取顶端向下第2节的成熟叶1片,10片叶用于形态测定、30片用于生理指标测定。叶片长、宽采用刻度尺测量,单叶质量采用电子天平测量,以每小区随机摘取的10片叶子测得的平均值为一个重复。参考文献[12],含水量测定采用常压烘干法;叶绿素、类胡萝卜素测定采用95%(体积分数)乙醇提取法;丙二醛(MDA)含量采用硫代巴比妥酸法;可溶性糖含量测定采用蒽酮比色法;脯氨酸含量测定采用酸性茚三酮法;过氧化物酶(POD)活性测定采用愈创木酚法。参考试剂盒说明(南京建成生物研究所),可溶性蛋白含量测定采用BCA法;超氧化物歧化酶(SOD)活性测定采用羟胺法。每个指标重复测定3次,取平均值。
1.2.2 药效成分含量各生境每小区随机取10株马蓝,将全部叶片置于60 ℃下烘干、磨粉,过80目筛后用于药效成分测定。靛玉红、靛蓝、色胺酮和吲哚苷含量采用1260高效液相色谱仪(Agilent公司)测定,精密称取0.5 g左右马蓝叶片样品粉末于三角烧瓶中,准确加入70%(体积分数)甲醇30 mL,30 ℃恒温超声提取40 min(功率100 W,频率50 kHz),摇匀,过0.45 μm微孔滤膜,取滤液作为供试品。色谱条件:Ultimate XB-C18色谱柱(4.6 mm×150 mm, 3 μm),流动相为甲醇(A)-水(B), 梯度洗脱(0~5 min, 8%~8% A;5~8 min,8%~20% A;8~11 min,20%~22% A;11~13 min,22%~22% A;13~18 min,22%~30% A;18~23 min,30%~45% A;23~33 min,45%~60% A;33~48 min,60%~80% A;48~58 min,80%~100% A;58~68 min,100%~8% A),流速1 mL·min-1,检测波长为280 nm,柱温30 ℃,进样量20 μL。方法学考察试验结果表明,相邻峰之间的分离度均大于1.5,精密度、重复性和稳定性均符合试验要求。
1.3 统计分析采用SPSS 19.0软件对试验数据进行方差分析。若差异显著(P<0.05),则采用Ducan′s新复极差法检验各组数据间的差异性。数据采用“平均值±标准差”表示。采用Excel 2010软件绘制图表。
2 结果与分析 2.1 栽培生境对马蓝叶片形态和含水量的影响由表 1可知,3种生境两次采样的马蓝叶宽、单叶质量和含水量变化均为:阴生>半阴生>阳生,差异达显著水平。与阳生马蓝相比,7月30日采样的半阴生、阴生马蓝叶长分别增长22.34%、49.27%,叶宽分别增长29.55%、56.79%;单叶质量分别增长40.45%、86.73%,含水量分别增长1.70%、6.33%;9月30日采样的半阴生、阴生马蓝叶长分别增长25.40%、32.89%,叶宽分别增长35.80%、53.85%;单叶质量分别增长62.22%、86.67%,含水量分别增长2.31%、11.87%。以上表明,低光照强度的生境有利于马蓝叶片生长。从表 1还可见,9月30日采样的数值均低于7月30日,可能受到降雨量减少的影响。2019年7月,当地阴雨天有27 d,而8—9月降雨量持续降低,9月仅12 d阴雨天,且采样前数日均为晴天。
| 采样日期 | 生境 | 叶长/cm | 叶宽/cm | 单叶质量/g | 含水量/% |
| 7月30日 | 阳生 | 10.51±0.42c | 4.32±0.21c | 0.72±0.05c | 78.77±0.26c |
| 半阴生 | 12.85±0.55b | 5.60±0.11b | 1.01±0.09b | 80.11±0.24b | |
| 阴生 | 15.68±0.59a | 6.77±0.32a | 1.34±0.13a | 83.76±0.04a | |
| 9月30日 | 阳生 | 9.88±0.32b | 3.38±0.14c | 0.45±0.06c | 71.75±0.19c |
| 半阴生 | 12.39±0.46a | 4.59±0.12b | 0.73±0.04b | 73.41±0.39b | |
| 阴生 | 13.13±0.20a | 5.20±0.12a | 0.84±0.01a | 80.27±0.23a | |
| 1)同列数值后附不同小写字母者表示同时期样品差异达0.05显著水平。 | |||||
从表 2可见,3种生境两次采样的马蓝叶片总叶绿素含量变化均表现为:阴生>半阴生>阳生,差异达显著水平。与阳生马蓝相比,7月30日采样的半阴生、阴生马蓝总叶绿素分别提高了66.89%、102.03%;9月30日采样的半阴生、阴生马蓝总叶绿素分别提高了34.31%、91.24%。两次采样的叶绿素a/叶绿素b均为阴生马蓝叶片显著小于阳生和半阴生;类胡萝卜素/总叶绿素均为:阳生>半阴生>阴生,且三者差异显著。从表 2还可见,9月30日各生境测得的光合色素含量均低于7月30日,可能与干旱或植株衰老有关。这与武云杰等[13]、柴胜丰等[14]发现的衰老和干旱情况会导致叶绿素和类胡萝卜素含量下降的研究结果相同。
| 采样日期 | 生境 | ||||
| 7月30日 | 阳生 | 1.48±0.14c | 0.21±0.01b | 1.78±0.05a | 0.143±0.007a |
| 半阴生 | 2.47±0.06b | 0.25±0.02a | 1.85±0.03a | 0.101±0.006b | |
| 阴生 | 2.99±0.04a | 0.22±0.01b | 1.65±0.05b | 0.074±0.004c | |
| 9月30日 | 阳生 | 1.37±0.03c | 0.18±0.01a | 1.70±0.09a | 0.130±0.001a |
| 半阴生 | 1.84±0.08b | 0.18±0.01a | 1.75±0.03a | 0.098±0.003b | |
| 阴生 | 2.62±0.04a | 0.13±0.02b | 1.45±0.07b | 0.049±0.007c | |
| 1)同列数值后附不同小写字母者表示同时期样品差异达0.05显著水平。 | |||||
遭遇环境胁迫会引起植物体内自由基水平的升高,加剧膜脂过氧化,导致MDA含量上升[15]。SOD酶、POD酶活性提高能起到减少自由基的作用[16]。(1)由图 1可知,不同生境下两次采样的马蓝叶片MDA含量变化表现为:阳生>半阴生>阴生,阳生与半阴生、阴生差异均达到显著水平,表明阳生马蓝叶的细胞膜较其他栽培生境受损严重。(2)由图 1还可知,不同生境下两次采样的马蓝叶片SOD酶活性为:阴生>阳生>半阴生,且差异达显著水平;POD酶活性为:阴生>半阴生>阳生,其中阴生与阳生的差异达到显著水平。SOD、POD的变化与MDA不一致,可能在于长期的强光或干旱胁迫导致活性氧产生速度大于清除速度,造成抗氧化系统的不可逆损伤。何天友等[17]研究表明,在严重或长期胁迫条件下植物体内的活性氧清除酶活性可能出现下降趋势。

|
不同小写字母者表示同时期样品差异达0.05显著水平。 图 1 不同栽培生境下马蓝叶片MDA含量及SOD和POD酶活性比较 Figure 1 Comparison on MDA contents and activities of SOD and POD of B.cusia leaves in different cultivation habitats |
渗透调节物质对提高植物抗逆能力有重要作用。从图 2可以看出,不同生境下两次采样马蓝叶片的可溶性糖、可溶性蛋白、脯氨酸含量变化除了7月30日采样的半阴生马蓝叶片可溶性蛋白含量略高于阳生外,基本表现为:阳生>半阴生>阴生。阳生和半阴生的渗透调节物质含量均显著高于阴生,表明阳生和半阴生环境可能对马蓝生长造成了一定的胁迫。马蓝叶片的脯氨酸、可溶性蛋白和可溶性糖含量变化与叶片含水量(表 1)变化相反,表明水分胁迫可能是造成不同栽培生境渗透调节物质含量差异的主要原因。9月30日各生境测得的脯氨酸含量是7月30日采样的26~36倍,可能主要与9月晴多雨少有关。脯氨酸是植物细胞内分布最广的有机渗透调节物质,多数植物在干旱胁迫会大量积累[18]。脯氨酸大量积累具有维持细胞渗透平衡、清除活性氧与减轻逆境胁迫对细胞的伤害等作用。
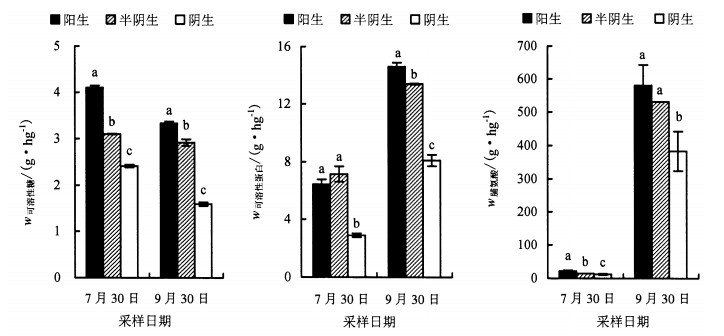
|
不同小写字母者表示同时期样品差异达0.05显著水平。 图 2 不同栽培生境下马蓝叶片可溶性糖、可溶性蛋白和脯氨酸含量比较 Figure 2 Comparison on contents of soluble sugar, soluble protein, proline in B.cusia leaves in different cultivation habitats |
由表 3可见,不同生境下两次采样的马蓝叶片药效成分含量基本表现为:阳生>半阴生>阴生,除了半阴生马蓝7月30日采样的吲哚苷含量和9月30日采样的色胺酮含量显著高于阳生,9月30日采样的吲哚苷显著低于阴生外。两次取样阳生马蓝叶药用成分含量均高于阴生,其中,7月30日采样的阳生马蓝叶片色胺酮含量较阴生约提高7.5倍;9月30日采样的阳生马蓝叶片吲哚苷含量较阴生约提高了5.6倍。由表 3还可见,7月30日采样的马蓝叶片色胺酮含量高于9月30日采样;9月30日阳生和阴生马蓝的吲哚苷、靛蓝、靛玉红含量高于7月30日采样。以上表明,阳生生境更有利于马蓝药效成分的积累,且药效成分含量高低随季节而变化。
| 采样日期 | 生境 | w药效成分/(mg·g-1) | |||
| 吲哚苷 | 靛蓝 | 靛玉红 | 色胺酮 | ||
| 7月30日 | 阳生 | 1.571±0.030b | 0.121±0.001a | 0.199±0.002a | 5.997±0.043a |
| 半阴生 | 1.679±0.042a | 0.102±0.008b | 0.194±0.009a | 1.071±0.004b | |
| 阴生 | 0.685±0.015c | 0.100±0.003b | 0.101±0.003b | 0.704±0.010c | |
| 9月30日 | 阳生 | 5.805±0.017a | 0.207±0.004a | 0.596±0.006a | 0.312±0.004b |
| 半阴生 | 0.624±0.012c | 0.200±0.002a | 0.150±0.001b | 0.396±0.003a | |
| 阴生 | 0.876±0.043b | 0.127±0.004b | 0.127±0.003c | 0.266±0.006c | |
| 1)同列数值后附不同小写字母者表示同时期样品差异达0.05显著水平。 | |||||
本研究在书峰乡马蓝产区调查发现,不同生境下的马蓝叶片形态差异显著。大田种植的马蓝叶片小而黄绿,叶面隆起,搓揉易碎,株形较为紧凑;半阴生与阴生环境下的马蓝叶片则大而深绿,株幅大于阳生。这种随栽培环境不同而改变自身形态和叶绿素含量以应对光能过剩或短缺的特性在木奶果[19]、谢君魔芋[20]等喜荫植物上也有表现。本研究中,马蓝叶片大小表现为:阴生>半阴生>阳生,与朱仁磊[21]的调查研究类似,表明较阴的生境更适合马蓝生长。此外,本研究中MDA含量表现(阳生>半阴生>阴生)与渗透调节物质含量表现(阳生>半阴生>阴生)也可以作为佐证。因此,阴生或半阴生的生境更有利于马蓝的生长。
本研究中,阴生生境下9月30日采样的马蓝叶片大、叶绿素含量高、叶绿素a/叶绿素b和类胡萝卜素/总叶绿素低,与大多数植物遮阴处理的变化规律相同[22],与宁书菊等[7]模拟不同光强获得马蓝的叶片大小和叶绿素含量变化略有不同,可能由于光质和栽培密度不同。孙小玲等[22]研究表明,树木的遮阴不仅会降低光照强度,也会改变光谱组成,导致红光比例降低、蓝光比例增高,而通常试验所用的遮阳网只能降低光照强度,没有改变光谱组成。此外,树林下马蓝种植密度相对更稀疏,植株间遮盖更少也有利于获得更多光能。
3.2 栽培环境对马蓝药效成分积累的影响本调查发现,书峰乡马蓝每年采收2次,一般在端午节后的一个半月进行第1次采收, 中秋节后至立冬前进行第2次采收,采收后留地上部两节。本研究测得9月30日(中秋后17 d)采样的阳生马蓝叶药效成分较7月30日(端午后53 d)采样的高,印证了地道产区农民在中秋前后进行大面积采割,且以采收叶面隆起、搓揉易碎的马蓝(大田种植的马蓝)加工青黛得率更高、品质更好的传统做法。可能原因是野生马蓝一般分布在阴湿环境,阳生环境对其造成胁迫,从而诱导产生更多的次生代谢产物。资源获得假说认为[23],植物在恶劣的自然环境条件下会生长缓慢且次生代谢产物含量高,在良好的自然条件下则会生长较快且次生代谢产物含量低。吲哚苷、靛蓝、靛玉红和色胺酮均为马蓝的次生代谢产物。吲哚苷、靛蓝、靛玉红为吲哚类生物碱。一般认为吲哚的合成主要通过莽草酸途径,莽草酸激酶是莽草酸途径的关键酶。黄玉香[24]研究发现,经紫外线照射后马蓝叶片编码莽草酸激酶的BcSK基因表达上升,或许能从分子层面解释大田种植的马蓝吲哚苷、靛蓝、靛玉红含量更高的原因。
中药材栽培不同于农作物或观赏植物,不仅要考察其产量更要注重品质和药效。本研究表明,马蓝在阴生和半阴生条件下长势更好,但药效成分含量低于阳生条件。“建青黛”道地产区种植的马蓝如用于炮制生产青黛或提取靛蓝、靛玉红、色胺酮,建议在阳生或在能获得较强光照的生境条件下种植,但在生长前期及采割后的恢复生长期需采用适度遮阳处理;若马蓝作为乡村旅游的观赏植物,可在人行道树荫下等弱光环境下种植。
| [1] | QIN J, CHEN Y L, ZHANG D Y, et al. Study on the content of indirubin in the leaves of Baphicacanthus cusia (Nees) Bremek. in different illumination intensities[J]. Medicinal Plant, 2014, 5(2): 9-11, 15. |
| [2] | 杨阳, 浦如月, 冯格, 等. 高效液相色谱法同时测定马蓝根、茎、叶中4种成分的含量及其3种不同干燥方法的评价[J]. 中国医院药学杂志, 2018, 38(2): 120–125. |
| [3] | 林琳, 刁勇, 周心怡, 等. 靛蓝的生物活性研究进展[J]. 染料与染色, 2019, 56(4): 16–18. |
| [4] | AGAFONOVA I G, MOSKOVKINA T V. Studies on anti-inflammatory action of tryptanthrin, using a model of DSS-induced colitis of mice and magnetic resonance imaging[J]. Applied Magnetic Resonance, 2015, 46(7): 781–791. DOI: 10.1007/s00723-015-0674-3 |
| [5] | XU W, ZHANG L B, CUNNINGHAM A B, et al. Blue genome: chromosome-scale genome reveals the evolutionary and molecular basis of indigo biosynthesis in Strobilanthes cusia[J]. The Plant Journal, 2020, 104(4): 864–879. DOI: 10.1111/tpj.14992 |
| [6] | 公培民, 宁书菊, 叶齐, 等. 马蓝色氨酸合成酶基因的克隆、序列及表达分析[J]. 分子植物育种, 2020, 18(3): 873–881. |
| [7] | 宁书菊, 张英娇, 林建勇, 等. 光强对福建马蓝光合特性的影响[J]. 中国生态农业学报, 2012, 20(7): 901–908. |
| [8] | 覃军, 陈奕龙, 张丹雁, 等. 不同光照条件对南大青叶(马蓝叶)中靛玉红含量的影响[J]. 安徽农业科学, 2014, 42(1): 59–60, 62. |
| [9] | 周正, 郭志英, 谭何新, 等. 马蓝种质资源研究进展[J]. 药学实践杂志, 2017, 35(1): 1–4, 16. DOI: 10.3969/j.issn.1006-0111.2017.01.001 |
| [10] | 陈文其. 福建地道药材建青黛优质生产实践[J]. 海峡药学, 2015, 27(10): 25–26. |
| [11] | 陈宗樑, 李金叶, 陈玉谊. 建青黛的栽培及加工方法[J]. 海峡药学, 1999, 11(1): 37–38. |
| [12] | 王学奎. 植物生理生化实验原理和技术[M]. 2版.北京: 高等教育出版社, 2006. |
| [13] | 武云杰, 戚莹, 张小全, 等. 不同烤烟品种叶片衰老与质体色素降解及降解产物含量的关系[J]. 华北农学报, 2015, 30(5): 197–204. |
| [14] | 柴胜丰, 唐健民, 王满莲, 等. 干旱胁迫对金花茶幼苗光合生理特性的影响[J]. 西北植物学报, 2015, 35(2): 322–328. |
| [15] | 余经, 林育钊, 范中奇, 等. 果蔬采后病害的发生与活性氧和膜脂代谢的关系研究进展[J]. 亚热带农业研究, 2020, 16(2): 132–137. |
| [16] | 刘竟运, 林育钊, 范中奇, 等. 活性氧在采后果蔬品质劣变中的作用及其控制技术研究进展[J]. 亚热带农业研究, 2020, 16(1): 52–59. |
| [17] | 何天友, 于增金, 沈少炎, 等. 花吊丝竹对干旱胁迫的光合和生理响应[J]. 森林与环境学报, 2020, 40(1): 68–75. |
| [18] | 邓凤飞, 杨双龙, 龚明. 细胞信号分子对非生物胁迫下植物脯氨酸代谢的调控[J]. 植物生理学报, 2015, 51(10): 1573–1582. |
| [19] | 黄河腾, 黄剑坚, 陈杰, 等. 不同遮阴环境下木奶果幼苗生长与生理生化的响应[J]. 生态学杂志, 2020, 39(5): 1538–1547. |
| [20] | 付忠, 谢世清, 徐文果, 等. 不同光照强度下谢君魔芋的光合作用及能量分配特征[J]. 应用生态学报, 2016, 27(4): 1177–1188. |
| [21] | 朱仁磊. 福建马蓝资源化学及其水分生理学研究[D]. 福州: 福建农林大学, 2011. |
| [22] | 孙小玲, 许岳飞, 马鲁沂, 等. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报, 2010, 34(8): 989–999. |
| [23] | BYERS J E. Effects of body size and resource availability on dispersal in a native and a non-native estuarine snail[J]. Journal of Experimental Marine Biology and Ecology, 2000, 248(2): 133–150. |
| [24] | 黄玉香. 马蓝药效物质形成关键基因的挖掘与功能研究[D]. 泉州: 华侨大学, 2017. |
 2021,Vol. 17
2021,Vol. 17


