文章信息
- 黄秋灿, 施婧, 张雪, 张媛媛, 林晓蓉, 李斌, 陈忠正
- HUANG Qiucan, SHI Jing, ZHANG Xue, ZHANG Yuanyuan, LIN Xiaorong, LI Bin, CHEN Zhongzheng
- 茶树儿茶素合成酶基因DFR的表达特性
- Expression characteristics of the key gene dihydroflavonol 4-reductase (DFR) involved in catechin synthesis in tea plants
- 亚热带农业研究, 2020, 16(3): 185-192
- Subtropical Agriculture Research, 2020, 16(3): 185-192.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2020.03.008
-
文章历史
- 收稿日期: 2020-07-01
2. 广东省功能食品活性物重点实验室, 广东 广州 510642
2. Guangdong Provincial Key Laboratory of Nutraceuticals and Functional Foods, Guangzhou, Guangdong 510642, China
儿茶素是茶树的重要次生代谢物,具有抗氧化、防癌及降低血压、血脂和血糖等功效,发展和应用前景广阔[1]。茶叶中含有丰富的儿茶素,分为表型儿茶素(包括表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯)和非表型儿茶素(包括儿茶素、没食子儿茶素、儿茶素没食子酸酯和没食子儿茶素没食子酸酯)[2]。Kang et al[3]研究发现,不同茶树品种间的儿茶素含量和种类存在很大差异,大部分茶树以表型儿茶素为主。Xiao et al[4]研究表明,南昆山毛叶茶(Camellia ptilophylla Chang)所含儿茶素以非表型儿茶素为主,没食子儿茶素没食子酸酯占总儿茶素含量的66.80%,南昆山毛叶茶的儿茶素代谢特性具有特殊性。
茶叶儿茶素生物合成主要通过类黄酮生物代谢途径[5]。二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase, DFR)是类黄酮代谢合成通路的关键酶,可将3种二氢黄酮醇,包括二氢堪非醇、二氢杨梅黄酮和二氢栎皮黄酮,分别还原为无色花葵素、无色翠素和无色花青素[6]。DFR基因最先从玉米中克隆[7],随后在矮牵牛、金鱼草和茶树等植物中相继获得[8-10]。王新珍[11]研究发现,DFR基因在舒茶早幼叶中的转录水平高于茎尖,与其对应的儿茶素累积水平相一致。Eungwanichayapant et al[12]发现,茶树新芽中DFR基因转录水平和儿茶素含量均高于成熟叶片。Rani et al[13]研究表明,CHI、F3H、DFR、ANS和ANR基因的转录表达与儿茶素含量呈正相关。马春雷等[14]对4个总儿茶素含量存在差异的茶树品种进行半定量PCR转录水平分析,发现DFR基因转录水平与总儿茶素含量均呈正相关,其他类黄酮代谢通路基因的转录水平与总儿茶素含量不具有相关性。Mamati et al[15]研究发现,在茶树新梢发育期间,没食子儿茶素GC及总儿茶素含量与DFR基因转录水平紧密相关。迄今为止,茶树儿茶素代谢研究已有较多报道,但对儿茶素合成酶基因的研究仍限于转录水平,相关合成酶基因表达尤其翻译蛋白水平表达对儿茶素累积的影响鲜见报道。为深入探究DFR基因在茶树儿茶素合成中的作用,本研究选取具有儿茶素代谢差异的英红九号(Camellia sinensis Yinghong 9)和南昆山毛叶茶为材料,克隆2种茶树的DFR基因,并对其体内表达蛋白进行亚细胞定位;经生物信息学分析,选取基因特异肽段人工合成及修饰后作抗原,免疫新西兰大白兔制备DFR基因特异抗体;利用实时荧光定量PCR、Western blot杂交技术测定DFR转录和翻译情况,对比分析2种茶树的DFR表达与儿茶素积累的关系,以期从DFR基因转录水平及蛋白质翻译水平揭示茶树儿茶素合成代谢的分子机理。
1 材料与方法 1.1 试验材料 1.1.1 材料2018年分别采集广东省龙门县南昆山自然保护区南昆山毛叶茶和华南农业大学园艺学院茶园英红九号的芽头、一叶和二叶。样品经液氮迅速冷冻后置于-80 ℃保存备用。
1.1.2 试剂高纯度质粒小提试剂盒(DP104)、增强型琼脂糖凝胶DNA回收试剂盒(DP209)、Goldview I,均购自天根生化科技有限公司;LA-Taq酶、pMD18-T载体、T4 DNA连接酶、DL2000、DL15000,均购自Takara公司;限制性快速内切酶(BamHⅠ、SalⅠ),购自赛默飞公司;All-In-One DNA/RNA提取试剂盒(编号:B618203),购自生工生物工程股份有限公司;RNA逆转录试剂盒,购自翊圣生物科技有限公司;标准儿茶素样品,购自Merck-Sigma公司。引物合成由擎科生物技术有限公司提供技术支持、DNA测序由睿博兴科生物技术有限公司完成。
1.1.3 仪器ZORBAX Eclipse XDB色谱柱、1200高效液相色谱系统,均购于Agilent公司;PCR仪,购于宝日医生物技术有限公司;温控电泳仪电源BG-Power 600 h,购于北京百晶生物技术有限公司;凝胶成像系统,购于Bio-Rad公司;荧光定量PCR仪,由生工生物技术有限公司提供;激光共聚焦显微镜,由华南农业大学仪器中心提供。
1.2 试验方法 1.2.1 目的基因扩增茶树总RNA提取操作参考All-In-One DNA/RNA提取试剂盒说明书。茶树总cDNA的合成参考RNA逆转录试剂盒说明书。根据NCBI中茶树Cs DFR基因登录号(KY615690)获得的CDS全长信息,设计特异上下游引物:5′-ATGAAAGACTCTGTTGCTTCTGCC-3′和5′-TAAACCTTGTTGCCATTGACAGGGTTTT-3′。扩增目的条带切胶回收后连接至pMD-18T并转化DH5α。对菌落进行鉴定,将阳性菌落进行过夜增菌并提取质粒,对质粒进行PCR和双酶切鉴定后送交睿博兴科生物技术有限公司测序。
1.2.2 DFR蛋白亚细胞定位参照施婧等[16]的方法,以特异引物对CGGGGATCCATGAAAGACTCTGTTGCTTCTGCC-3′ (BamHⅠ)和CATGTCGACAACCTTGTTGCCATTGACAGGG-3′ (SalⅠ)扩展DFR基因,并与酶切后已线性化的pC1301-GFP质粒进行连接,获得pC1301-GFP/DFR亚细胞定位载体,载体转化农杆菌EHA105后注射烟草叶片,经培养后进行激光共聚焦荧光检测。
1.2.3 实时荧光定量PCR测定参照施婧等[16]的方法检测DFR的表达,即以DFR特异引物(5′-TGTGGAAGGCGGATTTGA-3′和5′-TTGATTGTCGGCTTGATTACC-3′)进行扩增,以GAPDH基因为内参,采用2-ΔΔCT法[16]计算DFR基因的表达量。
1.2.4 抗体制备与效价检测(1) 抗体制备与纯化。选取2种茶树共有的C-KLMREKWPE-YNVPTEF-NH2作为DFR基因的特异肽段并进行人工合成。肽段经匙孔血蓝蛋白修饰后免疫新西兰大白兔,获得的抗体用抗原亲和柱进行纯化。
(2) 抗体效价检测。采用ELISA方法[16],将200 μL纯化抗原(1 μg·mL-1)加入酶标板, 在4 ℃下放置10~14 h后进行洗脱与封闭。加入纯化后稀释至1 μg·mL-1的DFR抗体100 μL,于37 ℃放置1 h。洗涤后加入100 μL已稀释200倍的二抗,于37 ℃静置30 min。加入TMB,于37 ℃放置15 min,显色并用酶标仪测定D450 nm。
1.2.5 DFR蛋白表达量测定(1) 总蛋白提取。对体积比为10%的TCA/丙酮(含体积分数为0.07% β-巯基乙醇、1 mmol·L-1 PMSF)进行预冷。取1 g茶鲜叶,在液氮中加入PVPP进行充分研磨后,加入10 mL 10%TCA/丙酮,于-20 ℃放置3 h。于4 ℃预冷,以10 629 r·min-1离心15 min,弃上清,加入丙酮洗涤。重复以上操作2~3次,收集沉淀蛋白,置于-80 ℃保存。
(2) Western blot分析。使用SDS-PAGE(12%分离胶和5%浓缩胶)进行蛋白质电泳,用考马斯亮蓝R-250对分离胶进行胶体染色3~5 h。用湿法转印技术将凝胶中蛋白转到PVDF膜上,再经5%脱脂奶粉进行封闭,4 ℃下轻摇10~14 h。加入1:5 000稀释后的一抗,4 ℃孵育10~14 h,TBST清洗3次。加入二抗(1:5 000稀释),26 ℃轻摇1 h,TBST清洗3次后加适量显影液显影。显色带经扫描后,用ImageJ进行灰度对比分析,得到DFR蛋白与actin内参蛋白灰度值之比,计算DFR蛋白相对表达量。
1.2.6 儿茶素含量的测定参考文献[17]进行儿茶素的提取。儿茶素测定采用Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm)和1200高效液相色谱仪,色谱柱柱温为40 ℃,流动相流动速度为1.0 mL·min-1,在吸收波长为280 nm处进行检测,样品上样量为10 μL。流动相A为100%分析纯乙腈,B为0.2%(体积比)甲酸。梯度洗脱程序:0~5 min B相从96%到94%;5~25 min B相从94%到90%;25~49 min B相从90%到79%。
1.3 统计与分析采用Graphpad Prism7和Excel 2016软件进行数据处理。
2 结果与分析 2.1 DFR基因克隆与序列以南昆山毛叶茶和英红九号样品提取的mRNA逆转录产物cDNA为模板,用合成的DFR扩增引物进行PCR扩增,2种茶树中均扩增出约1 100 bp预期大小的序列(图 1)。测序分析表明,从南昆山毛叶茶和英红九号中克隆的DFR基因MY-DFR和YH-DFR (在Genbank中的登录号分别为MT875201和MT876617),与NCBI数据库中登录的茶树DFR基因同源性高于99.33%,包含1 044 bp的ORF,并编码348个推导氨基酸序列,但克隆的2个基因间存在5个核苷酸碱基及对应5个编码氨基酸残基的差异(图 2)。
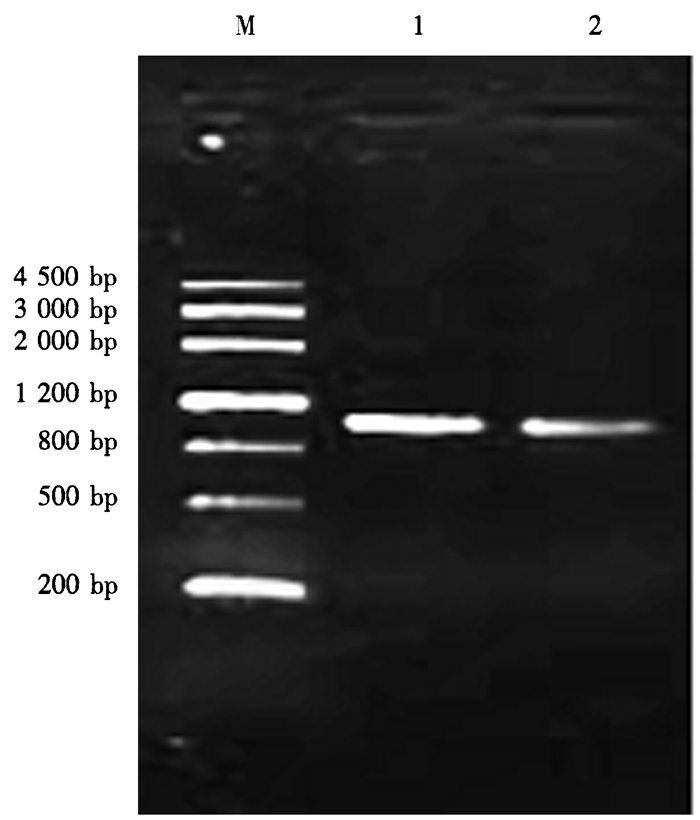
|
M.Marker;1.MY-DFR;2.YH-DFR。 图 1 MY-DFR、YH-DFR基因PCR扩增图 Figure 1 PCR amplification products of MY-DFR and YH-DFR genes |

|
A~E分别表示MY-DFR和YH-DFR序列差异氨基酸;F为DFR基因人工合成抗体特异肽段。 图 2 南昆山毛叶茶和英红九号氨基酸序列比对图 Figure 2 Comparison of amino acid sequences between two tea varieties of C.ptilophylla Chang and C.sinensis Yinghong 9 |
利用MEGA分析软件,将从南昆山毛叶茶和英红九号中克隆的DFR基因与NCBI数据库中已登陆的相关DFR基因进行系统进化树分析,结果见图 3。本研究克隆的MY-DFR、YH-DFR基因与其他茶树已登录的DFR基因的亲缘关系非常近,而红花油茶(JN944580.1)、田旋花(EU189076.1)和秣刍仙客来(AB517922.1)与茶树在进化关系上也相对较近。茶树与蔓越莓(AY780883.1)、高大越橘(KF960989.1)、兔眼蓝莓(AB610763.1)、猕猴桃(KF15739973.1)、蓝锭果(KT362345.1)、半边莲(AB221076.1)、榴莲(XM022913282.1)等物种不在同一簇,说明进化关系相对较远。
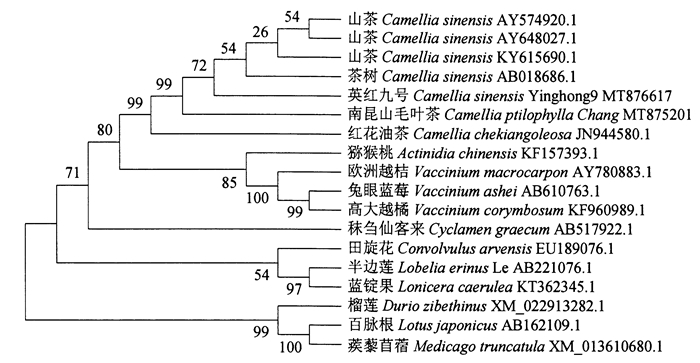
|
图 3 Cs DFR系统发育树 Figure 3 Cs DFR phylogenetic tree |
利用DNA同源重组法,将克隆的DFR基因与酶切后的亚细胞定位线性化载体pC1301-GFP进行同源重组连接,并获得pC1301-GFP-DFR重组载体。对pC1301-GFP-DFR重组质粒进行PCR,将重组载体用限制性内切酶BamHⅠ和SalⅠ进行酶切。结果表明,线性化pC1301-GFP载体与DFR基因成功连接(图 4)。将重组载体转化农杆菌EHA105,并注射烟草叶片下表皮,暗培养1~2 d后,用激光共聚焦显微镜进行观察,结果见图 5。GFP-DFR融合蛋白在烟草细胞中的细胞质部位发出绿色荧光,因此,将DFR基因表达的蛋白定位于细胞质。
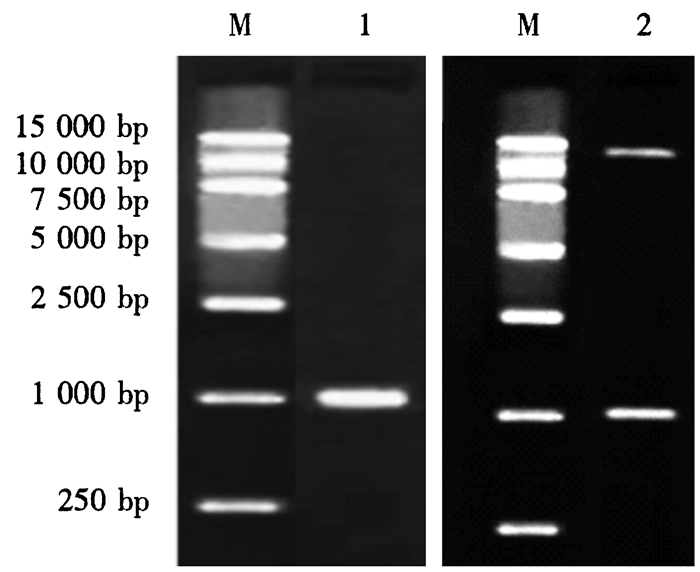
|
M.Marker DNA; 1.PCR; 2.质粒酶切。 图 4 pC1301-GFP-DFR重组质粒的鉴定分析 Figure 4 Identification of the pC1301-GFP-DFR recombinant plasmid |
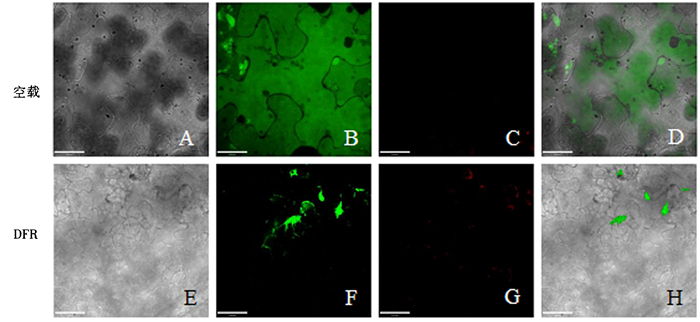
|
A.空载体明场; B.空载体荧光场; C.空载体叶绿体自发光; D.空载体叠加场; E.DFR明场; F.DFR荧光场; G.DFR叶绿体自发光; H.DFR叠加场。 图 5 DFR蛋白在烟草细胞中的亚细胞定位 Figure 5 Subcellular localization of DFR in tobacco cells |
2种茶叶的DFR基因转录水平经qRT-PCR测定(图 6)表明,DFR基因在南昆山毛叶茶中的相对表达量极显著低于英红九号,后者是前者的6.3倍。

|
**表示差异极显著(P < 0.01)。 图 6 南昆山毛叶茶和英红九号体内DFR基因荧光定量PCR Figure 6 Fluorescence qRT-PCR analysis of the DFR gene transcripts from C.ptilophylla Chang and C.sinensis Yinghong 9 |
对DFR蛋白特定肽段免疫新西兰大白兔获得的纯化抗体进行间接ELISA法检测,结果见表 1。2只免疫兔子来源的DFR抗体在1 μg·mL-1时,D450 nm值均不低于2.21,其效价均高达1:80 000。因此,2种抗体均可用于后续检测试验,本研究选取DFR抗体1进行后续检测试验。
| 抗体 | 稀释比(体积比) | 空白IgG (1:1 250) |
||||||
| 1:1 250 | 1:2 500 | 1:5 000 | 1:10 000 | 1:20 000 | 1:40 000 | 1:80 000 | ||
| DFR抗体1 | 2.686 | 2.563 | 2.663 | 2.7 | 2.555 | 2.624 | 2.554 | 0.101 |
| DFR抗体2 | 2.636 | 2.454 | 2.54 | 2.638 | 2.5 | 2.47 | 2.217 | 0.099 |
| 1)DFR抗体1、抗体2分别为免疫2只新西兰大白兔合成的抗体。 | ||||||||
将茶树中提取的总蛋白进行SDS-PAGE电泳,经转膜后利用制备的多克隆抗体检测DFR蛋白表达量,结果见图 7。DFR在近40 kU处有特异检测带,actin内参在55 kU左右有一特异性杂交带。利用灰度分析DFR蛋白相对表达量(图 8),发现南昆山毛叶茶DFR蛋白的相对表达量显著高于英红九号,前者是后者的1.21倍。

|
M.标准预染蛋白;1~3.南昆山毛叶茶;4~6.英红九号。 图 7 DFR蛋白Westernblot分析 Figure 7 Westernblot analysis of DFR protein |

|
*表示差异显著(P < 0.05)。 图 8 DFR蛋白与actin蛋白灰度比值 Figure 8 Gray ratio of DFR protein to actin protein |
用HPLC测定南昆山毛叶茶和英红九号中的儿茶素组成,结果见图 9。南昆山毛叶茶儿茶素组成以非表型儿茶素为主,占儿茶素总量的74.73%;英红九号儿茶素组成则以表型儿茶素为主,占儿茶素总量的95.94%,2种茶树的儿茶素代谢模式不同。依据DFR在南昆山毛叶茶中低转录高翻译和在英红九号中高转录低翻译的表达特性,说明DFR基因在2种茶树中的表达无论是转录水平还是翻译水平均具复杂性,推测茶树体内DFR基因的表达可能受到相关调控基因的调控。

|
**表示差异极显著(P < 0.01)。 图 9 南昆山毛叶茶和英红九号儿茶素含量 Figure 9 Catechin contents in C.ptilophylla Chang and C.sinensis Yinghong 9 |
基因表达是细胞生命活动最基本的过程,在生物的新陈代谢及调控中发挥重要角色。因此,阐释功能基因的表达情况,尤其酶蛋白表达水平与其对应代谢产物的关系,是研究生物代谢的重要内容。目前,生物体内基因表达蛋白的测定主要有蛋白质组学分析法和免疫检测法等[18-19],但前者研究费用高昂,而后者需要发展基因蛋白特定的抗体。本研究针对南昆山毛叶茶和英红九号茶树中克隆的DFR基因序列的特点,选择两者共有的特定肽段, 经人工合成与修饰后,制备成基因特定抗原并免疫新西兰大白兔,获得了在1:80 000稀释下D450 nm值仍不低于2.21的高效价多克隆抗体。将抗体同2种茶树中提取的总蛋白杂交,DFR蛋白显示非常高的特异性,且检测结果除了目标主带外,还出现1条分子量略小含量低的检测带,可能是茶样中提取的DFR蛋白出现一定程度的降解所致,这与Song et al[20]对PepMoV-Vb1基因蛋白Westernblot杂交结果相似,认为可能是靶蛋白出现降解。
DFR基因作为花青素和儿茶素等黄酮物质合成通路上游的关键酶基因,其表达情况对植物表型及代谢物积累具有重要影响。矮牵牛花色在转入玉米DFR基因后发生改变[21];Tanaka et al[22]在淡粉色矮牵牛中转入玫瑰花瓣的DFR基因,矮牵牛产生了原本缺乏的橙红色的花葵素。DFR可将3种二氢黄酮醇,包括二氢堪非醇、二氢杨梅黄酮和二氢栎皮黄酮,分别还原为无色花葵素、无色翠素和无色花青素[6],其对花青素、儿茶素和原花青素的累积具有调控作用[23]。本研究表明,在转录水平上,DFR基因在南昆山毛叶茶中的表达低于英红九号,但在翻译蛋白水平上,DFR基因在南昆山毛叶茶中的表达反而高于英红九号,体现了DFR基因在2种茶树中转录翻译表达的复杂性,这与Zhang et al[24]对番茄研究时发现的CDPK5S527和SRL3S329基因在转录和翻译中呈现的复杂性相似。王利彬[25]认为,生物体内DNA转录成mRNA、mRNA翻译成蛋白质会受到各种因子的调控。本研究发现,2种茶树体内DFR基因的表达具有复杂性,认为DFR基因在茶树体内的差异表达可能受到相关调控基因的调控。
| [1] | 夏涛, 高丽萍. 类黄酮及茶儿茶素生物合成途径及其调控研究进展[J]. 中国农业科学, 2009, 42(8): 2899–2908. |
| [2] | YOSHIDA Y, KISO M, GOTO T. Efficiency of the extraction of catechins from green tea[J]. Food Chemistry, 1999, 67(4): 429–433. DOI: 10.1016/S0308-8146(99)00148-X |
| [3] | KANG W, WANG L, JIAN Z, et al. Catechin contents in tea (Camellia sinensis) as affected by cultivar and environment and their relation to chlorophyll contents[J]. Food Chemistry, 2011, 125(1): 44–48. |
| [4] | XIAO R Y, YE C X, JIE K X, et al. Simultaneous analysis of purine alkaloids and catechins in Camellia sinensis, Camellia ptilophylla and Camellia assamica var. kucha by HPLC[J]. Food Chemistry, 2007, 99(3): 1132–1136. |
| [5] | TAN J F, WANG M J, TU L L, et al. The flavonoid pathway regulates the petal colors of cotton flower[J]. PLoS One, 2013, 8(8): e72364. DOI: 10.1371/journal.pone.0072364 |
| [6] | 高燕会, 黄春红, 朱玉球, 等. 植物花青素苷生物合成及调控的研究进展[J]. 中国生物工程杂志, 2012, 32(8): 94–99. |
| [7] | O'REILLY C, SHEPHERD N S, PEREIRA A, et al. Molecular cloning of the a1 locus of Zea mays using the transposable elements En and Mu1[J]. The EMBO Journal, 1985, 4(4): 877–882. DOI: 10.1002/j.1460-2075.1985.tb03713.x |
| [8] | BELD M, MARTIN C, HUITS H, et al. Flavonoid synthesis in Petuniahybrida:partial characterization of dihydroflavonol-4-reductase genes[J]. Plant Molecular Biology, 1989, 13(5): 491–502. DOI: 10.1007/BF00027309 |
| [9] | SINGH K, KUMAR S, YADAV S K, et al. Characterization of dihydroflavonol 4-reductase cDNA in tea[Camellia sinensis (L.) O. Kuntze][J]. Plant Biotechnology Reports, 2009, 3(1): 95–101. |
| [10] | MARTIN C, CARPENTER R, SOMMER H, et al. Molecular analysis of instability in flower pigmentation of Antirrhinummajus, following isolation of the pallida locus by transposon tagging[J]. The EMBO Journal, 1985, 4(7): 1625–1630. DOI: 10.1002/j.1460-2075.1985.tb03829.x |
| [11] | 王新珍.茶树儿茶素在芽中积累规律及茶树F3'5'H2的功能分析[D].合肥: 安徽农业大学, 2016. |
| [12] | EUNGWANICHAYAPANT P D, POPLUECHAI S. Accumulation of catechins in tea in relation to accumulation of mRNA from genes involved in catechin biosynthesis[J]. Plant Physiology and Biochemistry, 2009, 47(2): 94–97. |
| [13] | RANI A, SINGH K, AHUJA P S, et al. Molecular regulation of catechins biosynthesis in tea[Camelliasinensis (L.) O. Kuntze][J]. Gene, 2012, 495(2): 205–210. DOI: 10.1016/j.gene.2011.12.029 |
| [14] | 马春雷, 乔小燕, 陈亮. 茶树无色花色素还原酶基因克隆及表达分析[J]. 茶叶科学, 2010, 30(1): 27–36. |
| [15] | MAMATI G E, LIANG Y R, LU J L. Expression of basic genes involved in tea polyphenol synthesis in relation to accumulation of catechins and total tea polyphenols[J]. Journal of the Science of Food and Agriculture, 2006, 86(3): 459–464. DOI: 10.1002/jsfa.2368 |
| [16] | 施婧, 张雪, 张媛媛, 等. 茶叶CHS基因表达特性及其与儿茶素积累的关系[J]. 食品工业科技, 2020, 41(5): 101–106, 112. |
| [17] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.茶叶中茶多酚和儿茶素类含量的检测方法: GB/T 8313-2008[S].北京: 中国标准出版社, 2008. |
| [18] | GUPTA B, SENGUPTA A, SAHA J, et al. Plant abiotic stress:'Omics' approach[J]. Journal of Plant Biochemistry & Physiology, 2013, 1(3): e108. |
| [19] | 林影, 叶茂, 韩双艳, 等. 免疫检测技术的研究进展[J]. 食品与生物技术学报, 2007, 26(4): 117–120. |
| [20] | SONG E G, RY K H. A pepper mottle virus-based vector enables systemic expression of endoglucanase D in non-transgenic plants[J]. Archives of Virology, 2017, 162(12): 3717–3726. DOI: 10.1007/s00705-017-3539-2 |
| [21] | MEYER P, HEIDMANN I, FORKMANN G, et al. A new petunia flower colour generated by transformation of a mutant with a maize gene[J]. Nature, 1987, 330: 677–678. DOI: 10.1038/330677a0 |
| [22] | TANAKA Y, FUKUI Y, FUKUCHI-MIZUTANI M, et al. Molecular cloning and characterization of Rosahybrida dihydroflavonol 4-reductase gene[J]. Plant and Cell Physiology, 1995, 36(6): 1023–1031. DOI: 10.1093/oxfordjournals.pcp.a078844 |
| [23] | WANG W L, WANG Y X, LI H, et al. Correction to:Two MYB transcription factors (CsMYB2 and CsMYB26) are involved in flavonoid biosynthesis in tea plant[Camelliasinensis (L.) O.Kuntze][J]. BMC Plant Biology, 2019, 19(1): 36. |
| [24] | ZHANG X L, QI M F, XU T, et al. Proteomics profiling of ethylene-induced tomato flower pedicel abscission[J]. Journal of Proteomics, 2015, 121: 67–87. DOI: 10.1016/j.jprot.2015.03.023 |
| [25] | 王利彬.大豆苗期干旱和高温胁迫应答机制研究及关键转录因子的筛选[D].哈尔滨: 东北农业大学, 2018. |
 2020,Vol. 16
2020,Vol. 16


