文章信息
- 吴淑蓉, 卓钦, 陈发兴
- WU Shurong, ZHUO Qin, CHEN Faxing
- 不同处理方法对西番莲种子萌发的影响
- Effect of different treatment methods on the germination of Passiflora caerulea seeds
- 亚热带农业研究, 2020, 16(3): 180-184
- Subtropical Agriculture Research, 2020, 16(3): 180-184.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2020.03.007
-
文章历史
- 收稿日期: 2020-05-29
西番莲(Passiflora caerulea L.),俗称百香果、时计果,是西番莲科(Passifloraceae)西番莲属(Passiflora L.)的常绿草质藤本植物[1],广植于热带、亚热带地区。商业栽培种有黄果、紫果西番莲两大类[2-3]。西番莲繁殖一般采用扦插苗、嫁接苗和实生苗。其中,扦插苗繁殖系数低,且根系弱、苗期长[4];嫁接苗虽然开花较快,但存在后期长势不良、砧木老化的问题, 并且嫁接费时费工。因此,目前西番莲产业主要采用实生苗扩繁,但实生苗培育存在种子萌发率低、苗期较长且成活率较低等难题[4-6]。
已有研究表明,赤霉素(GA3)[7]、6-BA[8]、温度[6]等理化因子能不同程度地促进西番莲种子萌发,但尚未见有关培养基及GA3浸种对其萌发影响的相关报道。本研究比较了培养基与不同质量浓度GA3浸种对黄果西番莲种子萌发的影响,探究促进其萌发的处理方式,旨在为西番莲实生苗扩繁提供参考。
1 材料与方法 1.1 试验材料 1.1.1 植物材料黄果西番莲果实采自龙岩市赤水百香果基地。果实采收后,取出种子,洗净晾干。将洗净晾干的种子浸泡在水中,除去漂浮着的无活性种子,选择较为饱满的种子。种子平均千粒重为144.3 g。
1.1.2 药品试剂1%(体积分数)吐温-20、0.85 mol·L-1次氯酸钠、磷酸二氢钾、GA3、13 mol·L-1乙醇、0.1 mol·L-1 NaOH、琼脂、蔗糖,以上药品均为国产分析纯。实验用水为超纯水。
1.2 供试方法 1.2.1 种子吸水特性随机挑选30粒西番莲种子,室温下浸种。每隔2 h取出,用吸水纸吸去种壳外水分后称重,重复操作至种子质量无变化。试验设3次重复。
吸水率/%=[(吸水后种子质量-风干种子质量)/风干种子质量]×100
1.2.2 剥壳处理设置种子不剥壳、只裂不剥壳、半剥壳、全剥壳4种处理方式。将30粒处理好的种子置于13 mol·L-1乙醇中浸泡20~60 s,用无菌水洗脱1~2次,再置于1%吐温-20与0.85 mol·L-1次氯酸钠同等比混合液中浸泡12~15 min,用无菌水洗脱4~5次后吸干种子表面水分置于PNM培养基,常温下(20~25 ℃)暗培养15 d。各处理3次重复,统计种子萌发率。
萌发率/%=(正常萌发种子个数/试验种子总数)×100
1.2.3 培养基处理参试培养基包括:1/2MS、3/4MS、MS和PNM,以MS培养基为CK。MS培养基pH值为5.8;PNM培养基通过添加磷酸二氢钾调节pH值至5.6。4种培养基均在121 ℃、100 kPa压强下灭菌20 min。将灭菌处理的西番莲种子置于4种培养基中,常温下(20~25 ℃)暗培养3~7 d,观察并统计种子萌发率、萌发势及萌芽高峰日。萌芽高峰日指发芽种子数增长最多的一天。
萌发势/%=(规定日数内种子发芽数/试验种子总数)×100
1.2.4 GA3处理分别将种子在0(CK)、5、10、15、20 mg·mL-1 GA3浸泡12 h,再进行全剥壳、灭菌处理后接种于PNM培养基,常温下暗培养3~7 d,统计种子萌发率。
1.3 统计与分析采用SPSS进行数据统计分析,应用Excel 2010做图。
2 结果与分析 2.1 西番莲种子的吸水特性西番莲种子吸水率随浸种时间的变化见图 1。从图 1可见,前2 h内种子吸水率最高,达到8.68%,此时吸水量占12 h总吸水量的66.14%。浸种2 h后的吸水率大幅度降低,4 h时为2.51%,6 h时为1.20%,10 h时种子吸水率几乎降至0。综上可见,浸泡2 h内西番莲种子处于急速吸水状态,4~8 h处于缓慢吸水状态,10 h时种子吸水已经趋向饱和状态。
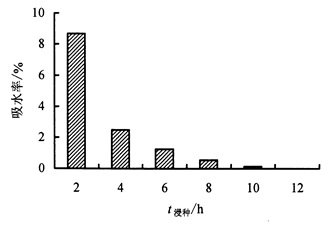
|
图 1 浸种时间对西番莲种子吸水率的影响 Figure 1 Eeffect of soaking time on the water absorption rate of P.caerulea seeds |
分别将4种剥壳处理的种子接种至PNM培养基上培养15 d,各处理种子萌发率见图 2。4种处理对西番莲种子萌发率的影响差异显著(P < 0.05),表现为随着剥壳程度加大,种子萌发率越高。其中,全剥壳处理的萌发率最高,达73.63%;不剥壳的种子萌发率最低,仅7.78%。此外,培养7 d时全剥壳处理的种子萌发率已达到68.89%。综上可见,对种子进行全剥壳处理可大幅度提高种子萌发率。
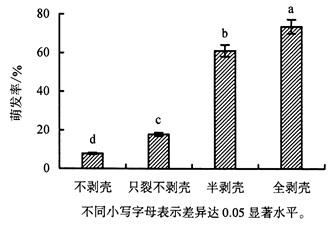
|
图 2 剥壳处理对西番莲种子萌发的影响 Figure 2 Effect of deshelling on the germination rate of P.caerulea seeds |
西番莲种子在不同培养基中培养7 d的萌发情况见表 1。4种培养基中西番莲种子的萌发势和萌发率从低到高依次为:1/2MSv3/4MS < MS(CK) < PNM。其中,1/2MS培养基中种子萌发势和萌发率最低,分别为34.44%、41.11%,极显著低于CK;PNM培养基中萌发势和萌发率最高,分别为61.10%、68.89%,极显著高于CK。1/2MS、3/4MS、MS培养基的差别主要在于盐分的高低。1/2MS、3/4MS培养基的种子萌发率低于MS培养基,表明盐分含量对种子萌发率有一定程度的影响,盐分含量过低会抑制萌发。组织培养中最广泛使用的培养基是MS培养基,但从表 1可知,接种于PNM培养基的种子萌发势及萌发率高于MS培养基。因此,建议将PNM培养基应用于西番莲实生苗生产,不仅能提高种子萌发率,还能缩短组培苗的萌发时间。
| 培养基 | 种子数 | 启动日 | 萌发高峰期 | 萌发势 | 萌发率 | ||||
| 粒 | d | d | % | % | |||||
| 1/2MS | 90 | 4 | 6 | 34.44dD | 41.11dC | ||||
| 3/4MS | 90 | 4 | 6 | 43.33cC | 47.78cB | ||||
| MS(CK) | 90 | 3 | 5 | 52.22bB | 55.56bB | ||||
| PNM | 90 | 3 | 5 | 61.10dA | 68.89aA | ||||
| 1)同列数值后附不同大小写字母者分别表示差异达0.01、0.05显著水平。 | |||||||||
西番莲种子在不同质量浓度GA3中浸种,并全剥壳接种于PNM培养基培养7 d的种子萌发情况见表 2。不同浓度GA3浸种处理对种子萌发的启动日和萌发高峰期几乎没有影响,但影响种子萌发势和萌发率。其中,5 mg·mL-1GA3浸种处理的种子萌发势和萌发率最高,分别为65.56%、82.22%;20 mg·mL-1 GA3浸种处理的种子萌发势和萌发率最低,分别为53.33%、73.33%。从表 2还可见,5、10 mg·mL-1 GA3浸种处理的种子萌发势和萌发率都高于CK,15、20 mg·mL-1 GA3浸种处理的种子萌发势和萌发率低于CK。综上可见,在一定范围内提高GA3浓度进行浸种可提高种子萌发势和萌发率,但浓度过高则抑制种子萌发。
| ρGA3 | 种子数 | 启动日 | 萌发高峰期 | 萌发势 | 萌发种子数 | 萌发率 | ||||||
| mg·mL-1 | 粒 | d | d | % | 粒 | % | ||||||
| 0(CK) | 90 | 4 | 5 | 53.33cC | 71 | 78.89cB | ||||||
| 5 | 90 | 4 | 5 | 65.56aA | 74 | 82.22aA | ||||||
| 10 | 90 | 4 | 5 | 60.00bB | 72 | 80.00bA | ||||||
| 15 | 90 | 4 | 5 | 55.56cC | 68 | 75.56dC | ||||||
| 20 | 90 | 4 | 5 | 53.33cC | 66 | 73.33eD | ||||||
| 1)同列数值后附不同大小写字母者分别表示差异达0.01、0.05显著水平。 | ||||||||||||
种子萌发可分为5个阶段:吸胀、水和酶活化、细胞分裂、突破种皮、成苗[9]。其中,种子吸水吸胀可以软化种皮,增加透性使供氧充足[10-11]。本研究表明,浸种2 h吸水率最高,之后吸水率下降,至10 h种子吸水趋于饱和状态。在实生苗生产中,建议将西番莲种子浸种10 h,可有效缩短种子萌发时间。
3.2 不同处理方式对西番莲种子萌发率的影响西番莲种子表面有角质化外壳,种壳坚硬,极大影响萌发速率[5]。郑宝强等[12]研究表明,对种子进行剥壳处理在不同程度上消除了种子萌发的机械障碍。本研究表明,对种子进行全剥壳处理,种子萌发启动只需3~4 d且萌发率较高。
适宜浓度GA3浸种处理可加速种子吸水、促进种子萌发,从而提高种子萌发势和萌发率[13-14]。GA3是最常用的打破种子休眠的植物激素[15-17]。在一定范围内提高GA3浓度浸种处理可促进种子萌发,过高浓度则抑制萌发[18-20]。韦妍等[21]研究表明,300 mg·mL-1GA3浸种对刺蒺藜种子的萌发势、萌发率和萌发速率均有促进作用。本研究表明,在5 mg·mL-1 GA3中浸种12 h最有利于西番莲种子萌发。
植物组织培养中运用最广泛的培养基是MS培养基。张婷婷等[7]研究表明,将种子剥壳后接种于MS培养基是西番莲种子萌发的最适方法,但该方法种子萌发率不足50%。邱杭等[8]将紫果西番莲种子置于6-BA浸种后接种于MS培养基培养9 d的萌发率为75%。本试验将西番莲种子置于5 mg·mL-1 GA3中浸种后全剥壳接种于PNM培养基中培养7 d的萌发率为82.22%,种子萌发启动更早,萌发率更高。从培养基配置成本来看,MS培养基配置使用的药品种类比PNM培养基更加复杂、多样,配置PNM培养基的成本低于MS培养基。因此,将PNM培养基应用于西番莲实生苗生产具有一定的可行性。西番莲种子在PNM培养基中的萌发率高于MS培养基,但对PNM培养基促进西番莲种子萌发的具体机理还有待进一步研究。此外,徐翠等[22]研究表明,浸种温度影响狗尾草种子活力与萌发,但不同浸种温度能否提高西番莲种子萌发率,也有待进一步研究。
| [1] | 黄东梅, 吴斌, 马伏宁, 等. 不同消毒剂及激素对黄果西番莲茎段组织培养的影响[J]. 热带农业科学, 2019, 39(12): 16–20. |
| [2] | 徐丽, 张如莲, 刘迪发, 等. 西番莲种子研究进展[J]. 农学学报, 2013, 3(3): 57–59, 63. |
| [3] | 郑文武, 郑颂, 刘永华. 我国西番莲生产现状及发展探讨[J]. 中国热带农业, 2008(6): 8–9. |
| [4] | 张勇, 熊丙全, 曾明. 种子处理对西番莲活力及苗木生长的影响[J]. 西南农业大学学报, 2003, 25(2): 135–137. |
| [5] | PERTUZATTI P B, SGANZERLA M, JACQUES A C, et al. Carotenoids, tocopherols and ascorbic acid content in yellow passion fruit (Passiflora edulis) grown under different cultivation systems[J]. LWT-Food Science and Technology, 2015, 64(1): 259–263. |
| [6] | 陈红卫. 百香果(西番莲)种植技术[J]. 中国农业信息, 2017(6): 80–81. |
| [7] | 张婷婷, 吴田, 张瑞丽, 等. 紫果西番莲种子萌发及根部诱导愈伤组织研究[J]. 西南农业学报, 2013, 26(3): 1148–1151. |
| [8] | 邱杭, 冼柏伟, 江剑址, 等. 西番莲种子促进萌发的研究[J]. 仲恺农业工程学院学报, 2016, 29(4): 13–17. |
| [9] | 毛琳琳, 朱志炎, 何勇, 等. 印度梨形孢(Piriformospora indica)与植物互作研究综述[J]. 安徽农学通报, 2016, 22(11): 47–50, 99. |
| [10] | 张沛.黑果枸杞种子萌发特性及组织培养研究[D].杨凌: 西北农林科技大学, 2017. |
| [11] | 王桔红, 陈文. 黑果枸杞种子萌发及幼苗生长对盐胁迫的响应[J]. 生态学杂志, 2012, 31(4): 804–810. |
| [12] | 郑宝强, 王雁. 大果西番莲的扦插育苗[J]. 中国花卉园艺, 2008(2): 42–44. |
| [13] | 李佳, 周素华, 贾娜, 等. 不同浓度赤霉素处理对杜仲种子萌发的影响[J]. 安徽农业科学, 2019, 47(3): 144–146, 185. |
| [14] | 张建, 范光发, 娄辉. 磷酸二氢钾、赤霉素浸种对小麦种子萌发的影响[J]. 园艺与种苗, 2020, 40(5): 51–53. |
| [15] | HERRANZ J M, FERRANDIS P, MARTÍNEZ-DURO E. Seed germination ecology of the threatened endemic Iberian Delphinium fissum subsp. sordidum (Ranunculaceae)[J]. Plant Ecology, 2010, 211(1): 89–106. |
| [16] | 黄承玲, 刘广超, 赵孝梨. 赤霉素提高露珠杜鹃种子活力机理[J]. 北方园艺, 2017(6): 77–80. |
| [17] | 曹莎, 刘冰, 周泓, 等. 激素处理对杜鹃花自交与杂交种子萌发的影响[J]. 浙江农业学报, 2016, 28(10): 1695–1703. |
| [18] | 潘丽梅, 韦树根, 白隆华, 等.促进金果榄种子萌发的方法: CN108323270A[P].2018-07-27. |
| [19] | 李晓冬.华重楼种子快速萌发研究[D].杨凌: 西北农林科技大学, 2018. |
| [20] | 陈乾平, 白隆华, 谷筱玉, 等.促进薯莨种子萌发的方法: CN108271462A[P].2018-07-13. |
| [21] | 韦妍, 李萍, 田婵, 等. 不同浓度赤霉素浸种对刺蒺藜种子萌发特性的影响[J]. 延安大学学报(自然科学版), 2018, 37(1): 84–87, 91. |
| [22] | 徐翠, 陈梅, 刘金海, 等. 浸种温度与时间对纳罗克非洲狗尾草种子萌发的影响[J]. 草原与草坪, 2020, 40(3): 75–79. |
 2020,Vol. 16
2020,Vol. 16


