文章信息
- 廖斌, 李珊珊, 梁梓豪, 徐小萍, 李汉生, 林玉玲, 赖钟雄
- LIAO Bin, LI Shanshan, LIANG Zihao, XU Xiaoping, LI Hansheng, LIN Yuling, LAI Zhongxiong
- 光质对龙眼胚性愈伤组织柯里拉京含量的影响
- Effect of light quality on corilagin[β-1-O-galloyl-3, 6-(R)-hexahydroxydiphenoyl-D-glucose] content of embryogenic Dimocarpus longan Lour. callus tissue
- 亚热带农业研究, 2018, 14(2): 128-133
- Subtropical Agriculture Research, 2018, 14(2): 128-133.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2018.02.010
-
文章历史
- 收稿日期: 2018-03-25
龙眼(Dimocarpus longan Lour.)为无患子科(Sapindaceae)龙眼属(Dimocarpus)常绿乔木, 是我国华南四大珍果之一。龙眼果实富含黄酮类和单宁类等酚类物质, 柯里拉京[β-1-O-galloyl-3, 6-(R)-hexahydroxydiphenoyl-D-glucose]是其中一种天然多酚类单宁酸化合物[1]。柯里拉京具有抗肿瘤、保肝、抗动脉粥样硬化、降血压、抗氧化等生物学活性[2-5], 极具药用价值和市场前景, 主要存在于龙眼、叶下珠、余甘子、蜜柑草等多种植物中[1]。近年来国内外市场对柯里拉京的需求日益增加, 但柯里拉京主要依赖于天然植物提取获得。目前, 大多选用龙眼果核作为研究材料[6-8], 而龙眼已经建立了优良的胚性愈伤组织细胞系, 可以快速增殖, 是建立悬浮细胞系和发酵培养的优良起始材料[9], 有关光质对龙眼胚性愈伤组织中柯里拉京含量影响的研究尚未见报道。
光是植物生长发育和形态建成的重要生态因子[10-11], 不同光质对植物细胞生长和次生代谢物的合成及其关键酶活性产生不同的影响[12-13]。蓝光对白桦愈伤组织生长和三萜的合成具有促进作用[14]; 红光有利于长鞭红景天悬浮细胞PAL活性的提高, 但生物量远低于白光[15]; 绿光虽能促进葡萄愈伤组织快速增殖, 但对白藜芦醇的合成起抑制作用[16]。超高效液相色谱法(ultra performance liquid chromatography, UPLC)在传统液相上进行了改进, 克服了HPLC分析时间长的缺点, 具有分析速度快、灵敏度高、分离度高等优点[17]。本研究采用UPLC法, 通过优化柯里拉京含量测定条件, 探讨不同培养天数及光质对龙眼胚性愈伤组织中柯里拉京含量的影响, 以期为利用龙眼胚性愈伤组织提取柯里拉京提供依据。
1 材料与方法 1.1 材料与仪器龙眼‘红核子’品种胚性愈伤组织LC2细胞系[18], 由福建农林大学园艺植物生物工程研究所提供; 超高效液相色谱仪, 由美国Water公司提供; 真空冷冻干燥机, 由北京四环科学仪器有限公司提供; KQ-600KDE型高功率数控超声波清洗器, 由昆山市超声仪器公司提供; 光照培养箱; 乙腈和甲醇均为色谱纯, 其余试剂均为分析纯; 柯里拉京标准样品(产品号:2309 4-69-1)购自上海源叶生物科技有限公司, 纯度≥98%。
1.2 方法 1.2.1 最佳培养天数的筛选选取色泽淡黄、颗粒细小、生长旺盛的龙眼胚性愈伤组织, 在2种培养基(①MS+20 g·L-1蔗糖+7 g·L-1琼脂+1.0 mg·L-1 2, 4-D+100 mg·L-1肌醇; ②MS+20 g·L-1蔗糖+7 g·L-1琼脂+1.0 mg·L-1 2, 4-D+0.5 mg·L-1 KT+5 mg·L-1 AgNO3)上交替继代培养, pH 5.8, 121 ℃高温蒸汽灭菌20 min。置于黑暗无菌条件下, 控制培养温度(25±1) ℃, 分别培养15、20、25、30和35 d后测定柯里拉京含量, 并筛选出柯里拉京含量积累的最佳培养天数。
1.2.2 光质处理在每瓶培养基上接4团生长状态良好的龙眼胚性愈伤组织, 分别置于红光、绿光、蓝光、白光下进行光质处理, 以黑暗培养作为对照。各单色光和黑暗交替处理12 h, 光照强度32 μmol·m-2·s-1, 培养温度(25±1) ℃。每个处理25瓶, 3次重复。
1.2.3 柯里拉京的提取参考刘莹等[19]、李华等[20]的方法并进行适当改良。将龙眼胚性愈伤组织冻干至恒重, 用研钵研磨粉碎, 过80目筛。精确称取0.2 g粉末于15 mL离心管中, 加入体积分数为70 %的乙醇3 mL, 震荡30 s, 室温浸泡30 min后, 45 ℃超声波辅助提取60 min。
1.2.4 柯里拉京含量的测定(1) 标准曲线的绘制。精确称取1 mg柯里拉京标准样品, 用体积分数为50%的色谱甲醇溶解并定容于1 mL离心管中, 充分摇匀, 配制成1 mg·mL-1标准贮备液, 于4 ℃避光保存, 备用。进样前, 用色谱甲醇依次稀释成0.001、0.01、0.1、0.2、0.5 mg·mL-1标准样品溶液, 过0.45 μm滤膜, 进行UPLC测定。以标准样品浓度为横坐标, 色谱峰面积为纵坐标绘制标准曲线, 并计算线性回归方程及相关系数(图 1)。
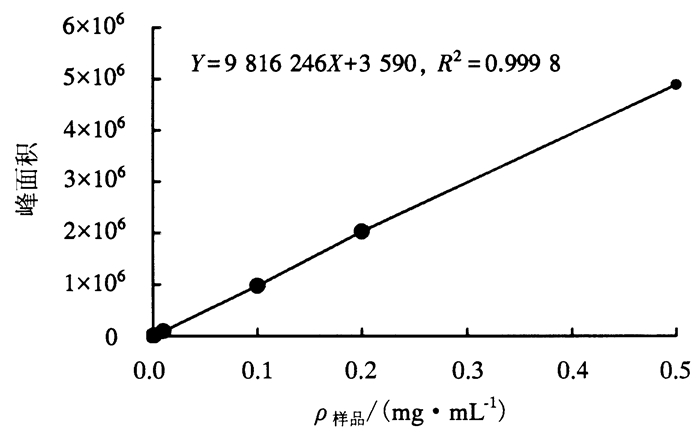
|
图 1 柯里拉京标准曲线 Figure 1 The standard curve of corilagin content |
(2) 供试样品溶液制备。将提取后的样品冷却、静置10 min后, 于7 000 r·min-1室温离心10 min。吸取2 mL上清液于新试管中, 用体积分数为50%的色谱甲醇稀释至10 mL, 震荡混匀, 用一次性针筒吸取1 mL, 过0.45 μm滤膜, 进样。根据标准曲线计算供试样品的柯里拉京含量。
1.2.5 色谱条件的优化采用WATERS ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm, 1.7 μm), 参考文献[21]~[22]优化流速、柱温、进样体积和梯度洗脱条件。流速0.2 mL·min-1; 柱温30 ℃; 进样体积5 μL; 梯度洗脱条件, 乙腈:0~1 min, 0~5%;1~3 min, 5%~13%;3~6 min, 13%~25%;6~8 min, 14%;8~10 min, 5%。流动相以乙腈与甲酸水溶液的不同配比进行筛选试验, 发现以体积分数为0.1%甲酸溶液—乙腈为流动相, 供试样品分离效果较好。采用PDA检测器对标准样品进行最大吸收光谱扫描, 分析其特征光谱, 确定以265 nm作为定量检测波长。
1.3 统计与分析采用Microsoft Excel 2016软件进行数据处理; 运用SPSS 22.0进行单因素方差分析(one-way ANOVA), 并采用LSD法进行两两比较, 不同大小写字母表示差异达0.01、0.05显著水平。
2 结果与分析 2.1 培养天数对龙眼胚性愈伤组织中柯里拉京含量的影响如图 2所示, 在黑暗培养条件下, 不同培养天数龙眼胚性愈伤组织中柯里拉京含量大小依次为:25 d>30 d>20 d>35 d>15 d。培养15~25 d时, 柯里拉京的合成呈明显上升趋势, 且在培养25 d时达到最大值(8.91 mg·g-1); 而培养25~35 d时, 则呈下降趋势。由此可见, 龙眼胚性愈伤组织中柯里拉京的合成与培养天数密切相关, 25 d为最佳培养天数, 培养天数过短或过长均不利于其积累。
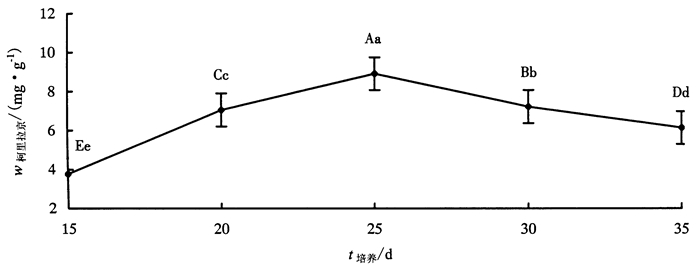
|
图 2 不同培养天数下龙眼胚性愈伤组织柯里拉京含量变化 Figure 2 The changing curve of corilagin content in embryogenic longan callus tissue after different days of culture |
运用SPSS软件进行方差齐性检验、F检验和单因素方差分析, 发现不同培养天数下龙眼胚性愈伤组织柯里拉京含量呈极显著差异。进一步采用LSD法进行多重比较试验, 发现培养25 d时柯里拉京含量极显著大于其他处理(P < 0.01), 其他各组培养天数之间柯里拉京含量的积累也存在极显著差异。由此可知, 黑暗培养25 d龙眼胚性愈伤组织中柯里拉京含量积累最高。
2.2 不同光质对龙眼胚性愈伤组织中柯里拉京含量的影响采用UPLC法测定龙眼胚性愈伤组织中柯里拉京含量, 标准样品和供试样品的图谱见图 3。由图 3可知, 供试样品与标准样品出峰时间接近, 峰形对称, 基线较为平稳, 样品分离效果良好。不同光质处理下, 龙眼胚性愈伤组织中柯里拉京含量(图 4)依次为:黑暗(18.81 mg·g-1)>红光(16.99 mg·g-1)>绿光(16.89 mg·g-1)>白光(15.10 mg·g-1)>蓝光(12.52 mg·g-1)。经方差齐性检验、单因素分析和LSD法多重比较分析, 发现黑暗处理与红光绿光、白光、蓝光处理组柯里拉京含量均存在极显著差异(P=0.000), 除红光与绿光处理之间差异不显著(P=0.8>0.01)外, 其他处理组间差异均达极显著水平。由此可见, 黑暗条件能显著促进龙眼胚性愈伤组织中柯里拉京含量的合成, 蓝光则起明显的抑制作用。
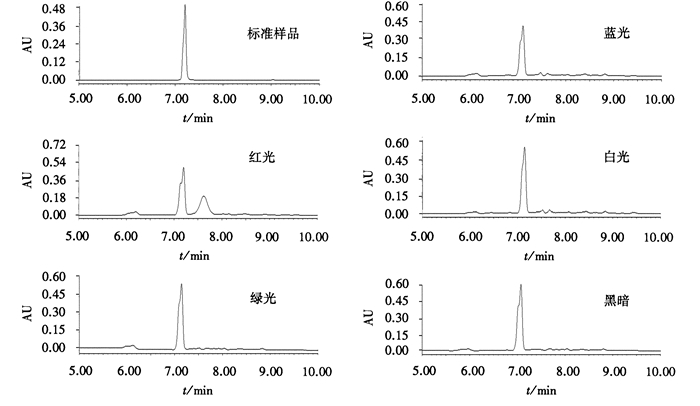
|
图 3 柯里拉京标准样品和供试样品的UPLC图谱 Figure 3 Ultra performance liquid chromatogram of corilagin standards and test samples |
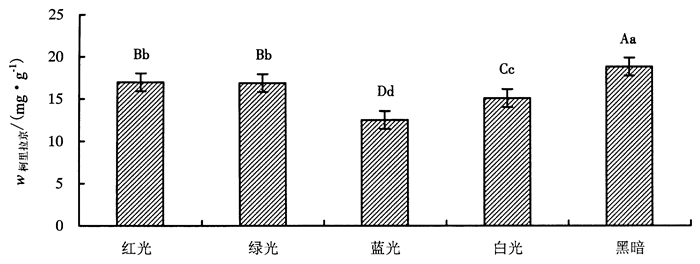
|
图 4 不同光质处理下龙眼胚性愈伤组织柯里拉京含量变化 Figure 4 Changes of corilagin content in embryogenic longan callus under different light treatment |
柯里拉京是多酚羟基化合物的新成员, 在高温或长时间加热条件下易分解[19], 可采用溶液浸提与超声波辅助相结合的方法提取。与大孔树脂吸附法[23]相比, 该方法简便易行, 不仅能极大缩短提取时间, 还能减少柯里拉京在高温下的分解。近年来, 采用HPLC测定柯里拉京含量的研究较多, 与传统HPLC相比, UPLC测定具有分析时间短、精密度高、溶剂耗量少和分离效果好等优点。本研究初步建立了UPLC法测定龙眼胚性愈伤组织中柯里拉京含量的方法, 进一步对色谱条件进行了优化。前人研究[24-25]大多以乙腈—磷酸盐水溶液作为流动相, 但高温条件下若使用pH值为8的磷酸盐缓冲液流动相会使色谱柱寿命缩短, 故采用乙腈—甲酸水溶液作为流动相。此外, 柯里拉京属于水溶性鞣质, 富含多酚羟基, 容易被氧化和水解[26], 故制备的样品应采用棕色瓶避光保存, 最好能在2 h内完成含量测定。
3.2 柯里拉京含量积累与培养天数密切相关次生代谢产物的合成与培养天数密切相关。李琰等[27]研究发现, 杜仲愈伤组织培养16 d时, 总黄酮和绿原酸含量达到最大值; 杨翠芹等[28]研究认为, 金线莲中生物碱含量随着培养时间的延长而上升, 培养50 d时达到峰值。本研究表明, 龙眼胚性愈伤组织黑暗培养25 d时柯里拉京含量达到最大值, 这一结果与董慧雪等[29]关于类黄酮的研究结果一致。在培养前期(15~25 d)龙眼胚性愈伤组织可吸收培养基中大量养分, 细胞旺盛地分裂生长, 能较快地由初生代谢转变为次生代谢, 故柯里拉京含量呈上升趋势; 而培养后期(25~35 d)培养基中参与柯里拉京代谢合成的营养物质逐渐耗尽, 积累的柯里拉京又重新参与其他生物进程, 从而导致其含量降低。
3.3 黑暗条件有利于龙眼胚性愈伤组织中柯里拉京的合成光作为植物生长发育的物理因子, 不同光质对植物的生长发育、形态建成和物质代谢具有不同的调控作用[30-32]。已有研究大多认为蓝光能显著促进次生代谢产物的合成。如赵德修等[33]研究表明, 蓝光能显著提高水母雪莲愈伤组织中PAL活性和黄酮的合成; 李娜等[34]研究发现, 连续蓝光处理36 h能提高合成类黄酮相关基因的表达量以及关键酶PAL与CHI的活性, 从而促进大豆芽苗菜类黄酮的合成。本研究表明, 黑暗条件能显著促进龙眼胚性愈伤组织中柯里拉京的合成, 蓝光则起明显的抑制作用, 这一结果与苏秀红等[35]的研究结果基本一致, 这可能与柯里拉京见光易分解特性相关。王建华[36]研究发现, 黑暗条件最有利于人参愈伤组织生长及次生代谢产物皂苷合成。由此可见, 光质对植物生长发育和次生代谢产物合成的影响具有复杂性, 除了外植体本身的生理生化和发育阶段等重要因素外, 还可能与光照强度、光周期以及生长环境因子(温度、湿度和培养基质)等综合调控有关。
| [1] | 张树峰, 明艳林, 林毅, 等. 叶下珠属植物活性成分柯里拉京研究进展(综述)[J]. 亚热带植物科学, 2010, 39(4): 79–83. |
| [2] | DUAN W, YU Y, ZHANG L. Antiatherogenic effects of phyllanthus emblica associated with corilagin and its analogue[J]. Journal of the Pharmaceutical Society of Japan, 2005, 125(7): 587–591. DOI: 10.1248/yakushi.125.587 |
| [3] | KINOSHITA S, INOUE Y, NAKAMA S, et al. Antioxidant and hepatoprotective actions of medicinal herb, Terminalia catappa L. from Okinawa Island and its tannin corilagin[J]. Phytomedicine, 2007, 14(11): 755–762. DOI: 10.1016/j.phymed.2006.12.012 |
| [4] | PRASAD K N, YANG B, ZHAO M M, et al. High pressure extraction of corilagin from longan (Dimocarpus longan Lour.) fruit pericarp[J]. Separation and Purification Technology, 2009, 70(1): 41–45. DOI: 10.1016/j.seppur.2009.08.009 |
| [5] | 陈一燕, 陈崇宏. 柯里拉京药理活性研究进展[J]. 中国现代应用药学, 2010, 27(5): 390–394. |
| [6] | 郑公铭, 魏孝义, 徐良雄, 等. 龙眼果核化学成分的研究[J]. 中草药, 2011, 42(6): 1053–1056. |
| [7] | 林志灿, 郑溢, 李旎, 等. 不同植物中柯里拉京的含量测定及其对人胃癌细胞增殖的抑制作用[J]. 厦门大学学报(自然科学版), 2016, 55(6): 847–852. |
| [8] | 林靖怡. 纤梗叶下珠柯里拉京的制备工艺及其化学成分的研究[D]. 泉州: 华侨大学, 2015. |
| [9] | 赖钟雄, 陈振光. 龙眼胚性细胞悬浮培养再生植株[J]. 应用与环境生物学报, 2002, 8(5): 485–491. |
| [10] | 谷艾素, 张欢, 崔瑾. 光调控在植物组织培养中的应用研究进展[J]. 西北植物学报, 2011, 31(11): 2341–2346. |
| [11] | SEIBERT M, WETHERBEE P J, JOB D D. The effects of light intensity and spectral quality on growth and shoot initiation in tobacco callus[J]. Plant Physiology, 1975, 56(1): 130–139. DOI: 10.1104/pp.56.1.130 |
| [12] | 王维荣, 王咏冬, 欧阳光察, 等. 光质对黄瓜及番茄愈伤组织培养中分化和有关酶的影响[J]. 植物生理学报, 1991, 17(2): 118–124. |
| [13] | 赖瑞联, 赖恭梯, 张梓浩, 等. 光质对茅膏菜试管苗生长和槲皮素含量的影响[J]. 亚热带农业研究, 2012, 8(4): 231–236. |
| [14] | 范桂枝, 詹亚光, 王博, 等. 光质、光周期对白桦愈伤组织生长和三萜质量分数的影响[J]. 东北林业大学学报, 2009, 37(1): 1–3. |
| [15] | 王莉, 史玲玲, 刘玉军. 不同光质对长鞭红景天悬浮细胞生长及苯丙氨酸解氨酶活性的影响[J]. 林业科学, 2007, 43(6): 52–56. |
| [16] | 罗丽媛, 李胜, 马绍英, 等. LED不同光质对葡萄愈伤组织及白藜芦醇合成的影响[J]. 甘肃农业大学学报, 2010, 45(5): 46–50, 55. |
| [17] | 陈敏氡, 朱海生, 温庆放, 等. UPLC测定草莓果实中类胡萝卜素含量[J]. 果树学报, 2013, 30(4): 706–711. |
| [18] | 赖钟雄, 潘良镇, 陈振光. 龙眼胚性细胞系的建立与保持[J]. 福建农业大学学报, 1997, 26(2): 160–167. |
| [19] | 刘莹, 熊富良, 张雪琼, 等. 正交试验法优选叶下珠的提取工艺[J]. 中国医院药学杂志, 2008, 28(4): 279–280. |
| [20] | 李华, 沈洁. 超声波法从葡萄籽中提取多酚的研究[J]. 酿酒科技, 2005(5): 89–91. |
| [21] | 郑迎春, 李静, 曹玉芬, 等. 梨叶片中9种多酚类物质的UPLC测定方法[J]. 果树学报, 2015, 32(6): 1258–1266. |
| [22] | 李耿, 辛文峰, 杜金行, 等. UPLC法同时测定丹参注射剂中6个成分的含量[J]. 药物分析杂志, 2008, 28(12): 2021–2024. |
| [23] | 李昌勤. HPLC测定蜜柑草中柯里拉京的含量[J]. 中国中药杂志, 2007, 32(16): 1711–1712. DOI: 10.3321/j.issn:1001-5302.2007.16.029 |
| [24] | 徐小萍, 谢燕萍, 慕尧, 等. HPLC法测定LED不同光质下迷迭香愈伤组织中鼠尾草酸含量[J]. 广东农业科学, 2015, 42(15): 77–81. DOI: 10.3969/j.issn.1004-874X.2015.15.014 |
| [25] | 袁永兵, 张兰珍, 郭亚健, 等. RP-HPLC法测定叶下珠中没食子酸、柯里拉京和鞣花酸的含量[J]. 北京中医药大学学报, 2009, 32(1): 56–58. |
| [26] | 熊富良, 张雪琼, 刘莹, 等. HPLC测定解毒保肝分散片中柯里拉京含量[J]. 中成药, 2009, 31(10): 1643–1644. |
| [27] | 李琰, 董娟娥, 姜在民, 等. 杜仲愈伤组织中次生代谢产物积累动态研究[J]. 西北植物学报, 2004, 24(11): 2033–2037. DOI: 10.3321/j.issn:1000-4025.2004.11.009 |
| [28] | 杨翠芹, 秦耀国, 曾富春, 等. 不同培养条件对金线莲多糖与总生物碱含量的影响[J]. 中国农学通报, 2010, 26(23): 259–262. |
| [29] | 董慧雪, 周燕蓉, 田奇琳, 等. 不同光质对龙眼胚性愈伤组织类黄酮含量的影响[J]. 热带作物学报, 2014, 35(12): 2374–2377. DOI: 10.3969/j.issn.1000-2561.2014.12.010 |
| [30] | LEE S H, TEWARI R K, HAHN E J, et al. Photon flux density and light quality induce changes in growth, stomatal development, photosynthesis and transpiration of Withania Somnifera (L.) Dunal. plantlets[J]. Plant Cell, Tissue and Organ Culture, 2007, 90(2): 141–151. DOI: 10.1007/s11240-006-9191-2 |
| [31] | 汪凤林, 林思祖, 叶义全, 等. 杉木幼苗不同光质光响应曲线的模型拟合及光合特性比较[J]. 亚热带农业研究, 2017, 13(3): 165–170. |
| [32] | 林小苹, 赖钟雄, 黄浅. 光质对植物离体培养的影响[J]. 亚热带农业研究, 2008, 4(1): 73–80. |
| [33] | 赵德修, 李茂寅. 光质、光强和光期对水母雪莲愈伤组织生长和黄酮生物合成的影响[J]. 植物生理学报, 1999, 25(2): 127–132. |
| [34] | 李娜, 张晓燕, 田纪元, 等. 蓝光连续光照对大豆芽苗菜类黄酮合成的影响[J]. 大豆科学, 2017, 36(1): 51–59. |
| [35] | 苏秀红, 董诚明, 王伟丽. 光质对冬凌草再生植株生长及次生代谢产物的影响[J]. 时珍国医国药, 2010, 21(12): 3278–3279. DOI: 10.3969/j.issn.1008-0805.2010.12.119 |
| [36] | 王建华. 人参愈伤组织无性系培养条件优化及次生代谢调控研究[D]. 长春: 吉林农业大学, 2006. |
 2018,Vol. 14
2018,Vol. 14


