文章信息
- 陈尧, 张奇, 姜帅, 黄威杭, 李家玉, 何海斌
- CHEN Yao, ZHANG Qi, JIANG Shuai, HUANG Weihang, LI Jiayu, HE Haibin
- 桉树根际土壤抑草放线菌的筛选与鉴定
- Isolation and characterization of herbicidal actinomycetes from rhizosphere soils of Eucalyptus
- 亚热带农业研究, 2018, 14(2): 110-115
- Subtropical Agriculture Research, 2018, 14(2): 110-115.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2018.02.007
-
文章历史
- 收稿日期: 2018-03-20
杂草作为导致作物减产的重要因素之一, 已成为世界性的难题。化学除草剂因作用迅速、使用方便、易于大面积使用, 而成为杂草防治的主要方式[1]。长期大量和非选择性地使用化学除草剂, 会造成土壤和地下水污染, 杂草也会产生抗性[2]; 高浓度的化学除草剂会增加农作物中有害物质的残留。因此, 寻找更加环保的方法防治杂草成为当务之急, 微生物除草剂是其中之一。而从植物根际土壤中筛选具有抑草作用的微生物, 是微生物除草剂研究的主要途径之一[3-5]。
桉树(Eucalyptus robusta)是桃金娘科木本植物, 原产于澳洲, 现已分布于许多热带和亚热带国家[6]。桉树可作为绿化植物, 因其生长速度快, 作为用材林也备受欢迎[7]。有研究表明, 桉树叶片、树干、根系释放的酚酸和挥发油能够抑制一些植物的生长[8-12]。此外, 桉树的种植还会显著降低林下土壤微生物群落多样性和酶活性, 其原因是桉树化感物质对土壤微生物产生影响, 进而减少了林下植物的生长[13-14]。以上研究印证了“桉树树下不长草”的俗语。张奇等[15]从桉树根际土壤筛选到1株对稗草具有强抑制作用的真菌。在此基础上, 本研究拟对桉树根际土壤中放线菌进行分离, 筛选具有抑草作用的潜在菌株, 以期为寻找抑草作用的微生物资源和开发微生物除草剂提供依据。
1 材料与方法 1.1 试验材料 1.1.1 主要试剂细菌基因组提取试剂盒购自生工生物工程(上海)股份有限公司; 高氏一号培养基和其他化学试剂均购自国药集团化学试剂有限公司。
1.1.2 种子莴苣、黄瓜、白菜种子购自福州永荣种子有限公司; 黑麦草、苜蓿种子购自壹叶小草种业有限公司; Ⅱ优航2号水稻种子购自农嘉种业有限公司。
1.2 培养基改良的高氏一号培养基:2 g葡萄糖、0.5 g NaCl、1 g KNO3、0.5 g K2HPO4·3H2O、0.5 g MgSO4·7H2O、0.01 g FeSO4·7H2O、2 g蛋白胨、2 g酵母浸膏, 加去离子水定容至1 000 mL, pH值调至7.0。
1.3 试验方法 1.3.1 菌种初筛按5点取样法, 取福建农林大学博学楼(北纬26°5′22″, 东经119°13′52″)种植的桉树根部周围无草区域的土壤, 按土壤放线菌的标准方法分离放线菌[16]。将土壤样品自然风干后混匀, 按四分法取样10 g, 放入90 mL无菌水中, 摇床180 r·min-1震荡30 min, 得到10-1的水悬浮液。该悬浮液再稀释3个浓度梯度(10-2、10-3和10-4)。从该3个浓度的悬浮液中各吸取0.5 mL, 放于含有高氏一号培养基(内含重铬酸钾、硫酸链霉素、制霉菌素)的15 cm培养皿中。28 ℃培养, 14 d后观察其生长形态。根据各菌落形态特征, 挑选生长特征各异的菌株各1株, 继续用含高氏一号培养基的9 cm培养皿进行纯化, 重复3次后获得单一菌株。将上述单一菌株接种到含有100 mL改良的高氏一号培养基的三角瓶中, 在摇床(180 r·min-1, 28 ℃)上发酵14 d, 发酵液用0.22 μm滤膜过滤后, 用于后续试验。用高氏一号培养基做成的斜面在4 ℃下保存菌株。
1.3.2 菌种复筛采用发酵液测试抑草潜力, 并通过实验室生物测试的方法进行评价[17]。即以莴苣为受体, 在组培瓶中加入5 mL发酵液(无菌水稀释50倍, 过0.22 μm滤膜), 每个组培瓶中播入5粒刚冒芽的莴苣种子, 以蒸馏水为对照, 设置4个重复。组培瓶放置于培养箱(28 ℃, 12 h光照), 培养3 d后测定莴苣的根长和株高。生测结果表明, 菌株A10对莴苣有最强的抑制率, 因此用其进行后续试验。
IR/%=(1-TR/CK)×100。其中, IR为抑制率, TR为处理, CK为对照。
1.3.3 菌种鉴定(1) 形态学鉴定。利用高倍显微镜观察菌丝以及分生孢子形态, 对A10菌株进行形态学初步鉴定[18]。
(2) 16S rDNA鉴定。利用Ezup柱式细菌基因组DNA抽提试剂盒提取纯化的A10基因组DNA。根据放线菌鉴定的特异性引物(上游引物NS1:5′-GTAGTCATATGCTTGTCTC-3′, 下游引物NS4:5′-GCATCACAGACCTGTTATTGCCTC-3′), 对菌株进行PCR。目的片段大小约1 449 bp。PCR扩增体系为25 μL, 其中10×Buffer(含Mg2+) 2.5 μL、上下游引物(10 μm·mL-1)各0.5 μL, DNA 0.5 μL, dNTP(各2.5 mmol·L-1)0.1 μL, 补充灭菌去离子水至25 μL。反应条件为94 ℃ 4 min预变性后进入循环, 循环参数为94 ℃ 45 s、55 ℃ 45 s、72 ℃ 1 min, 30个循环后, 72 ℃延伸10 min。取PCR产物5 μL, 在质量分数为1%琼脂糖凝胶上电泳。PCR产物经胶回收试剂盒纯化后委托生工生物工程(上海)股份有限公司进行序列测定, 并将序列信息经NCBI数据库分析比对。利用MEGA 5.05软件进行系统发育分析。采用邻接法(neighbor-joining, NJ)构建系统进化树。
1.3.4 A10菌株发酵液对不同植物的影响以水稻、黄瓜、白菜、黑麦草为受体, 分别将菌液稀释100倍后, 取5 mL发酵液加入到组培皿中, 按1.3.2中方法进行。
1.3.5 A10菌株最优培养条件的确定和抑草活性验证分别以葡萄糖、蔗糖、甘露醇、可溶性淀粉为碳源, 以蛋白胨、硝酸铵、氯化胺和酵母浸膏为氮源, 进行碳源和氮源优化。最优温度优化设置20、25、30、35 ℃, 最优pH优化设置2.0、4.0、6.0、8.0。除碳源和氮源外, 培养基中还含有KH2PO4(0.1%)、MgSO4(0.05%)、FeSO4(0.01%)、琼脂(2%)。每种培养基倒3个平板, 在平板中间接入0.8 cm的菌饼, 培养箱30 ℃下培养14 d后, 测量菌落直径。
用滤纸做介质, 在组培瓶中加入5 mL发酵液(优化培养基培养后过0.22 μm滤膜, 发酵方法见1.3.1), 以紫花苜蓿为受体, 按1.3.2方法进行优化后发酵液生测。
1.4 统计与分析方差、显著性分析均使用DPS 7.05软件进行。微生物系统进化树的构建采用MEGA软件进行。
2 结果与分析 2.1 菌株发酵液对莴苣生长的影响从桉树根际土壤共分离纯化了14个放线菌。以莴苣为受体的生测结果表明(表 1):A2、A5、A6、A10、A11、A12、A13和A14共8个菌株对莴苣根长有抑制作用, 且A10、A13和A14 3个菌株抑制率>20%, 以A10菌株抑制率最高(53.93%)。对莴苣株高有抑制作用的有A3、A6、A9、A10和A14, 其中A10菌株抑制率最高, 达29.71%。以上结果表明, A10菌株对莴苣根长和株高的生长都有强抑制作用。
| 处理 | 抑制率/% | |
| 根长 | 株高 | |
| A1 | -2.84±5.59 | -12.55±7.40 |
| A2 | 17.42±7.24 | -8.67±5.90 |
| A3 | -3.74±3.48 | 11.56±5.66 |
| A4 | -8.32±5.36 | -13.96±11.48 |
| A5 | 5.72±6.41 | -17.25±7.53 |
| A6 | 3.73±7.21 | 0.38±9.06 |
| A7 | -2.59±6.35 | -7.77±5.89 |
| A8 | -1.63±6.98 | -15.40±9.72 |
| A9 | -1.22±12.24 | 1.89±9.48 |
| A10 | 53.93±4.55 | 29.71±10.32 |
| A11 | 5.15±5.78 | -8.67±12.05 |
| A12 | 9.19±14.48 | -6.34±8.54 |
| A13 | 27.37±6.90 | -12.39±9.77 |
| A14 | 28.47±10.15 | 1.35±7.52 |
在所筛选的14株菌株中, 由于A10菌株对莴苣的根长、株高都有较强的抑制作用, 因此对其进行形态学鉴定和分子生物学鉴定。
2.2.1 形态学鉴定A10菌株在28 ℃高氏一号培养基培养7 d, 生长速度较慢。7 d后表面老菌落呈红色, 具同心圆, 有气生菌丝, 边缘呈辐射状延伸; 菌落表面呈致密、干燥的干粉状, 多皱、小而不蔓延、不易挑起, 有放射状沟纹和渗出物, 无味。在显微镜下可见, A10菌株有分支状菌丝, 气生菌丝通常发育良好, 形成长的孢子丝; 孢子不能运动, 外鞘上常有毛状饰物(图 1)。根据《放线菌快速鉴定与系统分类》[18], 可初步鉴定A10菌株是链霉菌株(Streptomyces)。
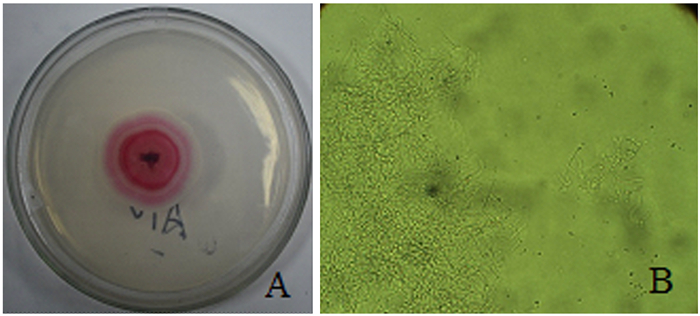
|
图 1 A10菌株形态学特征 Figure 1 The morphology of the A10 strain A.培养基上菌落形态; B.菌丝(×400)。 |
A10菌株的16S rDNA序列测序结果显示, 其序列共有1 449 bp碱基。碱基序列通过NCBI数据库上进行blast同源性比对, 从中筛选14个个体, 将这14个个体与待测目标序列利用MEGA软件进行系统进化树的构建(图 2)。
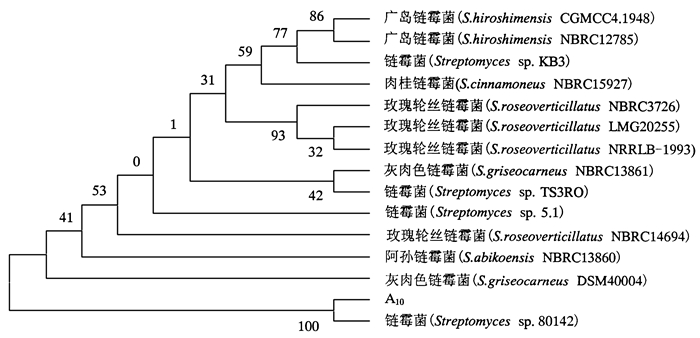
|
图 2 利用邻接法构建的进化树 Figure 2 The phylogenetic tree of the A10 strain |
从进化树(图 2)可以看出, 待测目标序列A10与链霉菌属中的Streptomyces sp.80142亲源性最近, 且它们之间的序列相似度达到99%。由此可以确定A10菌株为链霉菌菌株。
2.3 A10菌株发酵液对受体植物的影响生测结果表明, A10发酵液对不同受体植物生长的抑制效果有差异(表 2)。A10发酵液对4种受体植物的根长都有抑制作用, 且对白菜根长抑制效果超过了30%。但A10只对黄瓜和白菜的株高有抑制作用, 其中对黄瓜株高的抑制率高于10%;而对水稻和黑麦草株高的抑制率为负值, 即具有促进作用。
| 受体植物 | 抑制率/% | |
| 根长 | 株高 | |
| 水稻 | 10.13±1.12 | -7.18±1.53 |
| 黄瓜 | 17.66±2.01 | 12.01±0.79 |
| 白菜 | 31.70±1.42 | 1.57±1.13 |
| 黑麦草 | 18.45±2.05 | -9.04±0.98 |
从表 3可见, 葡萄糖中生长的A10菌落直径最大, 达1.96 cm, 与蔗糖中的菌落直径差异不显著, 与以可溶性淀粉、甘露醇为碳源的差异达到显著水平, 说明A10最适宜碳源是蔗糖或葡萄糖。在酵母浸膏中生长的菌株菌落直径最大, 达3.48 cm, 与硝酸铵、蛋白胨和硫酸铵为氮源的菌株达显著差异, 说明A10最适宜氮源是酵母浸膏。从表 3还可见, 菌株A10的最佳培养温度在30 ℃左右; 在pH=6.0时, 菌落直径最大, 为1.74 cm。
| 碳源 | 菌落直径/cm | 氮源 | 菌落直径/cm | 温度/℃ | 菌落直径/cm | pH | 菌落直径/cm | |||
| 蔗糖 | 1.71±0.03ab | 硫酸铵 | 0.23±0.05c | 20 | 1.13±0.02c | 2.0 | 0.98±0.02c | |||
| 甘露醇 | 1.60±0.04b | 蛋白胨 | 1.85±0.01b | 25 | 1.52±0.03b | 4.0 | 1.25±0.02b | |||
| 淀粉 | 1.12±0.04c | 硝酸铵 | 1.90±0.05b | 30 | 1.91±0.03a | 6.0 | 1.74±0.05a | |||
| 葡萄糖 | 1.96±0.05a | 酵母浸膏 | 3.48±0.03a | 35 | 1.79±0.04ab | 8.0 | 1.39±0.03b | |||
| 1)同列数据后附不同字母者表示差异达0.05显著水平。 | ||||||||||
优化后A10发酵液对苜蓿根长和株高的抑制率都有所提高(图 3), 对根长的抑制率(52.71%)比优化前提高了13.55%, 且具有显著差异; 对株高抑制率(6.10%)提高了2.99%, 没有显著差异。
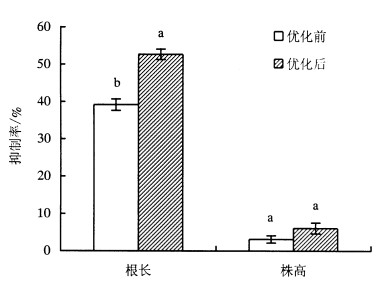
|
图 3 优化培养条件后A10发酵液对紫花苜蓿生长的影响 Figure 3 Inhibitory effect of A10 strain ferments on the growth of alfalfa after the optimization of culture conditions |
桉树具有化感作用, 可以抑制林下植物生长[13-14]。因此, 从桉树土壤中筛选微生物并应用于杂草防治, 具有丰富微生物资源及其开发利用的价值。本研究从桉树根际土壤中分离了14个放线菌, 通过莴苣受体的初步验证, 筛选到1株具有强抑制作用的菌株A10。经过形态学和分子生物学的双重鉴定表明, 该菌株是链霉菌(Streptomyces)。优化培养条件后, A10发酵液对紫花苜蓿的根长和株高抑制率分别为52.71%和6.10%, 具有潜在的抑制杂草的开发利用价值。据报道, 链霉菌属具有产抗生素的功能[19], 也可利用链霉菌属菌株来促进小麦的生长和减少病原菌对小麦的侵染[20]。
已有报道表明, 可以从特定的植物根际筛选微生物并应用于田间的杂草防制[21-23]。孙巍[24]在不同地区土壤中筛选到1株灰色链霉菌, 对稗草萌发和生长都有强抑制作用。张奇等[15]从桉树根际土壤筛选到1株真菌, 其发酵液对稗草具有较好的抑制效果。许学胜等[25]研究表明, 链霉菌发酵液对高粱、马唐和苋菜的根长都有显著的抑制作用, 但对水稻、小麦和高粱的萌发没有影响。以上研究证明了利用微生物的代谢产物进行除草是可行的[25-26]。目前, 对于放线菌作为植物田间防治的研究很多, 主要是对植物病虫害防治方面, 针对杂草防治的研究相对较少。本研究提供了一条利用放线菌防治杂草的途径。本结论仅涉及实验室所筛选菌株发酵液的初步结果, 其应用价值和应用方式尚需进一步通过田间试验给予验证, 并通过剂量与效率评价。
| [1] | 白勇, 王晓燕, 胡光, 等. 非化学方法在农田杂草防治中的应用[J]. 农业机械学报, 2007, 38(4): 191–196. |
| [2] | DUKE S O, DAYAN F E, ROMAGNI J G, et al. Natural products as sources of herbicides:current status and future trends[J]. Weed Research, 2000, 40(1): 99–111. DOI: 10.1046/j.1365-3180.2000.00161.x |
| [3] | HOAGLAND R E, BOYETTE M A, BOYETTE C D. Myrothecium verrucaria fungus:a bioherbicide and strategies to reduce its non-target risks[J]. Allelopathy Journal, 2007, 19(1): 179–192. |
| [4] | HAO S H, WEI Y, WANG J, et al. Allelopathy and the active metabolites of the endophytic fungus, Alternaria J46, from Platycladus orientalis[J]. Weed Biology and Management, 2015, 15(3): 95–101. DOI: 10.1111/wbm.12072 |
| [5] | ANDERSON K I, HALLETT S G. Herbicidal spectrum and activity of Myrothecium verrucaria[J]. Weed Science, 2004, 52(4): 623–627. DOI: 10.1614/WS-03-101R1 |
| [6] | COSSALTER C, PYE-SMITH C. Fast-wood forestry: myths and realities[R]. Bogor Indonesia: CIFOR, 2003. |
| [7] | 赖学文. 大面积种植桉树对生态的影响分析[J]. 南方农业, 2016, 10(3): 107–107. |
| [8] | 薛立, 赖日石, 陈红跃, 等. 深圳宝安区生态风景林典型造林地土壤养分、微生物和酶活性的研究[J]. 林业科学研究, 2002, 15(2): 242–246. |
| [9] | TURNBULL J W. Eucalypt plantations[J]. New Forests, 1999, 17(1/2/3): 37–52. |
| [10] | BAJWA R, NAZ I. Allelopathic effects of Eucalyptus citriodora on growth, nodulation and AM colonization of Vigna radiata (L.) Wilczek[J]. Allelopathy Journal, 2005, 15(2): 237–246. |
| [11] | FLORENTINE S K, JED F. Allelopathic effects of Eucalyptus victrix L.on Eucalyptus species and grasses[J]. Allelopathy Journal, 2003, 11(1): 77–83. |
| [12] | SASIKUMAR K, VIJAYALAKSHMI C, PARTHIBAN K T. Allelopathic effects of Eucalyptus on blackgram (Phaseolus mungo L.)[J]. Allelopathy Journal, 2002, 9(2): 205–214. |
| [13] | CHEN F L, ZHENG H, ZHANG K, et al. Soil microbial community structure and function responses to successive planting of Eucalyptus[J]. Journal of Environmental Sciences, 2013, 25(10): 2102–2111. DOI: 10.1016/S1001-0742(12)60319-2 |
| [14] | BEHERA N, SAHANI U. Soil microbial biomass and activity in response to Eucalyptus plantation and natural regeneration on tropical soil[J]. Forest Ecology and Management, 2003, 174(1-3): 1–11. DOI: 10.1016/S0378-1127(02)00057-9 |
| [15] | 张奇, 胡文文, 林晓丹, 等. 桉树根区土壤中抑草真菌的筛选分离[J]. 福建农林大学学报(自然科学版), 2015, 44(2): 159–164. |
| [16] | 胡开辉. 微生物学实验[M]. 北京: 中国林业出版社, 2004. |
| [17] | HE H B, WANG H B, FANG C X, et al. Herbicidal effect of a combination of oxygenic terpenoids on Echinochloa crus-galli[J]. Weed Research, 2009, 49(2): 183–192. DOI: 10.1111/j.1365-3180.2008.00675.x |
| [18] | 阮继生, 黄英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011. |
| [19] | 蒋细良, 谢德龄, 倪楚芳, 等. 中生菌素的抗生作用[J]. 植物病理学报, 1997, 27(2): 133–138. |
| [20] | HAMDALI H, HAFIDI M, VIROLLE M J, et al. Growth promotion and protection against damping-off of wheat by two rock phosphate solubilizing actinomycetes in a P-deficient soil under greenhouse conditions[J]. Applied Soil Ecology, 2008, 40(3): 510–517. DOI: 10.1016/j.apsoil.2008.08.001 |
| [21] | KREMER R J, SOUISSI T. Cyanide production by rhizobacteria and potential for suppression of weed seedling growth[J]. Current Microbiology, 2001, 43(3): 182–186. DOI: 10.1007/s002840010284 |
| [22] | KREMER R J, KENNEDY A C. Rhizobacteria as biocontrol agents of weeds[J]. Weed Technology, 1996, 10(3): 601–609. DOI: 10.1017/S0890037X00040525 |
| [23] | ŌTAKE N. Recent progress in research on agricultural antibiotics in Japan[M]//TAKAHASHI N, YOSHIOKA H, MATSUNAKA S. Natural Products: Proceedings of the 5th International Congress of Pesticide Chemistry, Kyoto, Japan, 29 August-4 September 1982. Amsterdam: Elsevier, 1983. |
| [24] | 孙巍. 除草放线菌的筛选及其培养条件的研究[D]. 沈阳: 沈阳农业大学, 2006. |
| [25] | 许学胜, 李孙荣. 一种放线菌产生的植物生长抑制剂[J]. 杂草学报, 1991, 5(2): 10–14. |
| [26] | EINHELLIG F A, LEATHER G R. Potentials for exploiting allelopathy to enhance crop production[J]. Journal of Chemical Ecology, 1988, 14(10): 1829–1844. DOI: 10.1007/BF01013480 |
 2018,Vol. 14
2018,Vol. 14


