文章信息
- 郑学立, 谢鑫鑫, 邵贵荣, 黄建都, 陈雨静
- ZHENG Xueli, XIE Xinxin, SHAO Guirong, HUANG Jiandu, CHEN Yujing
- 不结球白菜‘福冠’软腐病病原菌鉴定
- Identification of pathogens causing soft rot disease in non-heading Chinese cabbage 'Fuguan'
- 亚热带农业研究, 2018, 14(1): 48-54
- Subtropical Agriculture Research, 2018, 14(1): 48-54.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2018.01.010
-
文章历史
- 收稿日期: 2017-11-07
细菌性软腐病是白菜类蔬菜三大病害之一,在生产、运输、贮藏和销售环节均会发生,严重影响该类蔬菜的供应[1-2]。土壤中残留病菌及种子自带病菌是细菌性软腐病发病的主要原因,在低温(15~20 ℃)、多雨及高湿条件下,病菌易通过伤口侵入植株[3]。白菜类蔬菜细菌性软腐病多为果胶杆菌属(Pectobacterium)。果胶杆菌属原为胡萝卜欧文氏菌(Erwinia carotovora),其细胞呈直杆状,革兰氏阴性,兼性厌氧,鞭毛周生,寄生于植物并引起腐败病,主要包括3个亚种:胡萝卜果胶杆菌(P.carotovorum)、黑腐果胶杆菌(P.atrosepticum)和山葵果胶杆菌(P.wasabiae)[4]。目前,引起细菌性软腐病的病原菌主要为胡萝卜果胶杆菌胡萝卜软腐亚种或其变种[5]。
病原菌的致病过程实质是病原菌与寄主互相作用的过程,可分为非亲和性互作和亲和性互作两种类型[6-7]。非亲和性互作是指在植物生长前期或正常条件下,病原菌处于潜伏侵染状态,与寄主形成平衡,不大量繁殖,植物也未表现出明显症状;亲和性互作是指植物生长后期或处于不良环境时,病原菌与寄主的平衡被打破,病原菌大量繁殖,表现出软腐病症状[7]。病原菌致病性主要通过自身分泌的细胞壁降解酶发生作用,由果胶酶(含果胶酸盐裂解酶和多聚半乳糖醛酸酶)、纤维素酶和蛋白酶组成。纤维素酶和蛋白酶在致病过程中虽不是最重要的致病因子,但可与其他酶类协同侵染植物[8-10],而果胶酶尤其是果胶酸盐裂解酶,是软腐病病原菌的主要致病因子[11-13],可降解植物组织细胞壁进而引起组织浸离,最后导致整个植株腐烂。
不结球白菜在南方地区生长周期短,种植面积大,且可以周年生产,是福建省主要供应的绿叶菜之一。因气候温湿,福建省白菜类蔬菜软腐病的发生较为严重。本研究从田间患软腐病不结球白菜植株中成功分离出软腐病病原菌,通过对软腐病关键基因pel的克隆与序列分析,并结合形态观察和致病性试验,对分离的病原菌进行鉴定,获得1个不结球白菜软腐病病原菌,以期为十字花科蔬菜软腐病的防治提供依据。
1 材料与方法 1.1 试验材料试验所用不结球白菜品种为‘福冠’,由福州市蔬菜科学研究所不结球白菜课题组提供。
1.2 试验方法 1.2.1 病原菌的分离选出疑似感染软腐病的不结球白菜植株,观察并记录其发病症状。选择具有典型发病症状的患病植株,取腐烂组织置于流水中冲洗5~10 min,用刀片(已消毒)切下小块叶片的病健结合部,置于体积分数为75%酒精中消毒30 s,转入体积分数为1%次氯酸钠消毒1 min,再用无菌水清洗3次,加入5 mL无菌水静置15 min,获得细菌悬浮液。
将细菌悬浮液稀释100倍后于LB固体培养基上划线,28 ℃培养1~2 d。当培养皿中出现圆形菌落时,用接种针挑取单菌落并置于新LB固体培养基中划线培养,重复上述操作2~3次,直到得到纯化菌株。
1.2.2 pel基因保守区的PCR鉴定分别以Y1:TTACCGGACGCCGAGCTGTGGCG和Y2:CAGGAAGATGTCGTTATCGCGAGT为上、下游引物[14],以分离出的病原菌菌液为模板,对pel基因片段进行PCR扩增,反应体系为50 μL。扩增体系为:EXTaq酶(5 U·μL-1) 0.5 μL;10×EX PCR Buffer 5 μL;上、下游引物各2 μL;10 mmol·L-1 dNTP 1 μL;菌液1 μL;ddH2O 38.5 μL。PCR反应体系为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸90 s,28个循环;72 ℃延伸10 min,10 ℃保温1 min。PCR产物采用1.0%琼脂糖凝胶进行电泳鉴定,回收并送至上海华大基因科技有限公司进行测序,将测序结果于NCBI数据库中进行比对分析。
1.2.3 病原菌的形态及生理生化鉴定病原菌的形态鉴定参考文献[15]。将上述获得的菌株置于LB液体培养基中培养16~24 h后,于显微镜下观察,发现革兰氏染色呈阴性。将菌株置于LB培养皿上培养2~3代后,用负染法(磷钨酸)进行染色,置于透射电子显微镜中观察其形态。对氧化酶葡萄糖产酸、蔗糖产酸、甘油产酸、果胶盐酸降解、厌氧性、明胶液化、D-葡萄糖产气,以及在37 ℃和体积分数为7%NaCl下是否生长等生理生化特性进行鉴定。
1.2.4 病原菌的致病性鉴定将菌株置于LB液体培养基中,28 ℃、180 r·min-1培养16~24 h,待菌液D=0.6时取出,并置于25 ℃、湿度90%的人工气候箱中培养,每24 h观察发病情况。(1)离体鉴定。选取健康的不结球白菜叶柄,流水冲洗5~10 min后,在超净工作台上用刀片切成5 cm×5 cm的小块,用75%酒精消毒30 s,转入1%次氯酸钠消毒1 min,再用无菌水清洗3次,吸净水分置于铺有灭菌滤纸(无菌水浸湿)的培养皿中进行离体鉴定。共设4个处理:用消毒过的锋利刀片在不结球白菜叶柄处交叉割两道长约1 cm,深约2 mm的伤口,用注射器分别吸取0.5 mL的菌液(处理1)、LB液体培养基(处理2)、灭菌去离子水(处理3)喷洒伤口表面;不划伤口,直接吸取0.5 mL菌液喷洒叶柄组织表面(处理4),各处理喷洒时均以形成悬浮滴为宜。(2)活体鉴定。将高温灭菌过的基质(草炭:蛭石:田园土=1:1:3)装入8 cm×8 cm的营养钵中,每个营养钵播种2粒种子,每个处理10株,共40株。待不结球白菜长至6~8片真叶时[16]进行活体鉴定。共设4个处理:用刀片在叶柄处划十字伤口,用注射器吸取0.5 mL菌液(处理5)、LB液体培养基(处理6)、灭菌去离子水(处理7)喷洒植株表面;不切割伤口,直接吸取0.5 mL菌液喷洒植株表面(处理8)。各处理喷洒时均以形成悬浮滴为宜。
选用健康的不结球白菜叶柄和长至6~8片真叶的不结球白菜植株,采用回接法对上述分离出的菌株进行致病性分析。
1.2.5 病原菌的重新分离与鉴定从上述患病组织中重新分离病原菌,分离方法同1.2.1。随机挑取10个分离纯化的菌落置于28 ℃的LB液体培养基中,培养至对数期时进行菌液PCR鉴定。分别以Y1、Y2为上、下游引物,以病原菌菌液为模板,进行PCR扩增,反应程序同1.2.2。PCR产物采用1.0%琼脂糖凝胶进行电泳鉴定,回收送至上海华大基因科技有限公司进行测序,并将测序结果与之前接种的病原菌进行比对分析。
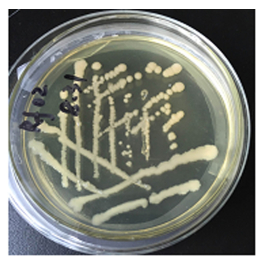
2 结果与分析 2.1 病原菌的观察与分离对田间不结球白菜软腐病观察发现,该病原菌主要通过雨水、灌溉水、肥料、土壤、昆虫等途径进行传播,多从患部伤口或自然裂口侵入,主要危害茎基部及叶柄基部,病害由初呈水渍状半透明病斑逐渐扩大,终致全株软腐枯死,并散发恶臭(图 1),在高温高湿及虫害多的环境下更为严重。从不结球白菜患病组织中分离纯化得到10个圆形单菌落,并培养出10个病原菌菌株,各菌株的菌落形态无明显差异,表面光滑,菌斑凸起,呈乳白色(图 2)。

|
图 1 不结球白菜软腐病田间症状 Figure 1 The soft rot disease symptoms of non-heading Chinese cabbage in the field |
|
图 2 LB固体培养基上的菌株 Figure 2 Soft rot disease pathogen grown on LB solid medium |
PCR鉴定结果显示10个菌株均显阳性,片段大小在430 bp左右。随机选取2个阳性菌株进行回收测序,发现其pel基因保守片段同源性为100%(图 3),为同一菌株。将该序列在NCBI数据库上进行比对分析,结果见图 4。该基因片段BC-RF与胡萝卜软腐果胶杆菌(原胡萝卜软腐欧文氏菌)的pel基因(GenBank: J03673.1)同源性为97.7%。

|
图 3 pel基因保守片段的扩增 Figure 3 Nucleotide sequence of amplified conservative fragment of pectin hydrochloric acid lyase (pel) gene |

|
图 4 pel基因序列比对分析 Figure 4 Sequence alignment analysis of pectin hydrochloric acid lyase (pel) gene |
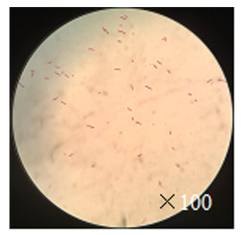
菌体为短杆状,两端钝圆,大小约(0.5~1.0) μm×(1.0~3.0) μm,周生2~8根鞭毛(图 5、6)。生理生化鉴定结果见表 1。由表 1可知,该菌株明胶液化、D-葡萄糖发酵产气,37 ℃、7%NaCl下可以生长,可利用葡萄糖、蔗糖、甘油产酸,符合胡萝卜果胶杆菌胡萝卜软腐亚种病原菌的形态特征描述。
|
图 5 菌株革兰氏染色 Figure 5 Gram staining of the isolated strain under an optical microscope |

|
图 6 菌株负染法染色 Figure 6 Negative staining of the isolated strain under electron microscopy |
| 反应类别 | 鉴定结果1) |
| 革兰氏反应 | - |
| 氧化酶 | - |
| 葡萄糖产酸 | + |
| 蔗糖产酸 | + |
| 甘油产酸 | + |
| 果胶盐酸降解 | + |
| 37 ℃生长 | + |
| 7%NaCl生长 | + |
| 厌氧性 | 兼性厌氧性 |
| 明胶液化 | + |
| D-葡萄糖产气 | + |
| 1)+.阳性;-.阴性。 | |
病原菌致病性鉴定结果见图 7、8。处理1和处理5表现出明显病害,处理1接种病原菌24 h后,植株叶柄出现水渍状半透明病斑,随着时间的推移,病斑逐渐变大,48 h后叶柄全部腐烂坏死(图 7);处理5接种病原菌24 h后,植株叶柄也出现水渍状半透明病斑,48 h后植株腐烂倒塌(图 8)。处理2、处理3和处理6、处理7分别用LB液体培养基和灭菌去离子水处理离体组织及植株,均未发现病害。处理4初期仅在外围切口发现病害,中间部位未见病害,后期全部腐烂。处理8植株健康无病害。

|
图 7 软腐病侵染不结球白菜叶柄 Figure 7 Disease symptom of non-heading Chinese cabbage petiole infected with soft rot pathogens A~C分别为接种0、24、48 h; 1~4分别为处理1~处理4。 |

|
图 8 软腐病侵染不结球白菜植株 Figure 8 Disease symptom of non-heading Chinese cabbage plants infected with soft rot pathogens 第1~3行分别为接种0、24、48 h; 5~8分别为处理5~处理8。 |
综上所述,软腐病病害需从伤口侵入,未见伤口的组织及植株不易感染。病原菌从伤口侵入后,逐渐向周围扩散,由最初的水渍状半透明病斑逐渐扩大至全部坏死,并散发出恶臭,与田间软腐病病症一致。
2.5 病原菌的重新分离与鉴定从接种病原菌的患病组织中再次分离病原菌,获得菌落形态一致的菌株8个,其形态与接种的病原菌一致。随机选取2个病原菌进行pel基因菌液PCR扩增,并进行测序比对分析,2个菌株与接种菌株的pel基因序列的同源性为100%。说明重新分离的菌株与接种菌株为同一菌株,进一步说明本试验分离出的病原菌为使植株患软腐病的病原菌。
3 讨论本研究表明,高温多雨气候软腐病爆发严重,主要由于高温多雨气候易使叶片基部处于浸水和缺氧状态,降低了寄主的愈伤能力,且降雨易使害虫向蔬菜内部钻藏、啃食,加速病原菌的繁殖与传播,这与王秀英等[17]、李跃进[18]、程施等[19]、芦铁雁[20]、李焕玲等[21]的研究结果一致。本研究从田间不结球白菜腐烂组织中筛选分离软腐病病原菌,通过对软腐病致病关键基因pel保守序列进行PCR扩增筛选获得病原菌菌株,该病原菌菌株为胡萝卜果胶杆菌。
软腐病病原菌的致病能力与环境相关,高温高湿环境有利于病原菌的繁殖。参考臧威等[16]、房伟民等[22]、史国立等[23]研究结果,选用28 ℃、相对湿度90%的环境,接种幼苗选择6~8片真叶植株,通过致病性试验进一步证明分离的菌株为胡萝卜果胶杆菌。接种试验发现有伤口且喷洒病原菌菌液的组织及植株表现出致病性,没有伤口喷洒病原菌菌液或者有伤口喷洒无菌水及LB培养基的植株不患病。说明软腐病病害必须从伤口侵入,并向周围扩散,最终全部腐烂死亡。重新分离的病原菌与之前接种的病原菌一致,说明本研究初步分离出了不结球白菜软腐病病原菌,其形态及生理生化特征与胡萝卜果胶杆菌胡萝卜亚种相符,能使植株表现出软腐病症状,该病原菌属胡萝卜果胶杆菌胡萝卜亚种,除了危害白菜、甘蓝、花椰菜等十字花科作物,还会危害黄瓜、莴苣及其他粮食作物、果树等[24-25]。
| [1] | 赵淑莲, 苗永建. 十字花科蔬菜常见病害及防治[J]. 吉林农业, 2013(7): 28. |
| [2] | 黄碧波, 曾静. 菜心、小白菜主要病虫害及防治[J]. 中国农业信息, 2014(3): 123. |
| [3] | 刘志华, 文明英, 刘剑眉, 等. 白菜类软腐病的发生与综合防治[J]. 上海蔬菜, 2007(6): 73–74. |
| [4] | 冯洁. 植物病原细菌分类最新进展[J]. 中国农业科学, 2017, 50(12): 2305–2314. DOI: 10.3864/j.issn.0578-1752.2017.12.011 |
| [5] | 刘宜生. 中国大白菜[M]. 北京: 中国农业出版社, 1998. |
| [6] | 李婷. 胡萝卜软腐果胶杆菌致病相关基因的功能分析[D]. 南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013284590.htm |
| [7] | 王金生, 董汉松, 方中达. 大白菜软腐病潜伏侵染的组织病理学研究[J]. 植物保护学报, 1985, 12(3): 189–194. |
| [8] | 李洋, 张俊莲, 白江平, 等. 马铃薯软腐病菌Erwinia carotovora subsp.carotovora 714种胞外酶基因的克隆和原核表达分析[J]. 草业科学, 2014, 31(4): 561–574. |
| [9] | MARITS R, KÕIV V, LAASIK E, et al. Isolation of an extracellular protease gene of Erwinia carotovora subsp.carotovora strain SCC3193 by transposon mutagenesis and the role of protease in phytopathogenicity[J]. Microbiology, 1999, 145(8): 1959–1966. DOI: 10.1099/13500872-145-8-1959 |
| [10] | 贾云鹤, 张俊华, 崔崇士. 软腐欧文氏菌致病性的研究进展[J]. 东北农业大学学报, 2007, 38(1): 113–118. |
| [11] | CAO J W, ZHENG L S, CHEN S Y. Screening of pectinase producer from alkalophilic bacteria and study on its potential application in degumming of ramie[J]. Enzyme and Microbial Technology, 1992, 14(12): 1013–1016. DOI: 10.1016/0141-0229(92)90087-5 |
| [12] | BRVHLMANN F, LEUPIN M, ERISMANN K H, et al. Enzymatic degumming of ramie bast fibers[J]. Journal of Biotechnology, 2000, 76(1): 43–50. DOI: 10.1016/S0168-1656(99)00175-3 |
| [13] | LEI S P, LIN H C, WANG S S, et al. Characterization of the Erwinia carotovora pelB gene and its product pectate lyase[J]. Journal of Bacteriology, 1987, 169(9): 4379–4383. DOI: 10.1128/jb.169.9.4379-4383.1987 |
| [14] | DARRASSE A, PRIOU S, KOTOUJANSKY A, et al. PCR and restriction fragment length polymorphism of a pel gene as a tool to identify Erwinia carotovora in relation to potato disease[J]. Applied and Environmental Microbiology, 1994, 60(5): 1437–1443. |
| [15] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998. |
| [16] | 臧威, 崔崇士, 张耀伟. 大白菜软腐病苗期抗性鉴定方法的研究[J]. 北方园艺, 2003(3): 57–58. |
| [17] | 王秀英, 巫东堂, 赵军良, 等. 十字花科蔬菜常见病害的发生与防治[J]. 中国瓜菜, 2011, 24(2): 72–74. |
| [18] | 李跃进. 白菜类软腐病的发生原因分析与综合防治措施[J]. 农村经济与科技, 2012, 23(3): 18–19. |
| [19] | 程施, 程蕾. 大白菜软腐病的发生及综合防治[J]. 植物医生, 2013, 26(2): 14–16. |
| [20] | 芦铁雁. 大白菜病毒病、霜霉病、软腐病的症状区别与防治[J]. 现代农村科技, 2012(3): 30–31. |
| [21] | 李焕玲, 李宝聚. 花椰菜软腐病的发生与防治[J]. 中国蔬菜, 2013(3): 27–29. |
| [22] | 房伟民, 陈发棣, 周学青, 等. 种球规格及GA3处理对彩色马蹄莲产花性之影响(简报)[J]. 上海农业学报, 2002, 18(2): 49–51. |
| [23] | 史国立, 崔崇士, 张耀伟. 大白菜对软腐病抗性的快速鉴定方法研究[J]. 植物保护, 2006, 32(6): 135–138. |
| [24] | AVROVA A O, HYMAN L J, TOTH R L, et al. Application of amplified fragment length polymorphism fingerprinting for taxonomy and identification of the soft rot bacteria Erwinia carotovora and Erwinia chrysanthemi[J]. Applied and Environmental Microbiology, 2002, 68(4): 1499–1508. DOI: 10.1128/AEM.68.4.1499-1508.2002 |
| [25] | JAY J R, MACLAUGHLIN D T, RILEY K R, et al. Modulation of meningioma cell growth by sex steroid hormones in vitro[J]. Journal of Neurosurgery, 1985, 62(5): 757–762. DOI: 10.3171/jns.1985.62.5.0757 |
 2018,Vol. 14
2018,Vol. 14

