文章信息
- 曹世江, 蔡培菁, 汪凤林, 陈钢, 徐永兴, 曹光球
- CAO Shijiang, CAI Peijing, WANG Fenglin, CHEN Gang, XU Yongxing, CAO Guangqiu
- 宁化县紫色土区不同森林类型土壤酶活性差异分析
- Analysis of soil enzyme activity in different forest types from purple soil areas in Ninghua County
- 亚热带农业研究, 2017, 13(4): 217-222
- Subtropical Agriculture Research, 2017, 13(4): 217-222.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2017.04.001
-
文章历史
- 收稿日期: 2017-09-19
2. 国家林业局 杉木工程技术研究中心, 福建 福州 350002;
3. 福建农林大学林学院, 福建 福州 350002;
4. 福建省沙县水南国有林场, 福建 沙县 365050
2. State Forestry Administration Engineering Research Center of Chinese Fir, Fuzhou, Fujian 350002, China;
3. College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
4. Shaxian Country Shuinan State-owned Forest Farm, Shaxian, Fujian 365050, China
紫色土是热带、亚热带地区紫色砂页岩风化发育形成的岩性土,其蒸发量大,水、热不均,导致矿质养分多、有效养分少。由于紫色土区存在土层浅薄、结构性差和保水保土保肥能力差等弊端,导致林木生长不良;加之大量森林植被遭严重破坏,母质层裸露,疏松腐殖质层易被侵蚀,导致水土流失严重,引起土地生产力下降,在一定程度上制约了当地农村的经济发展[1]。因此,紫色土区土壤改良及森林植被的恢复与重建成为林业工作者主要的研究热点。
土壤酶可以促进土壤生态系统中物质和能量的转化和转移,在森林生态系统中发挥重要作用[2-4]。土壤水解酶(包括蔗糖酶、脲酶、酸性磷酸酶)和氧化酶(包括多酚氧化酶和过氧化氢酶)参与土壤有机物质的分解和腐殖化过程[5],对土壤含N、含P等化合物的活化转移与提高土壤肥力方面起重要作用[6]。由于土壤酶专一性强、灵敏度高,且与土壤理化性质、森林植被类型和气候条件等诸多环境因子关系紧密,森林环境监测中常使用土壤酶活性这一指标[7-11]。因此,本研究以宁化县紫色土区油茶人工林、马尾松人工林、杉木人工林及阔叶林等4种不同森林类型为研究对象,通过分析不同森林类型2种土层(0~10、10~20 cm)4种土壤酶活性变化及与土壤理化性质的相关性,以期揭示土壤酶对不同森林类型的响应机制,为紫色土改良及紫色土区退化生态系统的恢复与重建提供参考。
1 研究区基本概况本研究区位于福建省三明市宁化县淮土镇(116°20′~117°02′E,25°28′~26°40′N),属丘陵山区地带,海拔300~400 m。该区光照足、雨量大;年平均气温17.5 ℃,最低气温-8.3 ℃;年日照时数1 900 h,相对湿度81%,年平均降雨量1 633.9 mm,年平均陆面蒸发量710~750 mm,无霜期214~218 d。土壤以紫色页岩土为主。
2 研究方法 2.1 样地选择及取样2016年7月在宁化县淮土镇,根据立地条件尽量一致的原则,选择油茶、马尾松、杉木3种成熟人工林及阔叶林共4种森林类型。每种森林类型选取3块20 m×20 m样地。样地及林分生长情况见本课题组已发表的文献[12]~[13]。
样地按照“S”型采样5个点,清除表层枯枝落叶并挖土壤剖面后,用环刀取0~10、10~20 cm土层深度土壤样品。5份土壤等量均匀混合,过2 mm筛后保存于4 ℃冰箱。
2.2 测定方法土壤酶活性测定参照文献[14]~[15]。酶活性以每克土每天生成酶解产物毫克数表示。
2.3 数据处理主要采用Origin 8.5和SPSS 16.0进行试验数据的统计和分析。对不同森林类型土壤酶活性差异比较进行单因素方差分析。同一森林类型不同土层各种土壤酶活性差异进行单样品T检验,显著水平为P < 0.05,用LSD多重检验法检验不同森林类型间的差异显著性,采用Peraron软件对酶活性与土壤理化性质进行相关分析。
3 结果与分析 3.1 不同森林类型土壤蔗糖酶活性差异4种林分中土壤蔗糖酶活性均随土层加深而降低且差异显著,其值范围为2.46~16.90 mg·g-1·d-1(图 1)。(1) 在0~10 cm土层中,土壤蔗糖酶活性依次为:马尾松林>阔叶林>油茶林>杉木林。马尾松林蔗糖酶活性为16.90 mg·g-1·d-1,与其他3种森林类型林分皆存在显著差异。杉木林蔗糖酶活性为4.21 mg·g-1·d-1,且与其他3种森林类型林分均表现显著差异。(2) 在10~20 cm土层中,土壤蔗糖酶活性依次为:马尾松林>阔叶林>油茶林>杉木林。马尾松林蔗糖酶活性仍最高, 为11.14 mg·g-1·d-1,与油茶林和杉木林存在显著差异,而与阔叶林无显著差异。杉木林蔗糖酶活性仍最低, 为2.46 mg·g-1·d-1,与马尾松和阔叶林存在显著差异,而与油茶林无显著差异。
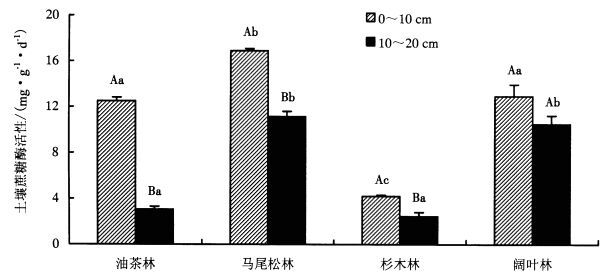
|
图 1 不同森林类型土壤蔗糖酶活性变化 Figure 1 Variable soil invertase activity in different forest types 不同大写字母表示同一森林类型不同土层各指标差异显著(P < 0.05);不同小写字母表示同一土层不同森林类型各指标差异显著(P < 0.05)。 |
除了阔叶林,油茶林、马尾松林和杉木林土壤脲酶活性均随土层加深而减小且差异显著,其值范围为1.67~20.11 mg·g-1·d-1(图 2)。(1) 在0~10 cm土层中,土壤脲酶活性依次为:油茶林>马尾松林>阔叶林>杉木林。油茶林脲酶活性为20.11 mg·g-1·d-1,与其他3种森林类型林分皆存在显著差异。阔叶林脲酶活性为6.46 mg·g-1·d-1,与油茶林和杉木林表现为显著差异,与马尾松林无显著差异。(2) 在10~20 cm土层中,土壤脲酶活性依次为:油茶林>阔叶林>马尾松林>杉木林。杉木脲酶活性1.67 mg·g-1·d-1最低,与油茶林、马尾松林和阔叶林均存在显著差异。
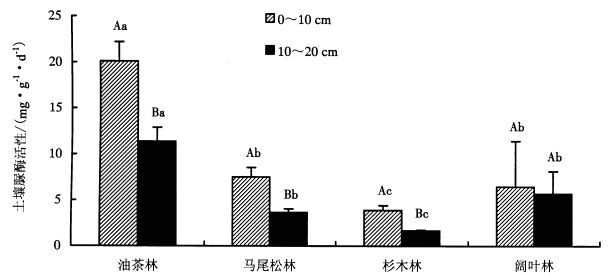
|
图 2 不同森林类型土壤脲酶活性变化 Figure 2 Variable soil urease activity in different forest types 不同大写字母表示同一森林类型不同土层各指标差异显著(P < 0.05);不同小写字母表示同一土层不同森林类型各指标差异显著(P < 0.05)。 |
4种林分中土壤酸性磷酸酶活性均随土层加深而降低且差异显著,其值范围为0.16~0.92 mg·g-1·d-1(图 3)。(1) 在0~10 cm土层中,土壤脲酶活性依次为:油茶林>马尾松林>杉木林>阔叶林。阔叶林土壤酸性磷酸酶活性(0.29 mg·g-1·d-1)最低,与其他3种林分皆存在显著差异。马尾松林和杉木林酸性磷酸酶活性间无显著差异,但均与油茶林存在显著差异。(2) 在10~20 cm土层中,土壤脲酶活性依次为:油茶林>马尾松林>阔叶林>杉木林。油茶林土壤酸性磷酸酶活性(0.35 mg·g-1·d-1)最高,与马尾松林、杉木林和阔叶林均存在显著差异。杉木林和阔叶林土壤酸性磷酸酶活性差异不显著,但均与油茶林和马尾松林存在显著差异。

|
图 3 不同森林类型土壤酸性磷酸酶活性变化 Figure 3 Variable soil acid phosphatase activity in different forest types 不同大写字母表示同一森林类型不同土层各指标差异显著(P < 0.05);不同小写字母表示同一土层不同森林类型各指标差异显著(P < 0.05)。 |
如图 4所示,过氧化氢酶活性在油茶林、马尾松林、杉木林和阔叶林中均随土层加深而降低且差异显著,其值范围为0.41~1.01 mg·g-1·d-1。(1) 在0~10 cm土层中,土壤过氧化氢酶活性范围为0.79~1.01 mg·g-1·d-1,阔叶林与马尾松林差异显著,其他林分间无显著差异。(2) 在10~20 cm土层中,过氧化氢酶活性范围为0.41~0.63 mg·g-1·d-1,马尾松林和杉木林差异显著,其他林分间无显著差异。
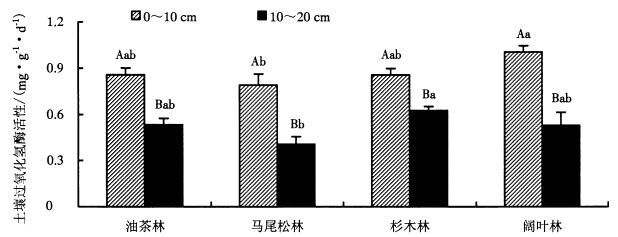
|
图 4 不同森林类型土壤过氧化氢酶活性变化 Figure 4 Variable soil catalase activity in different forest types 不同大写字母表示同一森林类型不同土层各指标差异显著(P < 0.05);小写字母完全不同表示同一土层不同森林类型各指标差异显著(P < 0.05)。 |
土壤理化性质是土壤酶活性重要的影响因子,而土壤酶通过参与土壤生物化学反应影响土壤的理化性质。由表 1可见,土壤蔗糖酶与全C、全N、有效P、全P含量及C/N呈极显著正相关,与含水量呈极显著负相关,与土壤容重、总孔隙度和速效K含量相关性不显著。脲酶与全C、全N含量呈极显著正相关,与有效P含量呈显著正相关,与速效K含量呈极显著负相关。过氧化氢酶与总孔隙度和有效P含量呈极显著正相关,与土壤容重呈极显著负相关。酸性磷酸酶与全C、全N和有效P含量呈极显著正相关,与土壤容重和速效K含量呈极显著负相关。
| 土壤酶 | 土壤容重 | 总孔隙度 | 全C含量 | 全N含量 | C/N | 有效P含量 | 全P含量 | 速效K含量 | 含水量 |
| 蔗糖酶 | -0.342 | 0.232 | 0.532** | 0.691** | 0.661** | 0.791** | 0.681** | 0.291 | -0.681** |
| 脲酶 | -0.552** | 0.371 | 0.581** | 0.762** | 0.312 | 0.512* | 0.052 | -0.591** | 0.053 |
| 过氧化氢酶 | -0.572** | 0.606** | 0.143 | 0.273 | 0 | 0.553** | 0.111 | 0.271 | 0.122 |
| 酸性磷酸酶 | -0.582** | 0.321 | 0.572** | 0.664** | 0.291 | 0.652** | 0.191 | -0.552** | 0.142 |
| 1)*、**分别表示达0.05、0.01显著相关。 | |||||||||
4种土壤酶活性间相关性见表 2。蔗糖酶与其他3种酶相关性不显著;酸性磷酸酶与脲酶呈极显著正相关,相关系数为0.752;酸性磷酸酶与过氧化氢酶呈显著正相关,相关系数为0.431;脲酶与过氧化氢酶相关性不显著。
| 土壤酶 | 蔗糖酶 | 脲酶 | 过氧化氢酶 | 酸性磷酸酶 |
| 蔗糖酶 | 1.000 | 0.232 | 0.271 | 0.291 |
| 脲酶 | 0.231 | 1.000 | 0.262 | 0.751** |
| 过氧化氢酶 | 0.272 | 0.261 | 1.000 | 0.432* |
| 酸性磷酸酶 | 0.291 | 0.752** | 0.431* | 1.000 |
| 1)*、**分别表示达0.05、0.01显著相关。 | ||||
土壤酶是森林生态系统的重要组成部分之一,主要产生于植物和土壤微生物的分泌物,通过调节土壤生物化学过程,参与了土壤中有机物质分解、营养物质循环、能量流动等。土壤酶活性可以反映土壤中各种生物化学过程的强度和方向,可以作为土壤质量和生态系统功能变化的生物活性指标[16]。同时,由于土壤酶促反应灵敏、测定简单且专一性强,常将其视为极具潜力的土壤质量变化指示剂[17]。
土壤各种酶促之间的反应既是单独的也是统一的,地上植被的变化对土壤环境造成改变的同时也会影响土壤中酶促的变化[18]。当土壤质地由壤土变成粉砂壤土,水解酶类活性会降低,而氧化还原酶类活性会缓缓加强[19]。王成秋等[20]研究表明,土壤脲酶和转化酶活性会随着土层的加深而降低,这与本研究结果一致。王旭熙等[21]研究表明,在生姜栽种后的4种种植类型土壤中,酸性磷酸酶、转化酶活性显著降低。马志勤等[22]研究表明,大木落叶最有助于提高紫色土区土壤酶活性,物料深施能够进一步提高土壤酶活性。
本研究表明,与其他3种林分相比,油茶人工林中脲酶和酸性磷酸酶活性均为最高,蔗糖酶和过氧化氢酶活性表现中等,马尾松林蔗糖酶活性最高,而杉木林中蔗糖酶、脲酶、酸性磷酸酶活性基本处于最低水平;影响4种土壤酶活性最关键的理化因子为土壤容重、全C、全N和有效P。因此,对于紫色土的改良及紫色土区森林生态系统的恢复与重建,应优先考虑油茶和马尾松,另外要加强保护森林生态系统乔木层植物及林下植被,从而达到土壤改良的目的。
| [1] | 杜威宁. 武夷山紫色土的理化特征分析[J]. 防护林科技, 2015(5): 58–60. |
| [2] | 林娜, 刘勇, 李国雷, 等. 森林土壤酶研究进展[J]. 世界林业研究, 2010, 23(4): 21–25. |
| [3] | 周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987: 32-54. |
| [4] | ZHANG Y M, ZHOU G Y, NING W U, et al. Soil enzyme activity changes in different-aged spruce forests of the eastern Qinghai-Tibetan plateau[J]. Pedosphere, 2004, 14(3): 305–312. |
| [5] | 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010: 243-262. |
| [6] | 蒋智林, 刘万学, 万方浩, 等. 紫茎泽兰与非洲狗尾草单、混种群落土壤酶活性和土壤养分的比较[J]. 植物生态学报, 2008, 32(4): 900–907. |
| [7] | 陶宝先, 张金池, 俞元春, 等. 苏南丘陵地区森林土壤酶活性季节变化[J]. 生态环境学报, 2010, 19(10): 2349–2354. DOI: 10.3969/j.issn.1674-5906.2010.10.015 |
| [8] | ALKORTA I, AIZPURUA A, RIGA P, et al. Soil enzyme activities as biological indicators of soil health[J]. Reviews on Environmental Health, 2003, 18(1): 65–73. |
| [9] | 万忠梅, 宋长春, 郭跃东, 等. 毛苔草湿地土壤酶活性及活性有机碳组分对水分梯度的响应[J]. 生态学报, 2008, 28(12): 5980–5986. DOI: 10.3321/j.issn:1000-0933.2008.12.025 |
| [10] | PUGLISI E, DEL R, RAO M. Development and validation of numerical indexes integrating enzymes activities of soils[J]. Soil Biology and Biochemisty, 2006, 38(7): 1673–1681. DOI: 10.1016/j.soilbio.2005.11.021 |
| [11] | 赵汝东, 樊剑波, 何园球, 等. 坡位对马尾松林下土壤理化性质、酶活性及微生物特性影响[J]. 生态环境学报, 2010, 19(12): 2857–2862. DOI: 10.3969/j.issn.1674-5906.2010.12.015 |
| [12] | 蔡培菁, 曹世江, 陈爱玲, 等. 宁化县紫色土区不同森林类型土壤理化性质差异[J]. 亚热带农业研究, 2017, 13(2): 99–104. |
| [13] | 黄春梅. 紫色土区不同林龄油茶人工林土壤理化性质差异分析[J]. 安徽农业科学, 2017, 45(13): 157–159. DOI: 10.3969/j.issn.0517-6611.2017.13.049 |
| [14] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. |
| [15] | KANDELER E, GERBER H. Short-term assay of soil urease activity using colorimetric determination of ammonium[J]. Biology and Fertility of Soils, 1988, 6(1): 68–72. |
| [16] | BANERJEE S, BORA S, THRALL P H, et al. Soil C and N as causal factors of spatial variation in extracellular enzyme activity across grassland-woodland ecotones[J]. Applied Soil Ecology, 2016, 105: 1–8. DOI: 10.1016/j.apsoil.2016.04.002 |
| [17] | 任天志. 持续农业中的土壤生物指标研究[J]. 中国农业科学, 2000, 33(1): 68–75. |
| [18] | 金裕华, 汪家社, 李黎光, 等. 武夷山不同海拔典型植被带土壤酶活性特征[J]. 生态学杂志, 2011, 30(9): 1955–1961. |
| [19] | 李集勤, 陈俊标, 彭文松, 等. 植烟沙泥田土掺混紫色土对土壤酶活性及理化性质的影响[J]. 中国土壤与肥料, 2014(5): 16–21, 31. |
| [20] | 王成秋, 王树良, 杨剑虹, 等. 紫色土柑桔园土壤酶活性及其影响因素研究[J]. 中国南方果树, 1999, 28(5): 7–10. |
| [21] | 王旭熙, 吴福忠, 杨万勤, 等. 栽植生姜对不同种植模式下紫色土微生物生物量及水解酶活性的影响[J]. 应用生态学报, 2012, 23(2): 433–438. |
| [22] | 马志勤, 张先婉. 有机物料对紫色土土壤酶活性的影响[J]. 土壤通报, 1992, 23(1): 25–27. |
 2017,Vol. 13
2017,Vol. 13


