文章信息
- 谭立山
- TAN Lishan
- 农业土壤N2O产生途径及其影响因素研究进展
- Advances in N2O generation pathway in agricultural soils and major influencing factors
- 亚热带农业研究, 2017, 13(3): 196-204
- Subtropical Agriculture Research, 2017, 13(3): 196-204.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2017.03.011
-
文章历史
- 收稿日期: 2017-04-11
氧化亚氮(N2O)是当今广受关注的温室气体之一,它与全球气候变暖、大气层破坏和大气酸沉降三大大气环境问题密切相关[1]。自工业革命以来,N2O在大气中的浓度增长了18%,其增温潜势为CO2的296倍[2],同时N2O在大气中的寿命为150 a左右,因此对气候变化及大气环境的影响是长期的[3]。目前,国内外学者对N2O产生、排放及影响因素进行了大量的研究,多集中于对各生态系统N2O排放量的估算,并建立了相应的估算模型[4]。生物圈释放到大气中的约90% N2O是由土壤微生物参与下的硝化和反硝化过程所致[5];近年来,土壤硝化微生物反硝化作用引起了关注,但由于研究方法的局限性,对其了解甚少[6]。本文综述了目前农业土壤N2O的产生机制、研究方法和产生途径的贡献量,以期为调控农业土壤N2O排放、N转化过程及其相关研究提供参考。
1 N2O产生的微生物学机制农田土壤N2O产生的主要途径包括:硝化作用、反硝化作用、硝化微生物反硝化作用和硝酸盐异化还原成铵作用。
硝化作用是指在硝化微生物的作用下将NH4+-N转化成NO2--N和NO3--N的过程,具体可分为自养硝化作用和异养硝化作用。前者是指由自养硝化微生物利用CO2作为唯一C源,将NH4+-N氧化成NO2--N和NO3--N的硝化过程[7];后者指由异养硝化微生物在好氧条件下,以有机C作为C源和能源,将还原态有机N氧化成NH2OH、NO2-和NO3-等产物的硝化过程[8]。在硝化微生物将NH4+-N氧化成NO2-过程中,细胞为了避免NO2-累积,在亚硝酸盐还原酶(Nir)的作用下以NO2-作为电子受体而产生N2O[9]。因此N2O和NO是硝化过程的副产物。
反硝化作用是指在兼气或者低氧环境下,在反硝化微生物作用下把NO2--N和NO3--N还原成NO、N2O和N2的过程(图 1)。N2O并不是反硝化作用的最终产物,它在氧化亚氮还原酶(Nos)作用下被还原成N2。因此,反硝化过程产生N2O有两种原因[9]:一是由于Nos受土壤理化性质的抑制,如O2浓度、pH等,无法将N2O还原成N2;二是由于反硝化微生物缺乏Nos而无法进一步还原。一般认为,反硝化作用只有在严格的厌氧环境下才会发生,但有研究表明在好氧环境也能进行反硝化作用并产生N2O[10-12]。
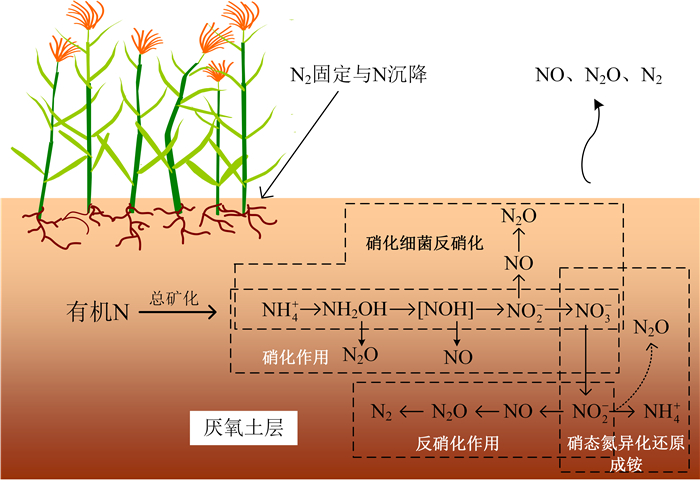
|
图 1 土壤硝化与反硝化作用过程 Figure 1 Soil nitrification and denitrification pathway |
硝化微生物反硝化作用是指硝化微生物先将NH4+(NH3)氧化成NO2-,最后将NO2-还原成NO、N2O和N2,这两个阶段分别属于硝化和反硝化过程(图 1)[13]。由于硝化微生物反硝化过程中仅由氨氧化微生物或古菌参与,并且没有NO3--N的生成而区别于硝化作用和反硝化作用。
硝酸盐异化还原成铵作用(DNRA)是指在微生物作用下将NO3--N还原成NO2--N,再进一步还原成NH4+-N的过程,此过程常伴有NO2-的短暂累积以及N2O生成。能发生该过程的微生物包括专性厌氧菌、兼性厌氧菌和好氧菌[14],因此DNRA受O2条件限制较小。已发现在有机质较高的草地和森林土壤中发生DNRA[15],并产生一定量的N2O,但是对农田土壤DNRA及其对N2O产生的贡献率研究仍鲜有报道。
综上所述,N2O是硝化与反硝化反应不完全的产物,是硝化与反硝化作用受抑制情况下的产物,也是土壤N素损失的潜在途径,并受生物和非生物因素的调控[16]。
2 N2O产生途径的研究方法 2.1 硝化与反硝化微生物的研究方法目前,用于研究土壤硝化与反硝化微生物群落功能、结构和丰度的主要分子技术为聚合酶链式反应(polymerase chain reaction, PCR)技术,主要包括:变性梯度凝胶电泳(denatured gradient gel electrophoresis, DGGE)、温度梯度凝胶电泳(temperature gradient gel electrophoresis, TGGE)、末端限制性片段长度多样性(terminal restriction fragment length polymorphism, T-RFLP)、定量PCR(real-time PCR)、随机扩增多态性DNA(random amplified polymorphic DNA, RAPD)和长度多态片段PCR(LH-PCR)等[17]。上述PCR技术因受成本、程序复杂程度和精度等影响,其使用范围和使用目的各有不同。其中,DGGE、TGGE、T-RFLP及定量PCR技术是现阶段农业土壤微生物硝化与反硝化作用研究中应用最为广泛的技术。此外,磷脂脂肪酸(phospholipid fatty acid, PLFA)分析法与Biolog技术亦是测定微生物群落结构与功能的常用手段[11, 18-21]。
2.2 硝化与反硝化作用的研究方法尽管众多文献报道了不同生态系统或土地利用方式的改变对N2O排放的影响,但对N2O产生途径进行区分的研究鲜见。农田土壤中硝化作用与反硝化作用往往同时发生,并伴随着硝化微生物反硝化作用,各发生途径对N2O产生的贡献率也不同。明确土壤各发生过程对N2O的贡献率对于温室气体的减排具有重要意义。目前,区分农业土壤硝化与反硝化作用的常用方法为同位素标记法和乙炔抑制法[22]。
2.2.1 硝化作用净硝化作用室内培养方法[23]包括:(1) 扰动土15N示踪法,在控制一定变量条件下,添加(15NH4)2SO4进行培养,通过对比培养前后15NO3--N与15NH4+-N变化量来测定;(2) 扰动土好气培养法,即在控制一定变量条件下加入(NH4)2SO4等进行好气培养,通过对比培养前后NO3--N变化量来测定。
2.2.2 反硝化作用(1)15N示踪法:一定环境条件下,在隔离小区或原状土内添加一定丰度和数量的15N标记物(K15NO3),通过测定15N气体来计算(15N示踪直接法)或在测定损失总量后扣除NH3挥发量来间接测定(15N平衡法)[22]。(2) 乙炔抑制培养法:乙炔体积分数为0.01%~0.1%时,能抑制自养反硝化作用;1%~10%时,能抑制反硝化过程中N2O还原过程[24]。但该方法不能很好抑制异养硝化微生物活性(表 1),可能导致反硝化作用贡献量被高估。
| 产生途径 | 无抑制剂(CK) | 0.06%乙炔 | 纯氧 | 纯氧加0.06%乙炔 | 纯氦 |
| 反硝化作用 | √ | √ | × | × | √ |
| 自养硝化作用 | √ | × | √ | × | × |
| 异养硝化作用 | √ | √ | √ | √ | × |
| 硝化微生物反硝化作用 | √ | × | × | × | × |
| 1)“√”.可发生,“×”.被抑制。 | |||||
近十年来,美国与德国的学者开始研究土壤硝化微生物反硝化作用对N2O产生的贡献,并在研究方法上做了探索性的工作[25-28],主要有两种:15N和18O双稳定同位素失踪技术与气体抑制剂抑制法。前者能更为准确判定N2O的来源,但由于该方法技术复杂、成本高,且不能完全阻隔被标记元素与土壤中或水中未标记元素的交换,未能被广泛采用[29];后者包括了纯氧和纯氦的气体抑制剂抑制法,能区分反硝化作用、自养反硝化作用、异养硝化作用及硝化微生物反硝化作用N2O排放的贡献(表 1)。气体抑制剂抑制法相对于15N和18O双标记法具有更好的经济性和操作性[30],但抑制的不完全性可能导致硝化微生物反硝化贡献量被低估。
根据以下公式计算不同反应途径下N2O产生量[31]:
| $ {{\rm{N}}_{\rm{2}}}{{\rm{O}}_{{\rm{反硝化}}}}{\rm{ = 纯氦}} $ | (1) |
| $ {{\rm{N}}_{\rm{2}}}{{\rm{O}}_{{\rm{自养硝化}}}}{\rm{ = 纯氧 - 纯氧加0}}{\rm{.06\% 乙炔}} $ | (2) |
| $ {{\rm{N}}_{\rm{2}}}{{\rm{O}}_{{\rm{异养硝化}}}}{\rm{ = 纯氧加0}}{\rm{.06\% 乙炔}} $ | (3) |
| $ {{\rm{N}}_{\rm{2}}}{{\rm{O}}_{{\rm{硝化微生物反硝化}}}}{\rm{ = 无抑制剂 - 纯氧 - 0}}{\rm{.06\% 乙炔 + 纯氧加0}}{\rm{.06\% 乙炔}} $ | (4) |
有关农田土壤N2O主要产生途径的文献见表 2。当前研究多以土壤含水率、土壤pH和施肥处理作为控制变量,其中土壤含水率及土壤pH值经常被认为是影响土壤N2O产生途径的主要因素,但是二者影响N2O产生途径的临界值尚不清楚。
| 产生途径 | 土壤类型 | 含水率/% | pH值 | 贡献率/% | 参考文献 |
| 硝化作用 | 耕作土壤(稻田) | 50(WHC) | 6.21 | 0.3(自养), 54.4(异养) | [28] |
| 耕作土壤(菜地) | 25.6(WHC) | 8.20 | 40(自养) | [29] | |
| 耕作土壤 | 70(WHC) | 6.11 | 19(自养), 38(异养) | [31] | |
| 耕作土壤 | 75;150(FC) | 7.10 | 60;10~15 | [32] | |
| 茶园土壤 | 40;60(WHC) | 5.30 | 75.9(自养)、14.7(异样); 66.7(自养)、21.8(异养) | [33] | |
| 暗色土 | 60;80;100(WHC) | 5.65 | 59.4(自养); 57.2(自养); 1.5(自养) | [34] | |
| 森林土壤 | 37.5~56.9(WHC) | 4.8~6.6 | 37~76(异养) | [35] | |
| 森林土壤; 草地土壤 | 60(WHC) | 5.16;6.27 | 53.1;72 | [36] | |
| 草地土壤 | 50~80(WHC) | 5.6~8.0 | >70 | [25] | |
| 草地土壤 | 18.5(WHC) | 6.45 | 65.7(异养) | [37] | |
| 泥炭土(农用) | 60;80;100 | 5.80 | 76;42.2;21.7(异养) | [38] | |
| 反硝化作用 | 耕作土壤(稻田; 菜地) | 50(WHC) | 6.21;5.44 | 45.3;40.8 | [28] |
| 耕作土壤(菜地) | 70(WHC) | 6.11 | 28 | [31] | |
| 耕作土壤 | 25.6(WHC) | 8.20 | 30 | [29] | |
| 耕作土壤 | 45;65;100(FC) | 7.87 | 15.23;28.22;51.5 | [39] | |
| 耕作土壤 | 80(WHC) | 7.20;6.00 | 80.3;65.5 | [6] | |
| 茶园土壤 | 40;60(WHC) | 5.30 | 9.4;11.5 | [33] | |
| 暗色土(农用) | 60;80;100(WHC) | 5.65 | 40.6;42.8;98.5 | [34] | |
| 草地土壤 | 18.5(WHC) | 6.45 | 34 | [37] | |
| 砂壤 | 50;70;90 | 5.40 | 20;16;92.1 | [40] | |
| 硝化微生物反硝化作用 | 耕作土壤 | 70(WHC) | 6.11 | 15 | [28] |
| 耕作土壤(菜地) | 25.6(WHC) | 8.20 | 20 | [29] | |
| 耕作土壤; 草地土壤 | 80(WHC) | 7.20;6.00 | 3.0~19.7;16.6~34.1 | [6] | |
| 砂壤 | 50;70;90(WHC) | 5.40 | 36.7~56.9;24.2~49.9;3.9~7.9 | [40] | |
| 1)WHC.土壤持水量(water holding capacity);FC.田间持水量(field capacity)。 | |||||
土壤基质主要通过土壤有机质和C/N影响硝化与反硝化作用。一方面,土壤有机碳(SOC)的分解为硝化与反硝化微生物提供能量,其中参与反硝化活动的微生物细胞合成需要充足的土壤溶解性有机C(DOC)[41];另一方面,SOC化合物的矿化作用所产生的NH4+-N和NO3--N为硝化和反硝化作用提供电子受体。有机质含量对硝化和反硝化的速率有着直接或间接影响。如果有机质过高,会导致异养硝化菌迅速繁衍,消耗土壤中的O2,从而抑制好氧的自养型硝化菌活性和代谢能力,降低了硝化速率,导致反硝化作用增强[42]。续勇波等[43]研究表明,土壤反硝化过程中产生的N2O排放量随SOC含量增加而提高。娄焕杰等[44]对上海河岸带土壤反硝化速率研究表明,反硝化速率与DOC和SOC含量呈正相关关系。Weier et al[45]研究表明,土壤中添加葡萄糖后,反硝化速率提高了10~20倍。
C/N是影响微生物分解有机质的主要因子。一般土壤微生物的最适C/N为25~30, 若C/N高于该值, 会导致有机质分解缓慢而形成N固定,进而抑制硝化作用的进行[46];若C/N过低,易分解的有机质在分解过程中产生的各种有机酸会使土壤pH下降, 而增大土壤对NO3--N和NH4+-N的吸附能力, 进而减弱硝化作用[47]。一般认为,土壤N2O排放与C/N呈负相关关系[48]。柯韵等[49]研究发现,紫色土坡耕地退耕还林后土壤C/N比提高,导致土壤N2O排放总量显著减少。
3.2 土壤物理性质 3.2.1 土壤含水率土壤含水率通过土壤通气性、底物有效性和微生物活性影响硝化与反硝化作用[16, 50]。在土壤充水孔隙度(water filled pore space, WFPS)60%以下时,土壤溶解性氧随水分增加而增加,促进了土壤硝化作用,N2O产生途径以硝化作用为主[31];当含水率达到一定临界值时,一般为70%~80%[25],N2O排放量最大,此时硝化与反硝化作用均为N2O产生的重要途径;含水率过饱和时,土壤空隙被水分填满而形成厌氧条件,硝化作用受抑制而反硝化微生物的Nos活性加强,将N2O彻底还原成N2,导致N2O排放量减少[51]。农田土壤N2O排放量与土壤含水量之间存在正相关关系[52]。当>60% WFPS的厌氧条件下,反硝化作用为产生土壤N2O的主要途径[53]。虽然土壤反硝化作用主要发生在厌氧土层,但是好氧条件下的反硝化作用不容忽视,李平等[36]对温带草地与林地土壤N2O的产生途径研究发现,反硝化作用对N2O产生贡献率达28.0%~46.9%,表明好气条件下反硝化作用仍是土壤N2O产生的重要过程。
3.2.2 温度温度通过影响微生物活性和植物生长,从而直接或间接影响湿地土壤N素转移,生态系统内生物对日昼变化和对季节变化的响应模式,主要是由于生物对温度响应所造成。一般来说,在微生物适应的温度范围内,土壤微生物活性与温度呈正相关[54]。硝化作用最适温度为25~35 ℃, <5 ℃和>50 ℃则受到抑制[55],温度升高可增加液相中的NO3--N比例, 且NO3--N和NH4+-N扩散速率以及硝化作用也随之增加。而反硝化作用的适应温度范围较广,最适温度为30~67 ℃[44]。Ryden et al[56]研究表明, 在相同的土壤含水量和NO3--N浓度条件下, 土壤温度从5 ℃提高到10 ℃,土壤反硝化速率从0.02 kg·hm-2·d-1提高到0.11 kg·hm-2·d-1。李平等[36]研究发现,当培养温度从10 ℃提高至15 ℃时,林地土壤与草地土壤N2O排放速率均有显著提高。
3.2.3 土壤质地土壤质地是指土壤不同粒径矿物质组合结构状况,决定了土壤整体的通透性能,是影响土壤水分含量以及含氧量的主要因素。一般粗质地土壤相对细质地土壤的NH4+-N扩散速率大, 砂土、砂壤土和壤土的NH3挥发分别为粘土的5.2、4.6和3.4倍[57]。较粗的土壤粒径有利于上覆水NO3--N向土壤扩散,产生较高的反硝化速率[58];而粘粒的吸附能力较强,因此有利于有机物的保留和防止矿化,从而导致硝化和反硝化微生物不能获得足够的电子受体和能量。徐华等[59]研究表明,砂壤土的N2O排放通量显著和极显著高于壤土和粘土,而壤土则高于粘土。人类农业活动对土壤的N素转移也有影响,农业活动使得土壤均质化,改变了土壤通气性以及土壤中硝化与反硝化微生物的数量[60]。Merino et al[61]研究表明,相对于森林,农田和牧草地的N2O排放量分别为3倍和6倍。
3.3 土壤化学性质 3.3.1 土壤pH值微生物活性对所在环境的pH具有高度敏感性,农业上长期施肥会对土壤的pH值产生影响。一般认为,最适宜反硝化的pH值为7.0~8.0;硝化作用最适宜的pH值为8.5, 若pH值>9.5, 硝化微生物则受到抑制,而pH值<6.0时,反硝化速率显著降低[46, 62]。在一定范围内,N2O生成量与pH呈负相关,随着pH降低,其活性受到抑制而无法进一步将N2O还原成N2,导致N2O累积增多,在碱性条件下,几乎不产生N2O[63]。但也有研究表明N2O与土壤pH呈正相关关系。Byrnes[64]研究表明,当土壤pH值从4.7升至6.5时,硝化速率提升了3~5倍。杨云等[65]研究表明,当农业土壤pH值在5.6~8.0内,N2O排放量与pH呈正相关。在缺氧、土壤C含量较低且pH较低的土壤环境下,自养硝化菌脱N作用处于主导地位,对N2O产生的贡献率要大于异养硝化菌[66],主要发生在草地土壤[7, 36]、旱地土壤[31]、稻田土壤[28]等农业生态系统中。
3.3.2 溶解氧硝化作用是好气反应, 反硝化作用是厌气反应。一般来说,硝化作用会消耗土壤间隙水中的溶解氧(DO),为反硝化提供了必要的条件。通常适于硝化作用的DO应高于2 mg·L-1,此时N2O产生速率最大[67],否则DO将成为限制因素,0.2 mg·L-1是硝化发生的最低DO要求;而反硝化作用的DO上限为0.5 mg·L-1,高于该值反硝化作用将受到严重抑制[68]。Zhu et al[28]研究表明,水稻田土壤氧气浓度在0、0.5%、3%和21%下,反硝化作用对N2O排放贡献率分别为100%、43.9%、34.1%和27.3%。当硝化与反硝化作用受到O2限制时,才能促进其生成N2O[23]。
3.4 施加N肥为了提高产量而施肥,这是农田土壤与自然土壤最大区别之一。N肥的施加(特别是化学N肥)能显著提高土壤中NH4+-N和NO3--N的含量,为土壤硝化、反硝化和硝化微生物反硝化作用提供充足的底物。如果施加N肥的量超过了作物所需量,会对土壤的一些理化性质产生影响。添加作物残茬和畜禽粪便等有机肥,能提高土壤中无机N和有机C含量,而增加农田土壤N2O排放。阎宏亮等[29]研究表明,短期对菜地施加NH4+-N肥会促进N2O释放通量,其中自养反硝化作用占主导。有研究表明,在草地施加NH4+-N肥使得N2O通量提高了1.52~1.88倍[37]。Cheng et al[33]研究表明,长期施加NH4NO3能促进N2O和NO的排放,其中自养硝化作用在N2O产生中占主导。而Xu et al[35]对酸性森林土壤施加NH4+-N与NO3--N肥得出类似的结论,并发现施加NH4+-N肥的N2O排放量大于施加NO3--N肥。有研究表明,施加尿素能促进土壤的异养硝化作用,使其成为土壤N2O的主要来源[31, 69]。熊舞等[70]对比尿素及含硝化抑制剂尿素对土壤N2O排放的影响,发现不管是否添加硝化抑制剂,N2O排放量均与施N量呈指数函数关系,硝化抑制剂减排效果随施N量增加而增加。
4 问题与展望(1) 硝化过程以及硝化微生物反硝化生成N2O的机理和路径还存在争议。但随着微生物测定技术发展,将会发现更多能产生N2O的新微生物种类,因此必须加强相关微生物N2O产生机制和生理生化条件的研究。并将微生物技术与N2O产生途径相结合,明晰土壤N2O产生途径,对于精确估算农业生态系统对气候的增温潜势有重要意义。
(2) 减排是在不影响农业生产力的前提下尽可能减少温室气体的排放。有关施用添加硝化抑制剂的化肥以及不同施肥模式和耕作模式对减排的研究仍鲜有报道,加强相关研究有利于为农田生态系统N2O减排提供理论依据。
(3) 影响土壤N2O产生的环境因素众多,它们共同耦合作用于土壤微生物活性,人为单因素调控并不能真实反映土壤微生物对环境因素的响应。应建立起更具有实际和理论意义的硝化—反硝化作用或农业N2O产生的概念模型以及环境效应模型。
| [1] | 戴树桂. 环境化学[M]. 北京: 高等教育出版社, 2002: 73-74. |
| [2] | IP CC. Climate Change 2013:the Physical Science Basis. Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. Cambridge, United Kingdom, New York, USA: Cambridge University Press, 2013. |
| [3] | PRINN R, CUNNOLD D, RASMUSSEN R, et al. Atmospheric emissions and trends of nitrous oxide deduced from 10 years of ALE-GAGE data[J]. Journal of Geophysical Research, 1990, 95(D11): 18369–18386. DOI: 10.1029/JD095iD11p18369 |
| [4] | 李英臣, 宋长春, 刘德燕. 湿地土壤N2O排放研究进展[J]. 湿地科学, 2008, 6(2): 124–129. |
| [5] | BOUWMAN A F. Exchange of greenhouse gases between terrestrial ecosystems and the atmosphere[C]//BOUWMAN A F. Soils and the Greenhouse Effect. New York:John Wiley & Sons, 1990:61-127. |
| [6] | KOOL D M, WRAGE S, ZECHMEISTER-BOLTENSTERN S, et al. Nitrifier denitrification can be a source of N2O from soil:a revised approach to the dual-isotope labelling method[J]. European Journal of Soil Science, 2010, 61(5): 759–772. DOI: 10.1111/j.1365-2389.2010.01270.x |
| [7] | PROSSER J I. Autotrophic nitrification in bacteria[J]. Advances in Microbial Physiology, 1990, 30: 125–181. DOI: 10.1016/S0065-2911(08)60112-5 |
| [8] | 孙志强, 郝庆菊, 江长胜, 等. 农田土壤N2O的产生机制及其影响因素研究进展[J]. 土壤通报, 2010, 41(6): 1524–1530. |
| [9] | 刘秀红, 杨庆, 吴昌永. 不同污水生物脱氮工艺中N2O释放量及影响因素[J]. 环境科学学报, 2006, 26(12): 1940–1947. DOI: 10.3321/j.issn:0253-2468.2006.12.002 |
| [10] | ZHOU Z M, TAKAYA N, SAKAIRI M A C, et al. Oxygen requirement for denitrification by the fungus Fusarium oxysporum[J]. Archives of Microbiology, 2001, 175(1): 19–25. DOI: 10.1007/s002030000231 |
| [11] | OKADA N, NOMURA N, NAKAJIMA-KAMBE T, et al. Characterization of the aerobic denitrification in mesorhizobium sp. strain NH-14 in comparison with that in related rhizobia[J]. Microbes and Environments, 2005, 20(4): 208–215. DOI: 10.1264/jsme2.20.208 |
| [12] | ZHU T B, ZHANG J B, CAI Z C. The contribution of nitrogen transformation processes to total N2O emissions from soils used for intensive vegetable cultivation[J]. Plant and Soil, 2011, 343(1-2): 313–327. DOI: 10.1007/s11104-011-0720-3 |
| [13] | 蔡延江, 丁维新, 项剑. 土壤N2O和NO产生机制研究进展[J]. 土壤, 2012, 44(5): 712–718. |
| [14] | YIN S X, CHEN D, CHEN L M, et al. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology and Biochemistry, 2002, 34(8): 1131–1137. DOI: 10.1016/S0038-0717(02)00049-4 |
| [15] | RÜTTING T, HUYGENS D, MVLLER C, et al. Functional role of DNRA and nitrite reduction in a pristine south Chilean Nothofagus forest[J]. Biogeochemistry, 2008, 90(3): 243–258. DOI: 10.1007/s10533-008-9250-3 |
| [16] | 刘义, 陈劲松, 刘庆, 等. 土壤硝化和反硝化作用及影响因素研究进展[J]. 四川林业科技, 2006, 27(2): 36–41. |
| [17] | 刘银银, 李峰, 孙庆业, 等. 湿地生态系统土壤微生物研究进展[J]. 应用与环境生物学报, 2013, 19(3): 547–552. |
| [18] | GARLAND J L, MILLS A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351–2359. |
| [19] | 樊芳玲, 谢德体, 魏朝富, 等. 坡耕地-桑树系统土壤微生物群落结构的PLFA分析[J]. 生态学报, 2016, 36(12): 3812–3823. |
| [20] | 郭丽芸, 时飞, 杨柳燕. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 2011, 38(4): 583–590. |
| [21] | 李大明, 成艳红, 刘满强, 等. 双季稻田甲烷排放与土壤产甲烷菌群落结构和数量关系研究[J]. 农业环境科学学报, 2013, 32(4): 866–873. |
| [22] | WRAGE N, VELTHOF G L, LAANBROEK H J, et al. Nitrous oxide production in grassland soils:assessing the contribution of nitrifier denitrification[J]. Soil Biology & Biochemistry, 2004, 36(2): 229–236. |
| [23] | 孙志高, 刘景双. 湿地土壤的硝化-反硝化作用及影响因素[J]. 土壤通报, 2008, 39(6): 1462–1467. |
| [24] | DAVIDSON E A, SWANK W T, PERRY T O. Distinguishing between nitrification and denitrification as sources of gaseous nitrogen production in soil[J]. Applied and Environmental Microbiology, 1986, 52(6): 1280–1286. |
| [25] | STEVENS R J, LAUGHLIN R J, MALONE J P. Soil pH affects the processes reducing nitrate to nitrous oxide and di-nitrogen[J]. Soil Biology and Biochemistry, 1998, 30(8-9): 1119–1126. DOI: 10.1016/S0038-0717(97)00227-7 |
| [26] | WRAGE N, VAN GROENIGEN J W, OENEMA O, et al. A novel dual-isotope labelling method for distinguishing between soil sources of N2O[J]. Rapid Communications in Mass Spectrometry, 2005, 19(22): 3298–3306. DOI: 10.1002/(ISSN)1097-0231 |
| [27] | KOOL D M, WRAGE N, OENEMA O, et al. The 18O signature of biogenic nitrous oxide is determined by O exchange with water[J]. Rapid Communications in Mass Spectrometry, 2009, 23(1): 104–108. DOI: 10.1002/rcm.v23:1 |
| [28] | ZHU X, BURGER M, DOANE T A, et al. Ammonia oxidation pathways and nitrifier denitrification are significant sources of N2O and NO under low oxygen availability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6328–6333. DOI: 10.1073/pnas.1219993110 |
| [29] | 阎宏亮, 张璇, 谢立勇, 等. 菜地土壤施用铵态氮肥后N2O排放来源及其动态[J]. 中国农业气象, 2014, 35(2): 141–148. |
| [30] | BAGGS E M. A review of stable isotope techniques for N2O source partitioning in soils:recent progress, remaining challenges and future considerations[J]. Rapid Communications in Mass Spectrometry, 2008, 22(11): 1664–1672. DOI: 10.1002/(ISSN)1097-0231 |
| [31] | CAI Y J, DING W X, ZHANG X L, et al. Contribution of heterotrophic nitrification to nitrous oxide production in a long-term N-fertilized arable black soil[J]. Communications in Soil Science and Plant Analysis, 2010, 41(9): 2264–2278. |
| [32] | MATHIEU O, HENAULT C, LEVEQUE J, et al. Quantifying the contribution of nitrification and denitrification to the nitrous oxide flux using 15N tracers[J]. Environmental Pollution, 2006, 144(3): 933–940. DOI: 10.1016/j.envpol.2006.02.005 |
| [33] | CHENG Y, WANG J, ZHANG J B, et al. Mechanistic insights into the effects of N fertilizer application on N2O-emission pathways in acidic soil of a tea plantation[J]. Plant and Soil, 2015, 389(1-2): 45–57. DOI: 10.1007/s11104-014-2343-y |
| [34] | INUBUSHI K, NAGANUMA H, KITAHARA S. Contribution of denitrification and autotrophic and heterotrophic nitrification to nitrous oxide production in andosols[J]. Biology and Fertility of Soils, 1996, 23(3): 292–298. DOI: 10.1007/BF00335957 |
| [35] | XU X K, INUBUSHI K. Mineralization of nitrogen and N2O production potentials in acid forest soils under controlled aerobic conditions[J]. Soil Science and Plant Nutrition, 2005, 51(5): 683–688. DOI: 10.1111/j.1747-0765.2005.tb00091.x |
| [36] | 李平, 郎漫. 硝化和反硝化过程对林地和草地土壤N2O排放的贡献[J]. 中国农业科学, 2013, 46(22): 4726–4732. DOI: 10.3864/j.issn.0578-1752.2013.22.010 |
| [37] | 白龙, 王跃羲, 刘英, 等. 草坪土壤的N2O产生途径及其对施氮肥的响应[J]. 园艺学报, 2016, 43(10): 1971–1979. |
| [38] | PIHLATIE M, SYVÄSALO E, SIMOJOKI A, et al. Contribution of nitrification and denitrification to N2O production in peat, clay and loamy sand soils under different soil moisture conditions[J]. Nutrient Cycling in Agroecosystems, 2004, 70(2): 135–141. DOI: 10.1023/B:FRES.0000048475.81211.3c |
| [39] | 徐杰, 石维, 同延安. 不同氮肥形态对土壤释放N2O的影响[J]. 土壤通报, 2009, 40(2): 325–330. |
| [40] | KOOL D M, DOLFING J, WRAGE N, et al. Nitrifier denitrification as a distinct and significant source of nitrous oxide from soil[J]. Soil Biology and Biochemistry, 2011, 43(1): 174–178. DOI: 10.1016/j.soilbio.2010.09.030 |
| [41] | MAȊTRE V, COSANDEY A C, DESAGHER E, et al. Effectiveness of groundwater nitrate removal in a river riparian area:the importance of hydrogeological conditions[J]. Journal of Hydrology, 2003, 278(1-4): 76–93. DOI: 10.1016/S0022-1694(03)00134-3 |
| [42] | 孙英杰, 吴昊, 王亚楠. 硝化反硝化过程中N2O释放影响因素[J]. 生态环境学报, 2011, 20(2): 384–388. |
| [43] | 续勇波, 蔡祖聪. 亚热带土壤氮素反硝化过程中N2O的排放和还原[J]. 环境科学学报, 2008, 28(4): 731–737. |
| [44] | 娄焕杰, 邓焕广, 王东启, 等. 上海城市河岸带土壤反硝化作用研究[J]. 环境科学学报, 2013, 33(4): 1118–1126. |
| [45] | WEIER K L, MACRAE I C, MYERS R J K. Denitrification in a clay soil under pasture and annual crop:estimation of potential losses using intact soil cores[J]. Soil Biology and Biochemistry, 1993, 25(8): 991–997. DOI: 10.1016/0038-0717(93)90145-2 |
| [46] | 孙志高, 刘景双, 于君宝, 等. 湿地土壤NH3挥发、N2O释放过程及影响因素[J]. 湿地科学, 2008, 6(3): 429–439. |
| [47] | 孙志高, 牟晓杰, 王玲玲. 滨海湿地生态系统N2O排放研究进展[J]. 海洋环境科学, 2010, 29(1): 159–164. |
| [48] | JANZEN H H. Soil carbon:a measure of ecosystem response in a changing world[J]. Canadian Journal of Soil Science, 2005, 85(4): 467–480. |
| [49] | 柯韵, 杨红薇, 王小国, 等. 紫色土坡耕地退耕还林对土壤N2O排放的影响[J]. 农业环境科学学报, 2015, 34(7): 1398–1406. DOI: 10.11654/jaes.2015.07.024 |
| [50] | SCHULTHESS R V, WILD D, GUJER W. Nitric and nitrous oxides from denitrifying activated sludge at low oxygen concentration[J]. Water Science and Technology, 1994, 30(6): 123–132. |
| [51] | 于萍萍, 张进忠, 林存刚. 农田土壤N2O排放过程影响因素研究进展[J]. 环境与可持续发展, 2006(5): 20–22. |
| [52] | SCHAUFLER G, KITZLER B, SCHINDLBACHER A, et al. Greenhouse gas emissions from European soils under different land use:effects of soil moisture and temperature[J]. European Journal of Soil Science, 2010, 61(5): 683–696. DOI: 10.1111/j.1365-2389.2010.01277.x |
| [53] | BATEMAN E J, BAGGS E M. Contributions of nitrification and denitrification to N2O emissions from soils at different water-filled pore space[J]. Biology and Fertility of Soils, 2005, 41(6): 379–388. DOI: 10.1007/s00374-005-0858-3 |
| [54] | 郑有飞, 石春红, 吴芳芳, 等. 土壤微生物活性影响因子的研究进展[J]. 土壤通报, 2009, 40(5): 1209–1214. |
| [55] | 黄益忠, 冯宗炜, 张福珠. 农田氮损失及其阻控对策研究[J]. 中国科学院研究生院学报, 2000, 17(2): 49–58. |
| [56] | RYDEN J C. Denitrification loss from a grassland soil in the field receiving different rates of nitrogen as ammonium nitrate[J]. Journal of Soil Science, 1983, 34(2): 355–365. DOI: 10.1111/ejs.1983.34.issue-2 |
| [57] | 赵振达, 张金盛, 任顺荣. 旱地土壤中氮的挥发损失[M]//中国土壤学会. 我国土壤氮素研究工作的现状与展望——中国土壤学会土壤氮素工作会议论文集. 北京: 科学出版社, 1986: 46-54. |
| [58] | CASEY R E, TAYLOR M D, KLAINE S J. Localization of denitrification activity in macropores of a riparian wetland[J]. Soil Biology and Biochemistry, 2004, 36(4): 563–569. DOI: 10.1016/j.soilbio.2003.11.003 |
| [59] | 徐华, 邢光熹, 蔡祖聪, 等. 土壤水分状况和质地对稻田N2O排放的影响[J]. 土壤学报, 2000, 37(4): 499–505. DOI: 10.11766/trxb199906010409 |
| [60] | MA W K, BEDARD-HAUGHN A, SICILIANO S D, et al. Relationship between nitrifier and denitrifier community composition and abundance in predicting nitrous oxide emissions from ephemeral wetland soils[J]. Soil Biology and Biochemistry, 2008, 40(5): 1114–1123. DOI: 10.1016/j.soilbio.2007.12.004 |
| [61] | MERINO A, PÉREZ-BATALLÓN P, MACIÍAS F. Responses of soil organic matter and greenhouse gas fluxes to soil management and land use changes in a humid temperate region of southern Europe[J]. Soil Biology and Biochemistry, 2004, 36(6): 917–925. DOI: 10.1016/j.soilbio.2004.02.006 |
| [62] | WIJLER J, DELWICHE C C. Investigations on the denitrifying process in soil[J]. Plant and Soil, 1954, 5(2): 155–169. DOI: 10.1007/BF01343848 |
| [63] | KIM P J S, KIM S J, LEE B H. Effect of Alcaligenes faecalis on nitrous oxide emission and nitrogen removal in three phase fluidized bed process[J]. Journal of Environmental Science and Health, 2004, 39(7): 1791–1804. DOI: 10.1081/ESE-120037878 |
| [64] | BYRNES B H. Environmental effects of N fertilizer use-an overview[J]. Fertilizer Research, 1990, 26(1-3): 209–215. DOI: 10.1007/BF01048758 |
| [65] | 杨云, 黄耀, 姜纪峰. 土壤理化特性对冬季菜地N2O排放的影响[J]. 农村生态环境, 2005, 21(1): 7–12. |
| [66] | WRAGE N, VELTHOF G L, VAN BEUSICHEM M L, et al. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology and Biochemistry, 2001, 33(12-13): 1723–1732. DOI: 10.1016/S0038-0717(01)00096-7 |
| [67] | ZHENG H, HANAKI K, MATSUO T. Production of nitrous oxide gas during nitrification of wastewater[J]. Water Science & Technology, 1994, 30(6): 133–141. |
| [68] | VANDERBORGHT J P, WOLLAST R, LOIJENS M, et al. Application of a transport-reaction model to the estimation of biogas fluxes in the Scheldt estuary[J]. Biogeochemistry, 2002, 59(1-2): 207–237. |
| [69] | XUE D, GAO Y M, YAO H Y, et al. Nitrification potentials of Chinese tea orchard soils and their adjacent wasteland and forest soils[J]. Journal of Environmental Sciences, 2009, 21(9): 1225–1229. DOI: 10.1016/S1001-0742(08)62408-0 |
| [70] | 熊舞, 夏永秋, 周伟, 等. 菜地氮肥用量与N2O排放的关系及硝化抑制剂效果[J]. 土壤学报, 2013, 50(4): 743–751. |
 2017,Vol. 13
2017,Vol. 13

